递增负荷运动对SD大鼠股骨和腰椎最大载荷的影响
杜艳艳 郑陆 王超
首都体育学院(北京 100088)
大量研究证实,合理的运动负荷有助于骨量增加[1,2]和骨力学性能改善[3,4]。但对于某些特殊人群,尤其是专业运动员,因长期超负荷运动,可能出现体内雌激素水平下降[5],骨密度降低[6]及应力性骨折等负面效应[7,8]。我们前期建立的递增负荷运动骨量降低动物模型[9]显示,随着递增负荷运动的进行,SD大鼠骨密度发生显著变化。骨的生物力学性能由骨质量、骨密度、骨的几何分布(结构)以及微结构的完整程度四者共同决定[10],评价指标可以分为结构力学性能指标和材料力学性能指标,其中,最大载荷主要反映骨抵抗破坏的能力,是反映骨生物力学性能的主要指标之一。为了探究递增负荷运动导致骨量降低SD大鼠股骨和腰椎抵抗骨折能力的变化,本研究分别对造模同期大鼠的左股骨和第二腰椎进行三点弯试验和压力试验[11],并进行运动组与对照组间的横向和各组自身的纵向比较,为探讨长期递增负荷运动与骨最大载荷变化的关系和机制提供实验依据。
1 材料与方法
1.1 实验对象
170只(体重 275.27±20.674g)未交配的 3月龄健康SD雌性大鼠(采购并饲养于北京维通利华实验动物技术有限公司[动物许可证SCXK(京)2006-0008,实验环境许可证 SYXK(京)2006-0025)],采用分笼、自由进食饮水的饲养方式,喂食国家标准啮齿类动物常规饲料,环境温度18~24℃,相对湿度45~55%。
1.2 实验分组
进行为期一周的适应性训练后,将大鼠随机分为基础对照组(Co,n=10),递增负荷训练组(T2W,T4W,T6W,T8W,T9W,T11W,T13W与T15W,各10只)和各训练周期的对照组(C2W,C4W,C6W,C8W,C9W,C11W,C13W与 C15W,各 10 只)。
1.3 训练方案
参照Bedford[12]的动物耐力运动负荷标准以及郑陆等[13]的前期相关研究制定递增负荷运动方案,具体如表1。利用杭州段式(PT2000型)跑台,每周运动6天,休息1天,最长训练时间为15周。

表1 本研究采用的运动方案Table 1 Training protocol in the study
1.4 骨标本的取材与制备
1.4.1 骨取材
将大鼠麻醉,抽血致死,取左股骨和第二腰椎,剔除主要肌肉,灭菌,喷洒生理盐水后以纱布包裹,装入带有标记的冻存管,保存在液氮中待用。
1.4.2 骨标本的制备
实验前将骨从液氮转放于-20℃的冰箱中,实验前半天将标本保存到4℃冰箱中解冻备用。
股骨标本的制备:将股骨上的残留肌肉及结缔组织清除干净。第二腰椎标本的制备:首先剔除椎骨上残留的肌肉,用剪刀剪去棘突,得到椎体部分,然后用手术刀切除椎盘,最后用粗、细砂纸将椎体的上下表面打磨平整且保证上下面平行。注意整个过程中适量喷生理盐水于椎体上以保持其新鲜,并尽量减少整个处理过程的时间。
1.5 测试方法
生物复合材料试验系统(MTS 858,MTS Systems Corporation,USA;南方医科大学临床解剖学研究所)。左股骨的三点弯试验(three-point bending test),加载速度v=1mm/min,最大加载位移Smax=3.5mm,测试时试件的放置如图1;第二腰椎椎体的压力试验(compressive test),加载速度v=1mm/min,最大加载位移Smax=3.5mm,测试时试件的放置如图2所示。

1.6 统计学分析
应用SPSS13.0进行数据统计,对整个研究过程中的对照组(C)和运动组(T)用 one-way ANOVA方差分析进行显著性检验(P=0.05)。
2 结果
实验大鼠在经历生长、训练、取材和测试过程中,由于受伤、死亡等客观原因,最终实际可用样本量有所变化。
2.1 股骨最大载荷的变化
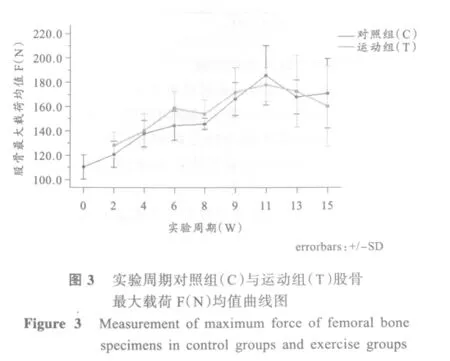
实验周期对照组与运动组股骨最大载荷的均值曲线图如图3。
2.1.1 对照组股骨最大载荷变化
表2显示,C0组股骨最大载荷 F(N)与 C4W组及后期各组大鼠均存在显著性差异(P<0.01);C2W组与其它各组均存在显著性差异(P<0.05);C4W、C6W、C8W组与C9W及其之后各组间存在显著性差异(P<0.05);C9W组与所有组间均存在显著性差异(P<0.05);C11W组与除 C15W组外的其它各组间都存在显著性差异(P<0.05);C13W组与C9W及C15W组外的各组间存在显著性差异。另外,图3显示C11W组最大载荷均值达整个研究过程的最大值。

表2 对照组间股骨最大载荷差异的显著性检验结果Table 2 Analysis of the maximum force of femoral bone specimens in all control groups by one-way ANOVA
2.1.2 运动组股骨最大载荷变化
表3显示,运动组股骨的最大载荷,T2W组与T6W及其之后的各运动组间均表现出显著性差异(P分别为0.001,0.014,0.000,0.000,0.000,0.001);T4W组与 T6W组及9周之后的各组间也都存在着显著性差异(P分别为0.043,0.002,0.001,0.001,0.032);T6W组与之 后的各组差异不显著;除T8W组与T11W组之间表现出显著性的差异之外,8周之后各组间未见显著性差异。
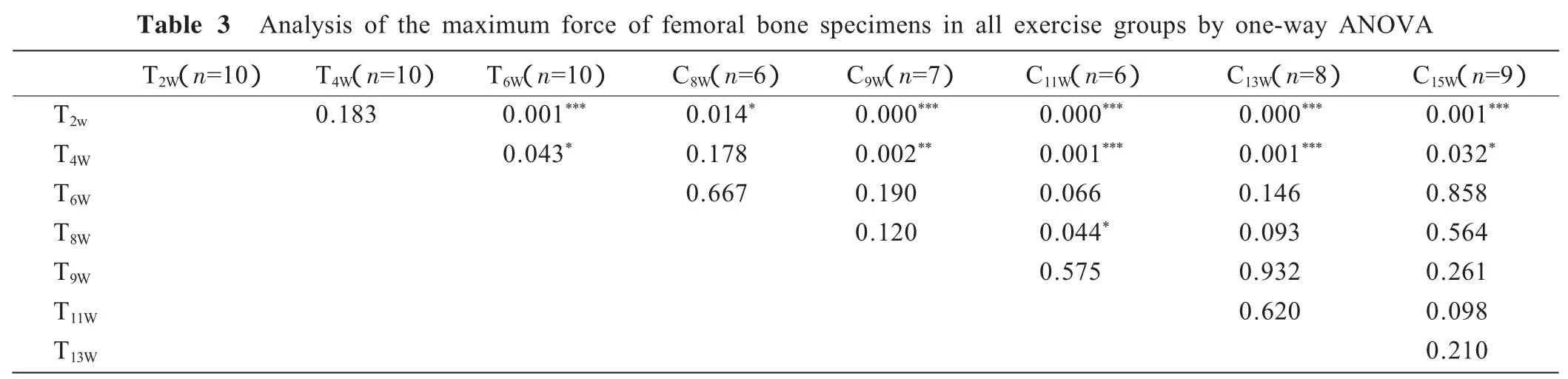
表3 运动组间股骨最大载荷差异的显著性检验结果
2.1.3 两组股骨最大载荷比较
实验周期中,对照组和运动组之间其股骨最大载荷均无显著性差异。此外,除去基础对照组,将整个研究中对照组与运动组看作两个独立样本进行独立样本t检验,结果显示两组间仍无显著性差异(P>0.05)。
2.2 腰椎最大载荷的变化
实验周期对照组与运动组第二腰椎最大载荷均值曲线图见图4。

2.2.1 对照组第二腰椎最大载荷变化
表5显示,从C8W组开始,各组第二腰椎最大载荷均与基础对照组有显著性差异(P分别为0.030,0.000,0.001,0.001,0.000),C9W组与除 C13W及 C15W组之外的各组间均存在显著性差异,9周之后各组间均未表现出显著性差异。
2.2.2 运动组第二腰椎最大载荷变化
表6显示,T9W组第二腰椎最大载荷与其之前的T2W、T4W、T6W组及之后的 T11W、T13W、T15W组均表现出显著性差异(P<0.01),同时T15W组与T11W及T13W组间也表现出了显著性差异(P分别为0.028,0.003)。
2.2.3 两组第二腰椎最大载荷比较
表7显示,实验周期中,对照组与运动组第二腰椎最大载荷比较中,C11W与 T11W,C13W与 T13W以及 C15W与 T15W之间分别有显著性差异(P分别为 0.001,0.030,0.000)。除基础对照组外,将本研究对照组和运动组看作两个独立样本进行独立样本t检验,结果显示它们的差异存在显著性(P<0.001)。
3 讨论
3.1 年龄增长过程中股骨和腰椎最大载荷的变化
据报道,3月龄大鼠内分泌系统完全发育成熟,但随着年龄的增长,在3~7月龄时大鼠的骨量陆续达到峰值,此时,皮质骨仍在增加,而松质骨则基本保持稳定,变化不大[14,15]。本研究中的动物模型恰好处在 3~7月龄峰值骨量蓄积期内,结果显示,大鼠股骨和腰椎最大载荷均呈现随年龄增长先增加后下降的显著性变化。两者不同的是,股骨在11周(6月龄)时达到峰值,第二腰椎在9周(5个半月龄)时达到峰值;达到峰值前,股骨的最大载荷增加较快,股骨和第二腰椎分别在C4W组(4个月零1周)和C8W组较其基础对照组显著提高。部分结果与已有文献报道变化趋势一致,但达到峰值的具体时程有一定差异[14,15],其原因可能与股骨为长形管状骨,而三点弯法是在忽略股骨整体几何形状的前提下,对整个股骨力学性能进行测定有关;另外实验条件的不同也可能构成差异[16]。此外,本次研究结果亦与我们同期的骨量实验结果(对照组大鼠全身骨的峰值骨量出现在6.5个月)略有差异[9]。骨量增加与其力学性能提高具有一定一致性,如骨质疏松患者骨折危险性升高与骨量的大量减少分不开,但是骨量仅是骨生物力学性能四大基本特性之一,骨的质量、骨组织结构及微结构完整程度的不同导致骨量与骨力学性能的变化并非完全同步。

表5 对照组第二腰椎最大载荷差异的显著性检验结果Table 5 Analysis for the maximum force of 2nd lumber vertebrae specimens in all control groups by one-way ANOVA
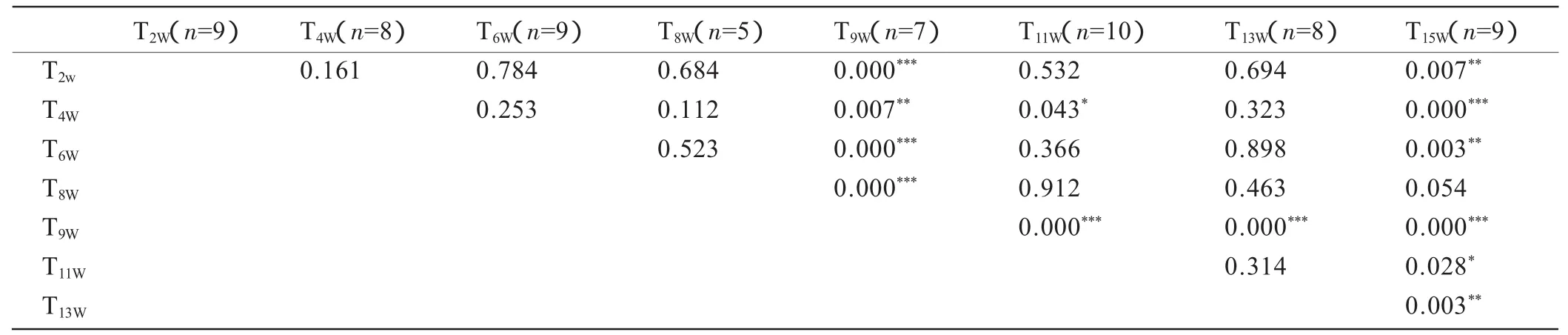
表6 运动组第二腰椎最大载荷差异的显著性检验结果Table 6 Analysis for the maximum force of 2nd lumber vertebrae specimens in all exercise groups by one-way ANOVA

表7 对照组与运动组不同实验周期第二腰椎最大载荷差异的显著性检验结果Table 7 Analysis for the maximum force of 2nd lumber vertebrae between control group and exercise group in every training cycle by one-way ANOVA
3.2 递增负荷运动与股骨和腰椎最大载荷变化的关系
在15周的实验期间内,对照组和运动组股骨和第二腰椎最大载荷均表现出一定的波动性,具体表现为波浪式上升至最大值然后下降。但不同骨、不同组别间又存在一定的差异性。2周至6周,运动组股骨及第二腰椎的最大载荷均高于同期相应对照组;9周之后股骨最大载荷逐渐低于对照组,第二腰椎则在7~8周前后即已低于同期对照组;运动组及对照组股骨及第二腰椎最大载荷分别在11周和9周达到峰值,但运动组峰值均低于对照组;除股骨T13W组高于C13W组外,股骨及第二腰椎最大载荷在达到峰值后均表现为运动组低于对照组。Frost的理论认为,力学载荷对于骨骼的作用表现为随着应变增加骨的生长相应增加,当应变达到阈值后,如果负荷继续增加,骨的生长反而减少[17]。同时,我们同期的动物模型实验结果[9]也证实,对骨骼施加超出成骨效应阈值范围的负荷,会诱导骨骼出现高代谢转换及骨吸收为主导的特征性变化。据此可知,本实验中递增负荷运动的强度及量度在实验前半时期(1~6周)对大鼠骨的生长起到了促进作用,因而表现为运动组最大载荷高于对照组;但当负荷增加至一定阶段(7周前后开始)则已超出良性范畴,出现对负荷载体——骨骼的抑制效应。因而,大鼠的骨形成作用相对减弱,骨量及骨质均发生改变,而这些变化也势必引起力学性能的相应变化。这提示对专业运动员,合理适度的运动训练将有助于其骨骼的成骨效应和力学性能的提高,超负荷的过量运动训练则可能导致相反的结果,对少年运动员尤其应该注意负荷量与个体承受能力间的相互效应关系。
已有研究表明[18],骨质疏松过程中最初表现为松质骨的骨量下降,然后皮质骨变薄,最终导致抵抗外力作用下降。本研究中,与对照组相比,腰椎最大载荷较股骨更早表现出下降;15周实验期内运动组第二腰椎最大载荷与对照组有显著性差异(P<0.001),股骨无显著性差异。但由于压力试验是对整个椎体进行的,其中皮质骨的比例过大而不能代表纯松质骨的力学特性,因此,在本实验的递增负荷方案下,第二腰椎最大载荷的变化较股骨发生得更早、更显著,而松质骨的变化则需要应用压痕试验[19,20]进一步论证。
此外,由于本研究中大鼠股骨和第二腰椎最大载荷变化发生在递增负荷运动的9~11周时段(大鼠5.5~6月龄),而我们同期的动物模型结果亦显示,在此时段运动组大鼠的全身骨密度最大[9],由此推测5.5~6月龄可能是递增负荷运动致大鼠骨质及骨量变化的关键转折点。
4 总结
SD大鼠骨的最大载荷随年龄增长出现相应变化,表现为波浪式上升至一定时期开始下降,且腰椎骨先于股骨到达峰值;递增负荷运动对SD大鼠骨的最大载荷产生的效应取决于运动强度,且腰椎较股骨更明显。
(致谢:感谢南方医科大学临床解剖学研究所、广东省医学生物力学重点实验室欧阳钧主任、赵卫东老师和梁栋柱老师在实验过程中给予的指导与支持。感谢南方医科大学孙培栋硕士、于巧莲硕士以及刘阳博士在实验期间给予的帮助。)
[1]Brewer V,Mever BM,Keele MS,et al.Role of exercise in prevention of involutional bone loss.Med Sci Sports Exer,1983,15:445.
[2]左群,于新凯,陆爱云.游泳运动对老年小鼠骨组织形态结构和生物力学性能的影响.中国运动医学杂志,2007,26(2):228-230.
[3]步斌.游泳运动对大鼠股骨和腰椎骨生物力学性能影响的研究. 体育科学,2005,25(11):55-57.
[4]Alcorn JD,Vyvial BA,Bloomfield SA,et al.Exercise improvesthe strength ofbone in the proximaltibia of hindlimb unloaded mature rats.J Biomechanics,2006,39(Supplement 1):876.
[5]Drinkwater BL,Nilson K,Chesnut CH,3rd,et al.Bone mineral content of amenorrheic and eumenorrheic athletes.N Engl J Med,1984,311(5):277-281.
[6]Nichols JF,Rauh MJ,Barrack MT,et al.Bone mineral density in female high school athletes:interactions of menstrual function and type of mechanical loading.Bone,2007,41(3):371-377.
[7]Joy EA and Campbell D.Stress fractures in the female athlete.Curr Sports Med Rep,2005,4(6):323-328.
[8]Braam LA,Knapen MH,Geusens P,et al.Factors affecting bone loss in female endurance athletes:a two-year follow-up study.Am J Sports Med,2003,31(6):889-895.
[9]陈晓红,郑陆,王智强.过度运动致骨量降低动物模型的建造. 中国运动医学杂志,2009,28(6):667-671.
[10]邓红文,刘耀中.骨生物学前沿.北京:高等教育出版社,2006.116-121.
[11]Turner CH,Burr DB.Basic biomechanical measurements of bone:a tutorial.Bone,1993,14:595-608.
[12]Bebforf TG,Tipton CM,Wilson NC,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures.J Appl Physiol,1979,47(6):1278-1283.
[13]郑陆,潘力平,隋波,等.运动性动情周期紊乱动物模型的建立. 山东体育学院学报,2005,21(2):46-49,59.
[14]刘钰瑜.骨质疏松动物模型的研究进展.中国临床药理学与理疗学,2002,7(6):570-573.
[15]Jee WSS.The aged rat model for bone biology studies.J Cells and Materials (Supplement 1),Scanning Microscope Internation,Chicago,1991:25-29.
[16]邓雪梅,刘跃,谢力勤.不同加载速度对大鼠骨生物力学特性的影响. 中国骨质疏松杂志,1999,5(1):8,9,21.
[17]Frost HM.Strain and other mechanical influences on bone strength and maintenance.Curr Opin Orthop,1997,8:60-70.
[18]Pak CYC,Sskhaee K,Beu NH.Comparison of nonrandomized rails with slow release odium fluoride with a randomized placebo on rolled trialin postmenopausal osteoporosis.J Bone Miner Res,1996,11:160-166.
[19]章晓霜,许豪文,赵卫东.不同强度运动和雌激素联合作用对去卵巢大鼠骨骼生物力学性能的影响.中国运动医学杂志,2006,25(2):187-191.
[20]杜艳艳,郑陆,杨俊卿.压痕试验法研究递增负荷训练队大鼠松质骨生物力学性能的影响.首都体育学院学报,2009,21(4):457-461.

