透明质酸钠对大鼠成肌细胞体外成骨分化的影响
张玉强,李游,王岩峰,王伟,吕刚
(1.中国医科大学附属第一医院骨科,沈阳 110001;2.中国医科大学附属盛京医院眼科,沈阳 110004;3.锦州市中心医院骨科,辽宁锦州 121001;4.辽宁医学院附属第一医院骨科,辽宁 锦州 121001)
透明质酸钠对大鼠成肌细胞体外成骨分化的影响
张玉强1,李游2,王岩峰1,王伟3,吕刚4
(1.中国医科大学附属第一医院骨科,沈阳 110001;2.中国医科大学附属盛京医院眼科,沈阳 110004;3.锦州市中心医院骨科,辽宁锦州 121001;4.辽宁医学院附属第一医院骨科,辽宁 锦州 121001)
目的研究透明质酸钠对成肌细胞体外成骨诱导分化的影响。方法 运用差速贴壁法和(或)酶消化法分离纯化的大鼠成肌细胞,将培养至第3代的细胞分为:(1)实验组:采用含0.1%的透明质酸钠和500ng/mL的重组人骨形态发生蛋白2(rhBMP-2)的培养基进行培养;(2)对照组:以含500ng/mL rhBMP-2的培养基进行培养。观察诱导过程中成肌细胞形态变化。第3周时对其进行成骨指标检测(碱性磷酸酶活性,I型胶原免疫组化,茜素红和碱性磷酸酶的钙结节染色)。结果 实验组和对照组成肌细胞在诱导过程中形态学改变相似。实验组和对照组碱性磷酸酶活性均升高,2组间差异无统计学意义,I型胶原免疫组化均呈阳性,茜素红和碱性磷酸酶染色均可见大量钙结节。结论透明质酸钠不抑制成肌细胞体外成骨分化,与成肌细胞具有良好的生物相容性。
透明质酸钠;成肌细胞;骨形态发生蛋白
研究证实,透明质酸钠与成肌细胞具有良好的生物相容性[1~8],对体外培养成肌细胞无明显影响,是成肌细胞良好的载体材料[5,6]。也有研究认为,透明质酸钠在促进成肌细胞增殖时,抑制成肌细胞分化融合为肌小管[1,3]。透明质酸钠是否抑制成肌细胞向成骨前体细胞方向分化目前尚不清楚。本研究拟在成肌细胞诱导分化为成骨前体细胞过程中加入透明质酸钠,观察其是否影响成肌细胞的体外成骨诱导分化。
1 材料与方法
1.1 材料
1.1.1 实验动物:新生1周的SD大鼠[由辽宁医学院实验动物中心提供,动物质量合格证号:SCXK(辽)2003-0007],实验过程中对动物的处置符合动物伦理学标准。
1.1.2 主要试剂:DMEM培养基、胰蛋白酶(Gibco公司),胎牛血清(杭州四季清生物工程材料有限公司),Dispase、CollagenaseⅡ、L-谷氨酰胺、重组人骨形态发生蛋白2(recombination of human bone morphogenetic protein-2,rhBMP-2) (Sigma 公 司 ),Desmin抗体、Ⅰ型胶原抗体(博士德生物工程有限公司),茜素红(北京拜尔笛生物工程有限公司),碱性磷酸酶(alkaline phosphatase,ALP)染液(南京建成生物工程研究所)。
1.2 方法
1.2.1 细胞分离、培养及纯化:取大鼠下肢骨骼肌1cm×1cm×1cm,参照文献[9,10]的方法,采用混合酶消化分离成肌细胞,差速贴壁法进行纯化。将纯化的成肌细胞接种于培养瓶,置37℃,5%CO2孵箱继续培养。常规换液,传代至第3代备用。
1.2.2 细胞鉴定:将成肌细胞接种于置有消毒盖玻片的6孔板内,待细胞于盖玻片上贴壁达70%~80%,按免疫组化步骤进行Desmin染色,胞质内有棕黄色颗粒者为阳性,以PBS为一抗作阴性对照。
1.2.3 透明质酸钠对成肌细胞成骨分化的影响:将上述第3代成肌细胞接种于置有消毒盖玻片的12孔板内,待细胞融合达70%~80%时,进行成骨诱导。将细胞随机分为:(1)实验组:加入含0.1%透明质酸钠和500ng/mL rhBMP-2的培养基(82%高糖DMEM+15%胎牛血清+2%双抗+1%L-谷氨酰胺);(2)对照组:加入含500ng/mL rhBMP-2的培养基。隔日换液,观察细胞形态学变化。参照文献[9]的结果,在第3周时对其进行成骨鉴定,包括应用酶标仪对2组诱导细胞进行碱性磷酸酶活性测定,Ⅰ型胶原免疫组化染色,茜素红和碱性磷酸酶染色。
2 结果
2.1 细胞培养及鉴定
原代培养的成肌细胞呈梭形,至培养的第5~7日,相邻细胞开始彼此融合,并逐渐形成肌管,继续培养,可观察到有节律收缩的肌管。Desmin的细胞免疫组织化学染色呈阳性,胞质内可见大量棕黄色颗粒,胞核蓝染。见图1,2。
2.2 透明质酸钠对成肌细胞成骨分化的影响
2.2.1 细胞形态学观察:在培养的前7d,胞质均无明显变化,但实验组可见少量相邻细胞融合,对照组相互融合细胞明显增多;第14天时,2组细胞的胞质内可见少量折光性物质,实验组相邻细胞融合较对照组少;第21天时,2组细胞胞质内均可见大量折光性物质,对照组相邻细胞融合较实验组多。提示含0.1%透明质酸钠的诱导培养基组细胞融合率低于单纯诱导培养基组。见图3。

2.2.2 成骨鉴定结果:(1)ALP活性测定:结果显示,随着诱导时间的延长,2组细胞表达ALP的活性均增强,但对照组与实验组总体平均值之间差异无统计学意义。见表1。
(2)Ⅰ型胶原的免疫组化:对rhBMP-2诱导3周的成肌细胞行Ⅰ型胶原免疫细胞化学染色,见2组细胞胞质中均出现棕黄色颗粒沉淀,表明Ⅰ型胶原染色呈阳性,见图4。
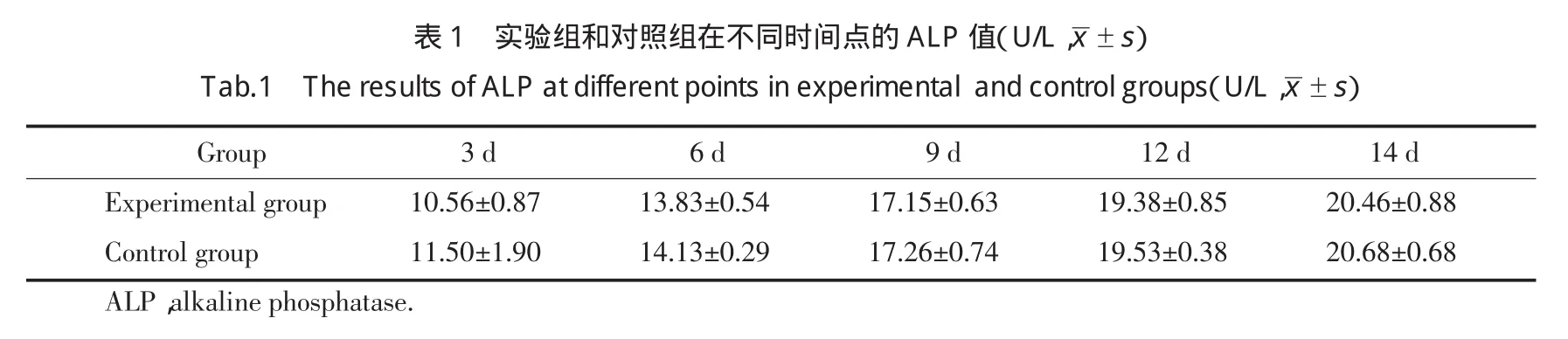
表1实验组和对照组在不同时间点的A L P值(U/L,±s)T a b.1T h e r e s u l t s o f A L Pa t d i f f e r e n t p o i n t s i n e x p e r i me n t a l a n d c o n t r o l g r o u p s(U/L,±s)Group 3d 6d 9d 12d 14d Experimental group 10.56±0.87 13.83±0.54 17.15±0.63 19.38±0.85 20.46±0.88Control group 11.50±1.90 14.13±0.29 17.26±0.74 19.53±0.38 20.68±0.68ALP,alkaline phosphatase.

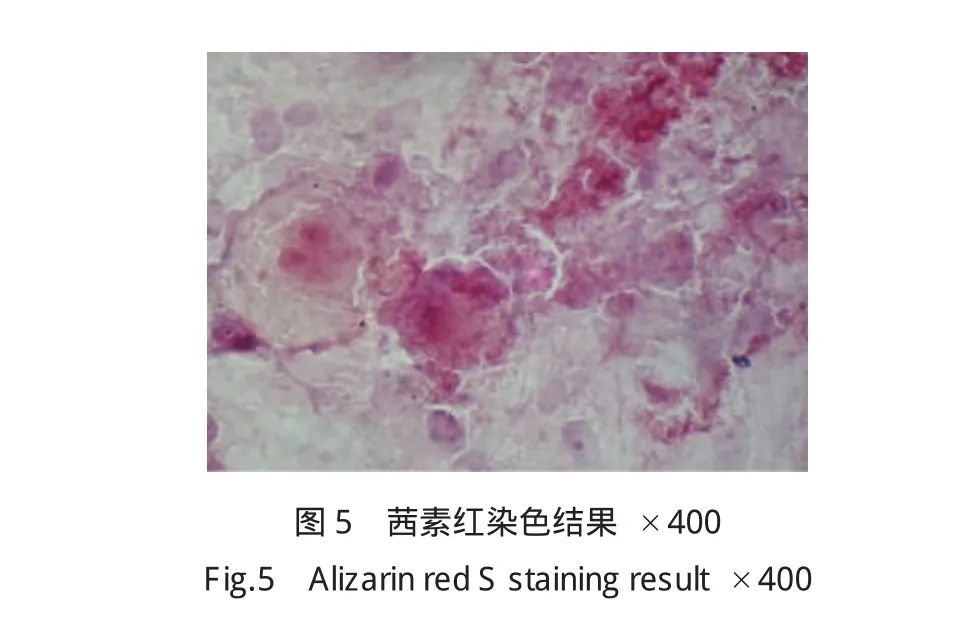
(3)茜素红染色:应用茜素红S对rhBMP-2诱导3周的2组成肌细胞染色,均可见胞质内形成大量红色沉淀,表明胞质内均有钙结节形成,见图5。
(4)ALP染色:应用ALP试剂盒对rhBMP-2诱导3周的细胞进行染色,可见胞质中有大量黑色颗粒,实验组与对照组无明显差异,见图6。

3 讨论
透明质酸钠作为一种生物活性物质,具有高度黏弹性、可塑性、渗透性、独特的流变学特性以及良好的生物相容性。研究显示,透明质酸钠对成肌细胞的增殖和分化均有影响。Kujawa等[1]发现透明质酸钠可促进成肌细胞增殖,同时抑制体外培养的成肌细胞融合形成肌管。Yoshimura等[2]认为透明质酸钠的抑制作用可逆,去除外源性透明质酸钠后融合功能恢复。张斌等[3,4]证实透明质酸钠能加速成肌细胞增殖,使细胞较早进入对数增殖期,倍增和峰值出现时间均显著提前,细胞增殖幅度加大,衰退现象减缓。本研究结果发现,加入了含透明质酸钠与rhBMP-2的实验组与仅加入rhBMP-2的对照组中成肌细胞均有融合,但实验组较对照组细胞融合少。rhBMP-2属于转化生长因子家族,具有很强的细胞黏附能力。我们推测,实验组和对照组肌管形成差异的原因可能是对照组中加入的外源性rhBMP-2促进了成肌细胞聚集,导致肌管形成较多,而实验组加入的rhBMP-2可能削弱了透明质酸钠对成肌细胞融合的抑制作用。
目前,将透明质酸钠用于诱导细胞成骨的实验研究很多且效果显著。林在俊等[7]在研究透明质酸钠对rhBMP-2转染的羊骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)增殖、分化的影响时发现,透明质酸钠与BMSCs具有较好的相容性,一定浓度的透明质酸钠能促进BMSCs的增殖,对BMSCs向成骨细胞的分化也有一定的促进作用。另外,Crouzier等[8]在将透明质酸钠与 rhBMP-2用于诱导C2C12成肌细胞向成骨细胞分化的研究中发现,透明质酸钠可延长rhBMP-2的生物学活性。本研究将0.1%的透明质酸钠加入含rhBMP-2的成骨诱导培养基中诱导成肌细胞,观察到有大量钙结节形成,表明透明质酸钠并不抑制成肌细胞向成骨方向分化。Kawan等[11]研究证实,透明质酸钠通过阻断rhBMP-2受体拮抗物分泌型多肽头蛋白和卵泡抑素表达,抑制细胞外信号调节激酶(extracellular signal-regulated protein kinase,ERK)磷酸化,促进人成骨肉瘤细胞MG63的成骨分化。本研究观察到透明质酸钠可促进成肌细胞的成骨分化,其机制可能是透明质酸钠与rhBMP-2发挥协同作用促进了成肌细胞的成骨分化,而碱性磷酸酶活性检测、Ⅰ型胶原的免疫组化、茜素红染色、碱性磷酸酶染色结果显示对照组和实验组无显著差异,其原因可能与本研究未采用蛋白印迹、聚合酶链式反应和荧光定量等更灵敏的检测方法有关。
综上所述,一定浓度的透明质酸钠并不抑制体外培养的成肌细胞向成骨细胞方向分化,透明质酸钠与成肌细胞具有良好的生物相容性,可作为成肌细胞培养的理想载体。
[1]Kujawa MJ,Pechak DG,Fiszman MY,et a1.Hyaluronic acid bonded to cell culture surfaces inhibits the program of myogenesis [J].Dev Biol,1986,113(1):10-16.
[2]Yoshimura M.Change of hyaluronic acid synthesis during differentiation of myogenic cells and its relation to transformation of myoblasts by Rous sarcoma virus[J].Cell Differ,1985,16(3):175-185.
[3]张斌,黄富国,解慧琪,等.透明质酸钠对大鼠成肌细胞增殖和分化的影响[J].中国修复重建外科杂志,2006,20(7):747-750.
[4]黄富国,张斌,杨志明.改良载体提高大鼠成肌细胞移植效率[J].中国临床康复,2006,10(25):34-36.
[5]Wang W,Fan M,Zhang L,et al.Compatibility of hyaluronic acid hydrogel and skeletal muscle myoblasts [J].Biomed Mater,2009,4(2):025011.
[6]王伟,范明,张力,等.透明质酸凝胶在成肌细胞体外培养中的应用[J].解剖科学进展,2007,13(3):215-218.
[7]林在俊,朱振安,孟凡琳,等.透明质酸对BMP-2转染的羊BMSCs增殖、分化的影响[J].临床骨科杂志,2007,10(4):344-347.
[8]Crouzier T,Szarpak A,Boudou T,et al.Polysaccharide-blend multilayers containing hyaluronan and heparin as a delivery system for rhBMP-2[J].Small,2010,6(5):651-662.
[9]张玉强,王伟,范明,等.体外诱导大鼠成肌细胞转化为成骨前体细胞的实验研究[J].军事医学科学院院刊,2009,33(1):14-17.
[10]张力,范明,王伟,等.改良法体外培养大鼠成肌细胞的实验研究[J].军事医学科学院院刊,2007,31(1):62-65.
[11]Kawano M,Ariyoshi W,Iwanaga K,et al.Mechanism involved in enhancement of osteoblast differentiation by hyaluronic acid[J].Biochem Biophys Res Commun,2011,405(4):575-580.
(编辑王又冬,英文编辑刘宝林)
Effect of Sodium Hyaluronate on In Vitro Osteoplastic Differentiation of Rat’s Myoblasts
ZHANG Yu-qiang1,LI You2,WANG Yan-feng1,WANG Wei3,L譈 Gang4
(1.Department of Orthopedics,The First Hospital,China Medical University,Shenyang 110001,China;2.Department of Ophthalmology,Shengjing Hospital,China Medical University,Shenyang 110001,China;3.Department of Orthopedics,Central Hospital of Jinzhou,Jinzhou 121001,China;4.Department of Orthopedics,The First Affiliated Hospital,Liaoning Medical College,Jinzhou 121000,China)
ObjectiveTo investigate the effects of sodium hyaluronate solution on the osteoplastic differentiation of rat’s myoblasts.MethodsThe minced muscles were digested with mixed digestive juices,followed by the isolation,culture and purification of the myoblasts.The third subculture myoblasts were cultured in two growth media,in which experimental group containing 0.1%sodium hyaluronate and 500ng/mL rhBMP-2,the control group containing 500ng/mL rhBMP-2,respectively.The morphological change of induced myoblasts in each medium was observed carefully.Three weeks later,a series of examination were performed,including:ALP activity,typeⅠcollagen immunohistochemistry,and new calcifying nodules staining with Alizarin red S and ALP.ResultsThe morphological change in each medium was similar during the induced process.There was a difference between the two groups on ALP activity,but the ALP activity increased and there was no statistic difference(P>0.05).The immunohistochemistry of typeⅠcollagen was positive,a great quantity of new calcifying nodules was seen by the staining of Alizarin red S and ALP.ConclusionSodium hyaluronate could not inhibit the osteoplastic differentiation of rat’s myoblasts in vitro,it could be a proper media for myoblasts.
sodium hyaluronate;myoblasts;bone morphogenetic protein
R318.08
A
0258-4646(2011)05-0408-04
doiCNKI:21-1227/R.20110523.1816.030
http://www.cnki.net/kcms/detail/21.1227.R.20110523.1816.030.html
张玉强(1981-),男,博士研究生.
吕刚,E-mail:lvgang@lnmu.edu.cn
2010-11-29
网络出版时间:2011-05-1815:25
·短篇论著·

