一株玉米弯孢叶斑病菌生长缓慢型突变株获得及T-DNA右翼序列分析
刘铜,薛文波,侯巨梅,左豫虎
(黑龙江八一农垦大学农学院,大庆163319)
由新月弯孢(Curvularia lunata)引起的玉米弯孢叶斑病是我国玉米上发生普遍的重要叶部病害[1-4]。尽管近年来随着针对该病原菌的具有热带和亚热带血缘的抗性品种的选育和推广应用,该病害的危害程度明显降低,然而人们研究发现该病原菌致病性变异或生理分化现象非常明显[5-8],具有潜在大发生的可能,因此深入研究该病原菌的致病和生长发育的调控分子机制,对于创建持久的防控措施,稳定国家玉米生产安全具有重要意义。
目前对该菌致病机理的研究主要集中在细胞壁降解酶、黑色素和毒素等致病因子的鉴定及合成相关基因的克隆与功能鉴定[9-11]。然而对该菌生长发育调控研究鲜有报道。植物病原真菌的生长速度影响其在寄主体内的扩展与蔓延,从而在一定程度上影响病害的发展进程。因此,通过对病原菌生长发育的分子机理的研究,将可以加深对该病原菌生长发育调控的认识,也可能为开发能够抑制病原菌发展的新型制剂提供一些新的靶位点。从而拓宽人们对病原菌防治的视野。本实验通过农杆菌介导的方法获得一个生长缓慢的突变体,利用接头PCR技术获得该突变体T-DNA右翼序列,这将为下一步克隆该基因,从分子水平上研究控制病原菌生长的分子机理奠定基础。
1 材料与方法
1.1 转化材料与质粒
将野生型弯孢叶斑病菌CX-3置28℃黑暗培养3 d后收集其分生孢子,配制成浓度为104个·mL-1的弯孢分生孢子悬浮液,然后涂布在玻璃纸上,在30℃黑暗条件下培养6 h后做转化受体材料。用于ATMT转化的农杆菌质粒pBHt-1(AGL-1)为转化供体。
1.2 农杆菌转化
农杆菌转化参照刘铜等[12]方法操作,取含有双元载体的农杆菌株接到含有100μg·mL-1潮霉素的5 mL LB液体培养基中,28℃下震荡培养至对数生长期,得到OD660=0.6的农杆菌菌液;然后取农杆菌菌液250μL,加到新鲜的5 mL LB液体培养基中,28℃下振荡培养过夜至对数生长期,然后在液体IM培养基上诱导培养6 h,将农杆菌菌液浓度调至OD660=0.2备用。
取诱导后的农杆菌菌液与萌发分生孢子悬浮液等体积混合,涂布于IM(10 mM glucose)固体培养基的玻璃纸上,在黑暗条件下培养数小时,然后将IM固体培养基上的玻璃纸转移到含有200μg·mL-1的头孢霉素和潮霉素的PDA平板培养基上筛选转化子;将平板培养基在28℃下培养7 d,将能够抗潮霉素的弯孢霉菌落转移到预先倒好的含有200μg·mL-1潮霉素的固体PDA培养基上进行2次筛选,第2次筛选得到抗潮霉素的玉米弯孢霉菌落即为转化子。
1.3 转化子遗传稳定性检测
把筛选到的第二代抗性转化子转接到不含潮霉素的PDA上,置28℃下继续培养5代后,再转接到含有潮霉素PDA上培养,检测转化子对潮霉素的抗性。
1.4 PCR检测与杂交分析
CTAB法提取基因组DNA,其方法参见文献[12]。PCR反应体系(50μL):Premix Taq 25μL,DNA模板1μL,引物hyg-F:5`-CGACAGCGTCTCCGACCTGA-3`和hyg-R:5`-CGCCCAAGCTGCATCATCGAA-3`各2μL,ddH2O 18μL。PCR扩增条件:94℃ 5 min,94℃1 min,55℃45 s,72℃1 min,共29循环;1.0%琼脂糖电泳检测。杂交分析根据 Southern blotting试剂盒操作说明进行,用HindⅢ酶切过夜,以上述扩增回收的潮霉素基因片段标记为探针。
1.5 生长速度测定
取在筛选培养基上生长速度有明显变化的转化子,用直径0.5 cm的打孔器在长满菌丝PDA平板上打孔,取菌落边缘生长良好、无污染的菌丝块,将菌块分别倒置转接于直径9 cm PDA培养基的培养皿中央,置28℃培养2 d后,按照十字交叉法每隔1 d测量菌落直径,每个菌株重复3次,计算菌落的生长速度。
1.6 产孢能力测定
将野生型菌株和突变体菌株置28℃黑暗培养15 d后,加入20 mL无菌水,用干净的玻璃片把孢子刮下,用擦镜纸过滤除去菌丝,定容到50 mL;然后通过血球计数板计数,实验重复5次。孢子浓度计算公式:孢子的浓度(个·mL-1)=5个中格孢子总数×5×105。
1.7 离体叶片致病力测定
用直径0.5 cm的打孔器把突变体打成菌块,转接到PDA培养基上,培养7 d后用双蒸水洗下孢子,将孢子悬浮液浓度调制为107孢子·mL-1。剪取健康无病的5叶期玉米自交系黄早四幼苗的第4位叶片,用刀片切成长2×2 cm的小块放在平铺滤纸浸入60mg·L-1的6-BA保湿培养皿中,然后在叶片上滴10μL孢子悬浮液,在25℃光照培养箱中培养72 h,观察叶片坏死反应,以野生型为阳性对照,清水处理为阴性对照,每次处理12块叶片,实验重复处理3次。
1.8 T-DNA右翼序列分析
用EcoRⅠ、HindⅢ、PstⅠ、SalⅠ和XbaⅠ酶切转化子基因组,其酶切体系50μL如下:基因组20μg;限制性内切酶5μL;10×buffer 5μL;用无菌水定容至50μL;然后在37℃酶切过夜,酶切后用琼脂糖凝胶电泳检测酶切效果。如果酶切充分后,加入1/10体积醋酸铵和2-2.5体积乙醇,在-20℃沉淀30 min,置4℃8 000 rpm离心10min,弃上清,沉淀用70%乙醇清洗两次后真空干燥。最后将沉淀溶于10μL的无菌水中,进行接头连接。根据T-DNA右边界序列设计一对特异引物S1和S2,分别与接头引物C1,C2经过2次特异PCR扩增。回收第2次PCR产生特异性条带,然后将目标片断与Ti载体连接,挑取阳性克隆进行测序。
2 结果与分析
2.1 生长缓慢型突变体的获得
经过ATMT转化5-7 d后,从筛选培养基可以获得转化子菌落,而在不含质粒的对照处理培养基上不能形成抗潮霉素的菌落(图1)。

图1 农杆菌介导的弯孢菌转化Fig.1 Agrobacterium-Mediated transformants of C.lunata
将抗性突变体进行稳定分析后转移到不含抗生素的PDA培养基生长,发现一个生长相当缓慢的突变体。将该突变体和野生型菌株分别接到新鲜的PDA培养基上,25℃培养7 d后观察突变体和野生型菌株在菌落形态差异,结果发现突变体菌落小,菌落边缘整齐,菌丝致密,其产孢量是野生型菌株18%。为了精确比较突变体与野生型菌株在生长速度上的差异,在PDA上培养2 d后,每隔一天进行菌落大小的测定,结果表明突变体生长速度是野生型菌株42%(图2)。
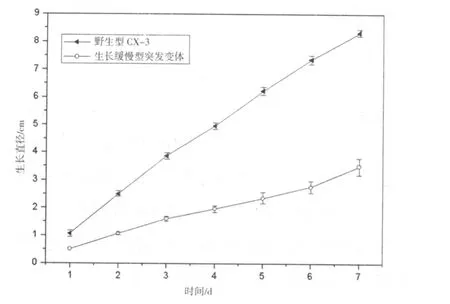
图2 野生型CX-3与生长缓慢型突变体生长曲线图Fig.2 Growth Curve figure ofwild type CX-3 and growth-slow mutant
2.2 生长缓慢的突变体的分子鉴定
通过CTAB法提取野生型菌株CX-3及其生长缓慢的突变体的总DNA,根据已知潮霉素基因hyg-F和hyg-R引物,对突变株进行了PCR检测。结果突变株能扩增出抗潮霉素基因的谱带(811 bp),而出发菌CX-3没有扩增出抗潮霉素基因的谱带,说明质粒pBHt1中的T-DNA已成功插入突变株中(图3)。Southern blotting杂交结果表明T-DNA以单拷贝形式插入到病原菌的基因组中(图4)。

图3 潮霉素基因PCR检测图Fig.3 PCR analysis of a slow-growthmutant
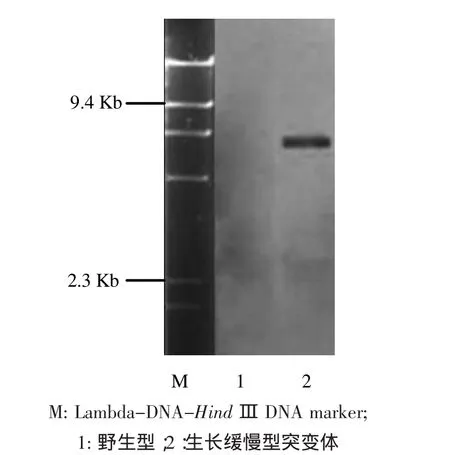
图4 Southern blotting杂交图Fig.4 Hybridization figure of Southern blotting
2.3 生长缓慢的突变体的产孢量测定
对获得性状稳定的生长缓慢突变体与野生型产孢量的测定,发现野生型产孢量平均值为2.2×106孢子·mL-1,而生长缓慢型突变体产孢量为4×105孢子·mL-1,生长缓慢型突变体产孢量是野生型CX-3的18%,明显低于野生型。
2.4 生长缓慢的突变体的致病力测定
滴有野生型菌株CX-3和突变体叶片经过72 h后培养后,其接种叶片都产生明显的褐色坏死斑,清水对照无明显病斑,结果表明生长缓慢型突变体的致病力,与野生型比较,在玉米叶片的致病力没有差异(图5),说明病原菌的产孢量和生长速度与致病力没有相关性。

图5 在离体玉米叶片上的致病力测定Fig.5 Pathogenicity assay on detached maize leaf

图6 生长缓慢突变体T-DNA右翼PCR扩增产物Fig.6 PCR productof the right flanking of T-DNA from a slow-growthmutant
2.5 生长缓慢的突变体T-DNA右翼序列分析
经过二次特异PCR后获取一条大约450 bp的片段(图6),对该片段进行测序发现其片段包括一个41 bp完整的T-DNA右边界序列,说明扩增片段属于插入T-DNA的基因组片段。将基因序列提交NCBI采用blastn比对后,没有找到高度同源的基因序列。
3 结论与讨论
创造缺陷型突变体是分离和鉴定相关基因的一种有效途径。目前获得丝状真菌突变体的方法有紫外诱导、质粒共转化(PEG/CaCl2)、电激转化、基因枪、限制性内切酶介导转化(REMI)和农杆菌介导转化等方法。其中根癌农杆菌介导的遗传转化(Agrobacterium tumefaciens-mediated transformation,ATMT)是近年来发展的一种新的真菌遗传转化方法,与PEG/CaCl2、基因枪等转化方法相比,该方法具有操作简便、转化效率高和易得到稳定转化子等特点,同时T-DNA的插入可为突变基因提供分子标记,为基因的克隆提供便利条件,因此被运用进行反遗传研究一种有效方法[13-14]。
高等真菌的生长是一个复杂的过程,许多影响细胞内新陈代谢和形成建成的因素都将会影响到真菌的生长和分化。其中G蛋白、几丁质合成酶、运输蛋白和cAMP及与之相关的调控因子已经被证明可以控制菌丝体的生长与分化。例如在稻瘟病菌中对一个编码G蛋白的ɑ亚单位的mag B基因进行定点突变时,发现突变体的菌丝体不能正常生长,附着胞和孢子不能形成[15];在烟曲霉(Aspergillus fumigatus)中发现CHS基因在菌丝的生长和伸长中起重要作用,同时对chs G和chs E基因缺失时发现其突变体表现为高度的分支,菌丝生长缓慢[16];在子囊菌赤球丛壳菌Wu等克隆一个与驱动蛋白具有同源性NhKIN1基因,对该基因进行破坏时发现其突变体的菌丝波纹状或螺旋形,其菌落生长率为野生型的50%[17]。另外环境因子,例如温度、湿度及水的参透势也可以在不同程度上影响菌丝的生长[18]。本实验通过农杆菌介导的方法获得一个生长缓慢的突变体,并利用接头PCR技术获得该突变体T-DNA右翼序列,今后可继续采用接头PCR技术获取T-DNA左翼序列,再通过基因序列的拼接、RT-PCR、RACE技术获取该基因的全长序列,这将为深入研究该基因在调控玉米弯孢叶斑病菌菌丝生长与分化中的作用奠定基础。
[1]戴法超,高卫东,王晓鸣,等.玉米弯孢菌叶斑病的初步研究简报[J].植物保护,1996,22(4):36-37.
[2]戴法超,王晓鸣,朱振东,等.玉米弯孢菌叶斑病研究[J].植物病理学报,1998,28(2):123-129.
[3]吕国忠,刘志恒,何富刚.辽宁省爆发一种新病害-玉米弯孢菌叶斑病[J].植物保护,1997,23(4):20-23.
[4]Macri F,Lenna P.Leaf corn blight incited by Curvularia lunata(Wakk.)Boed[J].Jounral of Plant Pathology,1974,10:27-35.
[5]Xu SF,Chen J,Liu LX,et al.Proteomics associated with virulence differentiation of Curvularia lunata in maize(Zea maydis)in China[J].J Integr Plant Biol,2007,49(4):487-496.
[6]Yan HH,Chen J,Gao ZG,et al.The heredity and variation of the interaction between Curvularia lunata and plant[J].Journal ofMaize Sciences,2005,13(2):119-120.
[7]王晓鸣,戴法超,焦志亮,等.玉米种质资源抗弯孢菌叶斑病特性研究[J].植物遗传资源科学,2001,2(3):22-27.
[8]Gong GS,Ye HZ.RAPD analysis among isolates of Curvularia lunata collected from corn in China[J].Acta phytopathologica sinica,2005,35(6):22-27.
[9]冯晶,高增贵,薛春生,等.玉米弯孢叶斑病菌产生的细胞壁降解酶的致病作用研究[J].杂粮作物,2002,22:164-166.
[10]王晓飞,薛春生,徐书法,等.玉米弯孢菌黑色素性质及其在致病性中的作用研究[J].安徽农业科学,2007,35(21):6476-6478.
[11]Liu T,Liu L X,Jiang X,et al.A new furanoid toxin produced by Curvularia lunata,the causal agent ofmaize Curvularia leaf spot[J].Can JPlant Pathol,2009,(31):22-27.
[12]Liu.T,Liu.L,Jiang.X,Hou.J,Fu.K,Zhou.F,Chen.J.Agrobacterium-Mediated transformation as a useful tool for molecular genetic study of phytopathogen Curvularia lunata[J].European of Plant Pathology,2010,126:363-371.
[13]Michielse CB,Hooykaas PJ,van den Hondel CA,et al.Agrobacterium-mediated transformation as a tool for functional genomics in fungi[J].Current Genetics,2005,48:1-17.
[14]Mikosch TSP,Lavrijssen B,Sonnenberg ASM,et al.Transformation of the cultivated mushroom Agaricus bisporus(Lange)using T-DNA from Agrobacterium tumefaciens[J].CurrentGenetics,2001,39:35-39.
[15]Fang EG and Dean RA.Site-directed mutagenesis of the mag B gene affects growth and development in Magnaporthe grisea[J].Molecular Plant-Microbe Interation 2000,13(11):1214-1227.
[16]Mellado E,Dubreucq G,Mol P,et al.Cell wall biogenesis in a double chitin synthase mutant(chsG-/ chsE-)of Aspergillus fumigatus[J].Fungal Genetics and Biology,2003,38(1):98-109.
[17]Wu QD,Tanya,MS,Turgeon BG,et al.A Fungal Kinesin Required for Organelle Motility, Hyphal Growth,and Morphogenesis[J].Molecular Biology Cell,1998,9:89-101.
[18]Hong CX and Themis JM.Mycelial growth,sporulation,and survival of monilinia fructicola in relation to osmotic potential and temperature[J].Mycologia,1999,91(5):871-876.

