利用正交设计优化甘蔗SRAP-PCR反应体系
昝逢刚,刘家勇,赵俊,赵培方,吴转娣,吴才文
(云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,开远616600)
利用正交设计优化甘蔗SRAP-PCR反应体系
昝逢刚,刘家勇,赵俊,赵培方,吴转娣,吴才文
(云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,开远616600)
利用正交设计L16(45)对甘蔗SRAP-PCR反应体系的五大因素(Mg2+、dNTPs、引物、模板DNA、Taq酶)在4个水平上进行优化,得到如下结论:各因素水平变化对PCR反应的影响从大到小依次是:Mg2+、dNTPs、引物、Taq酶和模板DNA;通过对各因素进行筛选,建立甘蔗SRAP-PCR反应的最佳体系(20μL)为:dNTPs 0.25 mmol/L、引物0.1μmol/L、Mg2+2.5 mmol/L、Taq酶0.25U和模板DNA 60 ng。
甘蔗;SRAP-PCR;正交设计;优化
甘蔗是我国最重要的糖料作物,同时也是重要的能源植物。随着甘蔗育种工作和基因工程研究的不断深入,分子标记技术已成为甘蔗育种工作中的重要辅助工具。目前,甘蔗育种主要通过常规杂交的方法,根据分离群体的形态表现和育种工作者的经验等对优良个体进行选育。然而甘蔗的主要工农艺性状较多地表现为数量性状,数量性状受多基因控制,且数量性状及控制数量性状基因的表达受外界环境因素的影响较大,发现与目标基因相连锁的形态标记深受困惑。将分子标记技术应用到甘蔗育种中,利用分子标记与决定目标性状基因紧密连锁的特点,开展遗传图谱构建、基因定位与克隆、比较基因组学、cDNA指纹图谱、生物多样性分析、预测杂种优势等,从而达到选择目标性状的目的,具有准确、快速、不受环境条件干扰的优点。分子标记技术已在许多作物的育种工作中获得了成功的应用。
相关系列扩增多态性(Sequence-related amplified polymorphism,SRAP)是一种新型的基于PCR的标记系统,由美国加州大学蔬菜作物系Li与Quiros博士(2001)提出,又叫基于序列扩增多态性(Sequence-based amplified polymorphism,SBAP)(Ferriol et al.,2003)。SRAP分子标记系统最早在芸薹属作物开发出来,目前已在水稻、苹果、棉花和芹菜等多种植物中成功扩增,并应用于遗传图谱构建(柳李旺,2004)、比较基因组学(Li G.Gao et al.,2003;于拴仓等,2005)、遗传多样性分析(Ferriol et al.,2003;昝逢刚等,2009)。SRAP标记扩增结果易受dNTPs、引物、Mg2+、Taq酶和模板DNA等因子的影响,且不同物种选用引物和反应体系也不相同,所以对反应体系的优化是必要的。为此,本研究对甘蔗SRAP技术体系中各影响因素进行正交试验,旨在探讨SRAP分析技术的最佳方案,为下一步甘蔗的SRAP标记分析研究奠定必要的技术基础。
1 材料与方法
1.1 材料
选用材料为ROC22号,2010年9月采自云南省农业科学院甘蔗研究所所内试验基地。用于SRAP-PCR反应的Mg2+、Taq酶和dNTPs购自TaKaRa公司,SRAP引物由上海生工合成,经筛选引物(me3和em3)作为本次试验引物,正向引物me3序列:TGAGTCCAAACCGGAAT;反向引物em3序列:GACTGCGTACGAATTGAC。
1.2 甘蔗基因组DNA模板的提取与检测
甘蔗总DNA提取采用CTAB法稍加改良,紫外分光光度计及1%琼脂糖凝胶检测其浓度和纯度,并稀释到20 ng/μL备用。
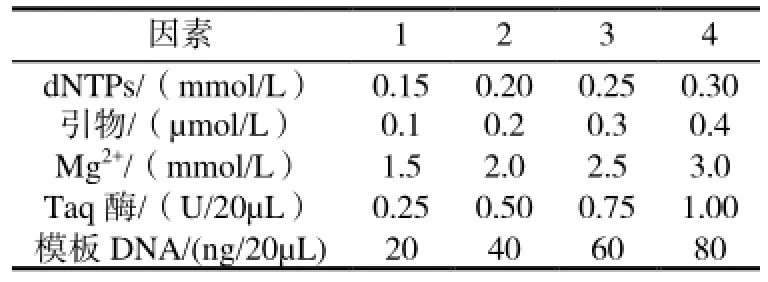
表1 PCR反应的因素水平体系终浓度
1.3 SRAP-PCR反应因素水平的确定与正交表设计
为确定PCR反应中各因素最佳水平,采用正交设计L16(45)进行试验。PCR各因素水平见表1。正交试验中16个处理3次重复,总反应体系为20μL,反应程序参照Li与Quiros(2001)的程序,略有改动:94℃预变性5min,94℃变性1 min,35℃复性1 min,72℃延伸1.5 min,5个循环;94℃变性1 min,50℃复性1 min,72℃延伸1 min,35个循环;最后72℃延伸10 min。PCR扩增产物用5%变性聚丙烯酰胺凝胶电泳分离。
2 结果与分析
2.1 电泳结果评分
按表2设计的16个处理进行PCR试验,电泳检测结果如图1所示,根据电泳条带的多少、清晰度及背景颜色进行打分。条带丰富、清晰度高、背景颜色浅的记16分,相反的记1分(谢运海等,2005)。对3次重复分别进行统计,得分见表2,从结果看一致性较好。取3次得分平均值进行直观分析:求各列各水平的和T1、T2、T3、T4;由于各列各水平均重复了4次,可由和求出各水平的均值;用各列最大均值减去最小均值得各列极差R。R越大,说明该因素对指标影响越大。分析极差R可知,各因素水平变化对PCR反应影响从大到小依次是:Mg2+、dNTPs、引物、Taq酶和模板DNA。
2.2 因子浓度对PCR结果的影响
2.2.1 dNTPs浓度对PCR结果的影响底物dNTPs浓度过高,会导致聚合酶错误的渗入,浓度过低则会影响合成的效率。如图2所示,dNTPs浓度在0.15~0.25mmol/L时差异显著,结果均值在上升;在0.25~0.3mmol/L水平间差异不显著,均得到较好的效果,最终确定0.25mmol/L为最佳反应水平。
2.2.2 引物浓度对PCR结果的影响引物过多会产生错误引导或产生引物二聚体,引物过低则降低产量。如图3所示,0.1μmol/L与0.3μmol/L、0.2μmol/L与0.3μmol/L在水平上差异不显著,0.1μmol/L与0.2μmol/L、0.1μmol/L与0.4μmol/L在水平上差异显著。最终确定0.1μmol/L为最佳反应水平。
2.2.3 Mg2+浓度对PCR结果的影响较高的Mg2+浓度可增加产量,但也会增加非特异性扩增。浓度过低则会降低Taq酶的活性,反应产物减少。如图4所示,Mg2+浓度从1.5mmol/L到3mmol/L过程中,结果均值一直在增加。2.5mmol/L与3mmol/L水平结果均值差异不显著,其余每二者间的差异均达到显著水平。最终确定2.5mmol/L为最佳反应水平。
2.2.4 Taq酶浓度对PCR结果的影响一般说来,酶量过多会使产物非特异性增加,过少则使产量降低。如图5所示,0.25~0.75U结果均值略有下降,0.75~1U略有上升,但在水平间差异都不显著。从节约的角度考虑,最终确定0.25U为最佳反应水平。

表2 PCR反应的因素水平L16(45)正交试验设计

图1 PCR产物电泳结果

图2 dNTPs浓度与结果均值的关系

图3 引物浓度与结果均值的关系

图4 Mg2+浓度与结果均值的关系

图5 Taq浓度与结果均值的关系
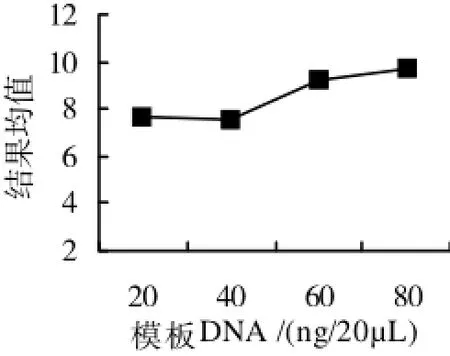
图6 模板DNA浓度与结果均值的关系
2.2.5 模板DNA浓度对PCR结果的影响模板DNA浓度过低,会导致扩增结果不稳定及扩增条带模糊;浓度过高,则可能底物过量扩增,扩增结果不稳定的现象。如图6所示,20ng到80ng扩增结果在水平上无明显差异,选择效果较理想的60ng作为模板的优化浓度。
3 讨论
SRAP标记是一种新型的基于PCR的标记技术,它针对基因外显子区GC含量丰富而启动子、内含子区AT含量丰富的特点设计引物对ORFs(open reading frames,开放阅读框)进行扩增,因不同个体的内含子、启动子与间隔区长度不等而产生多态性,具有简便、稳定、共显性、多态性高、中等产率、引物具有通用性和比较容易地分离目的标记并测序等特点。
SRAP标记技术基于PCR反应,反应条件、扩增程序变化和不同作物都会有不同的影响。本试验结果证明,采用不同PCR体系和不同扩增程序对甘蔗的SRAP-PCR扩增结果影响较大。正交试验结果分析,得出了甘蔗SRAP-PCR反应最佳体系。20μL反应体系包括:dNTPs 0.25mmol/L,引物0.1μmol/L,Mg2+2.5mmol/L,Taq酶0.25U,模板DNA 60ng。优化体系结果与正交实验中最好的第12个体系较为接近。
本试验对甘蔗SRAP体系优化采用正交试验设计与分析,使结果更加科学可靠,结果具有一定的客观准确性。但在依据条带打分过程中存在一定主观成分和误差。相信SRAP技术在甘蔗遗传多样性、品种鉴定、遗传图谱构建及其它方面必定具有更加广阔的应用前景。
[1]方宣钧,吴为人,唐纪良.作物DNA标记辅助选择[J].北京:科学出版社,2001:23-26.
[2]Li.G.,and Quiros C.F.,Quiros sequence-related amplified polymorphism(SRAP),a new marker system based on a simple PCR reaction:its application to mapping and gene tagging in Brassica[J].Theor Appl Genet,2001:103(2-3):455-461.
[3]Ferriol M.,Pico B.,Nuez F.,Genetic diversity of some accessions of Cucurbita maxima from Spain using RAPD and SBAP markers[J].Genetic Resources and Crop EvoIution,2003,50(3):227-238.
[4]柳李旺,龚义勤,黄浩,等.新型分子标记SRAP与TRAP及其应用[J].遗传,2004,26(5):777-781.
[5]Li G.,Gao M.,Yang B.,and Quiros C.F.,Gene for gene alignment between the Brassica and Arabidopsis genomes by direct transcriptome mspping[J].Theor Appl Genet,2003,107(1):168-180.
[6]于拴仓,柴敏,赵泓,等.栽培番茄与秘鲁番茄种间杂种的DNA指纹鉴定[J].分子植物育种,2005,3(1):61-65.
[7]Ferriol M.,Pico B.,Nuez F.,Genetic diversity of a germplasm collection of Cucurbita pepo using SRAP and AFLP markers[J]. Theor Appl Genet,2003,107(2):271-282.
[8]昝逢刚,吴转娣,曾淇,等.荔枝种质遗传多样性的SRAP分析[J].分子植物育种,2009,7(3):562-568
[9]谢运海,夏德安,姜静,等.利用正交设计优化水曲柳ISSR-PCR反应体系[J].分子植物育种,2005,3(3):445-450.
Optimization for Sugarcane SRAP-PCR System by Orthogonal Design
ZAN Feng-gang,LIU Jia-yong,ZHAO Jun,ZHAO Pei-fang,WU Zhuan-di,WU Cai-wen
(Yunnan Province Key Laboratory of Sugarcane Genetic Improvement/Sugarcane Research Institute,Yunnan Academy of Agricultural Sciences,Kuaiyuan 616600,China)
The orthogonal design was used to optimize SRAP-PCR amplification system on sugarcane in four levels of five factor(Mg2+,dNTPs,Taq DNA polymerase,primer and the DNA template),respectively.The result of PCR showed that the effect of each factor in different levels in the order from big to small was Mg2+,dNTPs,primer,Taq DNA polymerase and the DNA template.A most suitable SRAP-PCR system for sugarcane was established,the system of 20μl reaction contained 0.25 mmol/L dNTPs,0.1μmol/L primer,2.5 mmol/L Mg2+,0.25U Taq DNA polymerase and 60 ng DNA template.
sugarcane;SRAP;orthogonal design;optimization
S566.101
A
1007-2624(2011)03-0006-03
2011-02-21
现代农业产业技术体系建设专项资金(nycytx-024-01-03);云南省“十一五”科技攻关(2006NG11)。
昝逢刚(1979-),男,云南省楚雄州人,硕士。研究方向:甘蔗遗传育种。E-mail:fengang88@126.com
吴才文(1963-),男,研究员。研究方向:甘蔗遗传育种。E-mail:gksky_wcw@163.com

