鸭肝炎病毒GD-B株生物学特性测定*及多聚蛋白基因序列分析
黄良宗,刘鳗仪,王淑敏,司兴奎,顾万军*
(1.佛山科学技术学院动物医学系,广东佛山 528231;2.佛山市南山动物防疫站,广东佛山 528000)
鸭病毒性肝炎(Duck viral hepatitis,DVH)是由鸭肝炎病毒(Duck hepatitis virus,DHV)引起的雏鸭的一种急性、高度接触性传染病[1]。Sandhu T S等[2]发现了Ⅰ 型鸭肝炎病毒变异株,称为Ⅰa型鸭肝炎病毒。用鸡胚做交叉中和试验,证实Ⅰ 型和Ⅰa型毒株之间有部分交叉反应,但结果有些反复。国内许多地区频频出现免疫鸭群暴发鸭病毒性肝炎的报道[3-6]。陈建 红 等[7]发 现 珠 江 三 角 洲 地 区 部 分DHV可能由于长期的自然传播,其毒力增强,若这些毒力增强的变异株伴随着抗原的变异,则易造成免疫失败。本研究测定了广东分离的DHV野毒株GD-B株多聚蛋白基因序列和病毒的部分生物学特性,对开展鸭肝炎病毒分子流行病学监测和免疫防控提供理论依据。
1 材料与方法
1.1 材料
1.1.1 毒株 鸭肝炎病毒GD-B株,2007年分离自广东新兴发病鸭群,广东温氏食品集团有限公司温纳相博士提供;鸭肝炎病毒SN株,2000年分离自广东三水发病鸭群,佛山科学技术学院预防兽医研究室保存。DHV-Ⅰ标准毒株购于中国兽医药品监察所。
1.1.2 试验用动物 9日龄鸡胚购自南海狮山种鸡场;7日龄健康雏鸭购自本校科研禽场。
1.2 方法
1.2.1 兔抗Ⅰ型DHV标准阳性血清及分离株高免血清制备 兔抗DHV血清,包括标准DHV-Ⅰ血清,DHV-SN血清和 DHV-B血清,依次由 DHV-Ⅰ标准毒株、DHV-SN和DHV-B病毒液制备成蜂胶佐剂灭活疫苗,按常规免疫家兔制成,无菌检验合格后置-20℃冰箱保存备用;兔血清,由健康家兔采血制备,无菌检验合格后置-20℃保存备用。
1.2.2 CELD50测定 取标准毒株和GD-B株病毒鸡胚尿囊液分别进行l0-1~l0-9稀释,每个稀释度接种5枚9日龄鸡胚,0.2mL/枚,并设空白对照,按Reed-Muench法计算CELD50,试验重复一次,取两次平均值。
1.2.3 对7日龄雏鸭的致病性与半数致死量(LD50)的测定 分别将各野毒株用灭菌生理盐水作原液至10-5稀释,每株病毒每个稀释度接种7日龄雏鸭7只,0.3mL/只,试验同时设标准DHV对照组和正常雏鸭对照组,然后隔离饲养观察。按常规计算GD-B株对7日龄雏鸭的LD50,解剖死亡鸭观察病理变化,抽检病死雏鸭的细菌感染情况及病毒分离情况。
1.2.4 中和试验 采用固定病毒稀释血清法分别测定标准鸭肝炎病毒血清对GD-B株和SN株中和指数。置兔抗鸭肝炎病毒血清于56℃水浴灭能30 min,然后用灭菌生理盐水稀释病毒液至浓度200 ELD50/0.2mL,将病毒液分别与等体积1∶2、1∶8、1∶32、1∶128、1∶512稀释的血清混合,37℃作用60min,每个稀释度接种5枚9日龄的鸡胚,0.2 mL/枚。同时设阳性对照和空白对照。按常规方法计算抗体中和指数以及毒株间的相关系数。判定标准:中和指数大于50判定为阳性,10~49为可疑,小于10为阴性。
1.2.5 多聚蛋白基因序列测定 根据GenBank上收录的Ⅰ型鸭肝炎病毒的多聚蛋白基因组序列,利用Primer5.0软件设计8对特异性引物,使每个相邻片段部分重叠,第1~5片段大小均为1 000bp,第6~8片段大小分别为930、760、476bp。按常规方法提取病毒RNA,RT-PCR方法分段扩增多聚蛋白基因序列,并克隆到pMD18-T载体中。将重组菌送上海英骏生物技术有限公司测序。应用分子生物学软件DNA Star分析DHV GD-B株多聚蛋白基因序列进行拼接及比对,与国内外发表的参考毒株序列进行比较并构建系统进化树。
2 结果
2.1 CELD50测定结果
按Reed-Muench法计算出GD-B株的CELD50为10-4.68。
2.2 对7日龄雏鸭的致病性与半数致死量(LD50)的测定
雏鸭攻毒后36h后开始发病死亡,死亡主要集中在72h~96h;临床症状为精神萎靡,食欲废绝,呈现角弓反张状,同时伴有高声鸣叫。剖检死亡鸭,病变特征与自然发病病例相似,表现为肝脏肿胀,呈土黄色,有明显的出血斑点,胆囊多数呈草青色或茶色;肾肿胀、淤血、出血;肺淤血。可从发病鸭的肝脏重新分离到接种的病毒,而未分离到细菌。对照鸭全部健康存活。GD-B株和标准DHV LD50分别为10-4.13/0.3mL和10-4.08/0.3mL。
2.3 中和试验结果
病毒对照组全部死亡,空白对照组正常。根据Reed-Muench法计算得出标准阳性血清对GD-B株的中和指数为23.3(10~49),对SN株中和指数为50。
2.4 多聚蛋白基因序列分析
分8个片段成功扩增到预期大小的多聚蛋白基因片段,如图1。序列比对结果表明GD-B株多聚蛋白基因与广东DHV-Ⅰ型GFS99株的同源性最高,达99.4%~99.5%,与台湾变异株90D的同源性最低,只有72.6%~72.7%,因此可以推断 GD-B株属于DHV-Ⅰ型。根据核苷酸序列绘制的系统进化树形成明显的三个大群,分别为DHV-Ⅰ型毒株、韩国和中国大陆的变异株、中国台湾变异株(图2)。

图1 多聚蛋白基因序列分段RT-PCR扩增Fig.1 RT-PCR amplification of polyprotein gene sequence
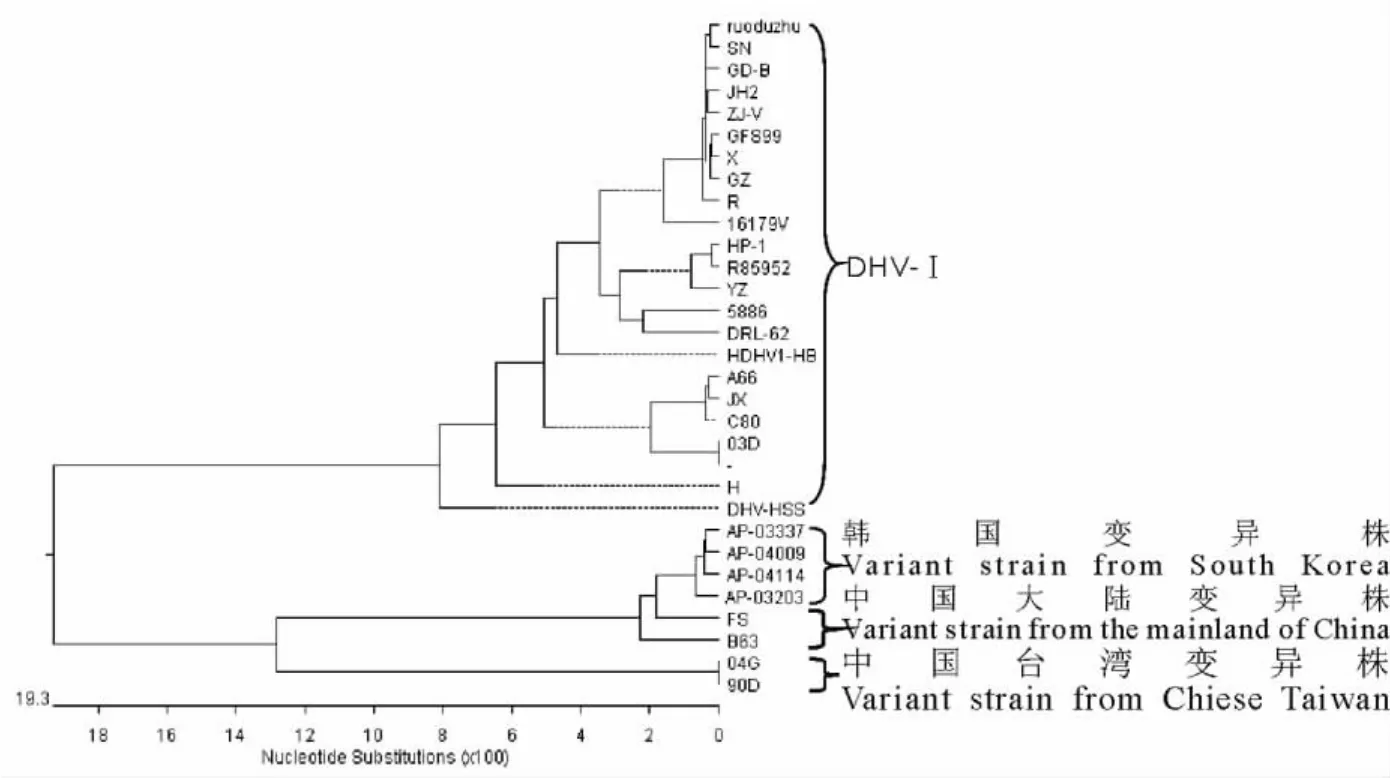
图2 多聚蛋白核苷酸序列的系统进化树Fig.2 Phylogenetic tree of polyprotein nucleotid sequenc
3 讨论
GD-B株与弱毒疫苗株多聚蛋白核苷酸序列同源性为99.5%,与参考毒株同源性为72.6%~99.5%,与台湾变异株90D的同源性最低,只有72.6%~72.7%,推断该毒株属于DHV-Ⅰ型。多聚蛋白基因核苷酸序列的系统进化树形成明显的3个分支,分别为DHV-Ⅰ型毒株分支、韩国和中国大陆的变异株分支、中国台湾变异株分支。根据多聚蛋白基因序列构建的遗传进化树各分支的研究发现,一方面,GD-B株与弱毒疫苗株和SN株的亲缘关系最近,而本实验室对SN株的毒力测定结果为强毒株[8];另一方面,强毒03D株与弱毒A66株,JX株,C80株处于一个较小的分支上。以上结果提示通过整个编码区来判定毒株毒力强弱存在一定的局限性。因此,目前对毒株毒力的判定主要还需要依赖于生物学特性的相关试验。从动物试验和多聚蛋白基因核苷酸序列的系统进化树分析发现GD-B株与SN株均是Ⅰ型鸭肝炎病毒强毒株,但从中和试验结果发现它们与标准I型DHV之间的抗原性发生变异。病毒中和试验表明,标准Ⅰ型DHV阳性血清对分离株SN病毒的中和指数为50,结果为阳性,说明DHV标准阳性血清对SN株病毒有中和能力,进一步证明SN株为Ⅰ型鸭肝炎病毒株;标准DHVⅠ阳性血清对GD-B株的中和指数为23.3,处于可疑范围。
近年来,国内外学者陆续分离到与Ⅰ型鸭肝炎病毒具有相同基因组结构,但不同血清型的新型DHV,且国内新型DHV与“中国台湾新型”和“韩国新型”DHV核苷酸相似性较低,尚不清楚“中国台湾新型”和“韩国新型”DHV之间是否存在血清学相关性,故学者建议对DHV的血清型重新命名为“血清Ⅰ型”、“中国台湾新型”、“韩国新型”DHV,将基因型分为A型(DHV A),B型(DHV B)和C型(DHV C)3个不同的基因型[9]。何冉娅等[10]报道,2007年-2009年采集华南地区发病鸭场病鸭分离检测到15株新型DHV(基因型为C型),3株Ⅰ型DHV(基因型为A型),表明华南地区有DHV-A和DHV-C型。为了快速准确地诊断与防控本病,必须尽快建立型变异株或不同血清型毒株的实验室检测手段,加强其分子流行病学调查。
[1]卡尔尼克B W.禽病学[M].10版.高 福,苏敬良,译.北京:中国农业出版社,1999.
[2]Sandhu T S,Calnek B W,Zeman L.Pathologic and serologic characterization of a variant of duck hepatitis type I virus[J].Avian Dis,1992,36:932-936.
[3]范书才,李 虹,哀率珍,等.新型鸭肝炎病毒的分离鉴定[J].中国预防兽医学报,2009,31(10):770-775.
[4]Kim M C,Kwon Y K,Joh S J,et al.Molecular analysis of duck hepatitis virus type 1reveals a novel lineage close to the genus parechovirus in the family picornaviridae[J].J Gen Virol,2006,87:3307-3316.
[5]郑献进,张大丙,曲丰发,等.Ⅰ型鸭肝炎病毒变异株的鉴定[J].中国兽医杂志,2006,42(5):15-16.
[6]陈晓丹,张 云,王 钰,等.I型鸭肝炎病毒株和株全基因组序列分析[J].中国兽医科学,2009,39(12):1057-1061.
[7]陈建红,张济培,司兴奎,等.标准鸭肝炎Ⅰ型血清对鸭肝炎野毒株的免疫保护试验[J].中国兽医学报,2001,21(3):231-235.
[8]陈建红,张济培,司兴奎,等.珠江三角洲地区鸭肝炎病原分离及其致病性和理化特性测定[J].中国兽医科技,2001,31(4):3-6.
[9]Fu Y,Pan M,Wang X,et al.Molecular detection and typing of duck hepatitis A virus directly from clinical specimens[J].Vet Microbiol,2008,131:247-257.
[10]何冉娅,于 森,张玉玲,等.2007-2009年华南地区鸭肝炎病毒流行病学调查及分离株的VP1基因变异分析[J].中国动物传染病学报,2010,18(1):7-15.

