白桦木材蓝变生防菌(Bacillus subtilis)B26液体发酵条件的优化1)
韩 丽 常建民 张柏林 孙 薇 王 雨
(北京林业大学,北京,100083)
20世纪80年代以来,化学药剂防治木材蓝变引起的环境污染等一系列问题日益引起世界各国政府的广泛关注,寻找对环境友好、无毒高效的防治技术成为木材保护领域的研究热点。生物防治被认为是最具发展潜力的防治技术之一,而基础是获得高效生防菌株并使其作用充分发挥[1-5]。枯草芽孢杆菌由于抗逆性强、抗菌谱广泛,被认为是理想生防菌来源之一,在植物病害生物防治领域已得到了广泛的研究与应用,但用于木材蓝变防治的研究还较少[6-8]。枯草芽孢杆菌(Bacillus subtilis)B26是北京林业大学木材生物防治实验室分离、筛选、鉴定和保存的一株优良生防细菌[9]。在前期平板试验和室内木片试验中,B26菌株对白桦木材蓝变菌表现出明显的拮抗作用,显示了较高的研究价值和应用潜能。由于生防菌对病原菌的抑制效果不仅取决于菌株本身,还取决于外界条件,包括培养基成分和培养条件等。因此本研究采用单因素试验和正交试验对B26菌株液体发酵条件进行优化,得到其最适培养基和最适培养条件,以期为该菌株的进一步开发应用奠定基础。
1 材料与方法
1.1 试验材料
生防菌枯草芽孢杆菌B26和病原菌绿色木霉均由北京林业大学木材生物防治实验室分离、筛选、鉴定和保存。
种子液培养基为NB培养基,抑菌活性检测培养基为PDA培养基,制备方法参考张纪忠方法[10]。
碳、氮源试验专用培养基:(NH4)2SO42 g、NaH2PO40.50 g、K2HPO40.50 g、MgSO40.20 g、CaCl20.10 g、蒸馏水1000 mL。
1.2 研究方法
1.2.1 种子液制备
将斜面保存的B26菌株接一环到种子液培养基中,装液量100 mL(容器容量250 mL),温度(28±1)℃,转速110 r/min,振荡培养48 h后,按5%的接种量接入不同条件下的发酵培养液中,进行相关单因素的发酵试验。
1.2.2 培养基的优化
采用碳、氮源试验专用培养基,分别以不同碳源(乳糖、葡萄糖、麦芽糖、蔗糖、可溶性淀粉、糊精)和不同氮源(牛肉膏、蛋白胨、酵母粉、(NH4)2SO4、NaNO3)替代培养基中的碳氮源,其他成分固定不变,装液量100 mL(容器容量250 mL),接种量5%,温度(28±1)℃、速度110 r/min,振荡培养48 h后检测不同碳源、氮源对B26菌株发酵液抑菌活性的影响。每处理3次重复。
在单因子试验基础上进一步优化培养基配方,采用L9(34)正交表安排试验,明确碳源、氮源、CaCl2、MgSO4·7H2O的最适添加量。每处理3次重复。
1.2.3 培养条件的优化
采用1.2.2优化后的培养基,分别检测不同培养温度、初始pH、装液量、摇瓶转速、接种量和培养时间对B26菌株发酵液抑菌活性的影响。每处理3次重复。
1.2.4 发酵液抑菌活性检测方法
取不同发酵条件下振荡培养48h的发酵液,在4℃、9 000 r/min下,离心20 min,去除大量菌体和杂质,取其上清液,置于4℃下保存备用。
采用孔碟法检测发酵液抑菌活性[11]。具体操作为:配制病原真菌的孢子悬浮液,取2 mL移至培养皿中。将冷却到约45℃的PDA培养基倒于培养皿中(约20 mL),摇均,在离培养平板边缘2 cm的地方用内径为6 mm的打孔器打孔,每皿打4个孔(孔间距离为2 cm)。将25 μL的发酵上清液置于孔中,在28℃下培养4~7 d,采用十字交叉法测定抑菌圈直径。
2 结果与分析
2.1 培养基的优化
2.1.1 碳源和氮源对B26菌株抑菌活性的影响
对常见的6种碳源:乳糖、葡萄糖、麦芽糖、蔗糖、可溶性淀粉、糊精(碳源质量分数为1.5%)的研究结果见表1。可知,培养基中碳源种类不同,B26菌株发酵液对变色菌抑制效果不同,以蔗糖为碳源时,发酵液抑菌活性最佳,抑菌圈直径可达到17.02 mm;其后依次是葡萄糖、可溶性淀粉、糊精、乳糖、麦芽糖。
对常见5种氮源:牛肉膏、蛋白胨、酵母粉、(NH4)2SO4、NaNO3(有机氮源质量分数为1.5%,无机氮源质量分数为0.5%)的研究结果见表2。可知,B26菌株对有机氮源的利用普遍好于无机氮源。在有机氮源中,以蛋白胨为氮源的发酵液抑菌活性最佳,抑菌圈直径可达18.16 mm;在无机氮源中,以NaNO3为氮源的发酵液抑菌活性最好,抑菌圈直径为13.62 mm。

表1 不同碳源对B26菌株抑菌活性的影响

表2 不同氮源对B26菌株抑菌活性的影响
2.1.2 培养基的正交优化
通过上述碳源和氮源单因素试验的研究,确定了液体发酵培养基的最佳碳源和氮源的种类。为进一步优化培养基配方,选取发酵培养基的主要成分蔗糖、蛋白胨、CaCl2、MgSO4·7H2O,进行L9(34)正交试验。正交试验各因素及水平见表3,统计结果及方差分析见表4与表5。由表4中R值可看知,影响B26菌株发酵液抑菌活性的因素依次为:B(蛋白胨)>A(蔗糖)>D(MgSO4·7H2O)>C(CaCl2)。结合K值,本研究中选出的最佳培养基组合为B1A1D3C2,即蔗糖1.5%、蛋白胨1.5%、CaCl20.15%、MgSO4·7H2O 0.20%。

表3 培养基优化的正交试验因素水平
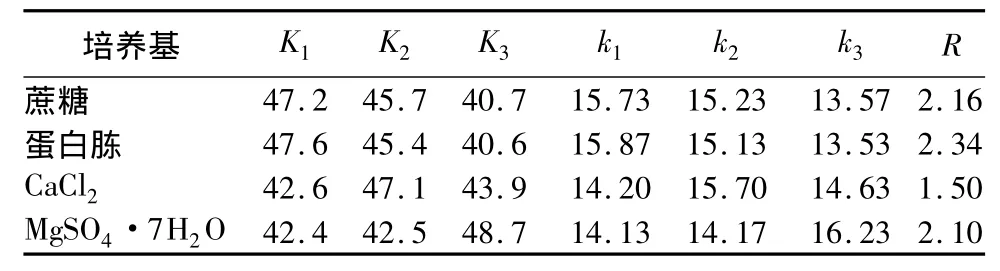
表4 培养基优化的正交试验结果

表5 正交设计方差分析
由表5中的方差分析可知:FB(6.78)>FA(6.13)>FD(5.90)>FC(2.83),表明蔗糖、蛋白胨、CaCl2、MgSO4·7H2O对发酵液抑菌活性的影响均不显著。
2.2 培养条件
2.2.1 温度对B26菌株抑菌活性的影响
将 B26菌株分别置于 20、25、30、35、40、45 ℃下摇瓶培养,测定培养温度对菌株发酵液抑菌活性的影响,结果见表6。可知,温度对B26菌株发酵液抑菌活性有一定影响。在20~45℃范围内,发酵液的抑菌活性相差不大,在35℃时菌株发酵液抑菌活性最高。随着温度的进一步升高,发酵液抑菌活性急剧下降,说明温度过高或过低都不利于B26菌株的发酵。

表6 温度对B26菌株抑菌活性的影响
2.2.2 装液量对B26菌株抑菌活性的影响
将 B26 菌株接入分别装入 30、60、90、120、150、180 mL 培养液的250 mL三角瓶中,比较不同装液量对发酵液抑菌活性的影响(见表7)。结果表明,装液量为120 mL时,菌株发酵液抑菌活性最强,说明该菌株为好氧菌,发酵液抑菌活性与通气条件有一定要求,装液量过少或过大,都不利于菌株的发酵。
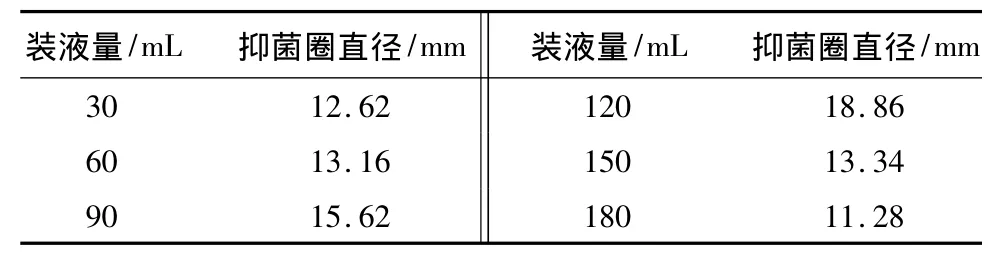
表7 装液量对B26菌株抑菌活性的影响
2.2.3 转速对B26菌株抑菌活性的影响
摇床转速分别设定为 90、110、130、150、170、190 r/min,结果见表8。在转速为130 r/min时,B26菌株发酵液抑菌活性最好,抑菌圈直径可达16.36 mm。当转速超过170 r/min时,发酵液的抑菌活性显著下降,说明转速太高不利于菌株生长,可能会导致菌体细胞机械损伤而影响其生长,或引起菌体自溶,从而对发酵抑菌活性产生很大的影响。

表8 摇瓶转速对B26菌株抑菌活性的影响

表9 初始pH对B26菌株抑菌活性的影响
2.2.4 初始pH对B26菌株抑菌活性的影响
测定了 6.0、6.5、7.0、7.5、8.0、9.0 等不同初始 pH 值对B26菌株发酵液抑菌活性的影响(见表9)。结果表明,pH为7.5时菌株发酵液的抑菌活性最高,抑菌圈直径可达19.00 mm。当pH为6.5~8.0时,B26菌株发酵液抑菌活性较高,说明中性及弱碱性的培养条件更有利于B26菌株对病原菌的抑制作用。
2.2.5 接种量对B26菌株抑菌活性的影响
分采用2%、4%、6%、8%、10%、12%等6个接种量梯度进行摇瓶培养,测定接种量对发酵液抑菌活性的影响(见表10)。可见,在一定范围内菌株抑菌活性随接种量的增加而增加,接种量在8%时发酵液抑菌活性最高,当接种量大于10%,发酵液抑菌活性开始降低。因此最适接种量为8%。

表10 接种量对B26菌株抑菌活性的影响
2.2.6 发酵时间对B26菌株抑菌活性的影响
从表11中可以看出,随着发酵时间的延长,发酵液的抑菌活性呈上升趋势,在培养36~72 h内抑菌活性最大并呈平稳趋势,其中72 h时发酵液抑菌活性最大,之后发酵液活性呈现下降趋势。因此菌株以培养72 h最为适宜。
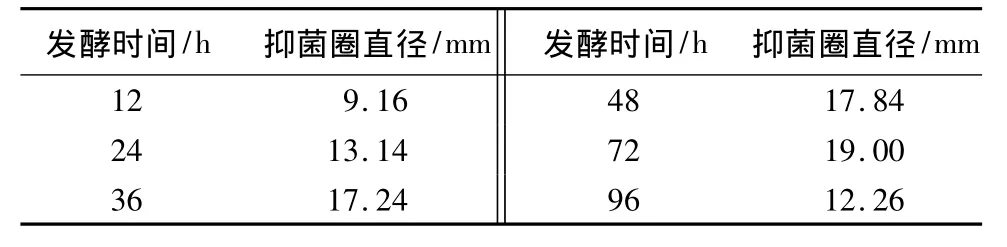
表11 发酵时间对B26菌株抑菌活性的影响
3 结论
通过对枯草芽孢杆菌B26液体发酵条件的优化,确定了菌株抑菌活性最高的培养基配方及培养条件:蔗糖1.5%+蛋白胨 1.5%+CaCl20.15%+MgSO4·7H2O 0.20%;温度为 35℃、初始pH值7.5、装液量120 mL、接种量8%、转速130 r/min,发酵时间72 h。在该优化条件下,发酵液抑菌圈直径从最初的12.40 mm提高到了19.00 mm,抑菌活性比优化前提高了53%。优化得到的培养基成分是工业生产中较常用的原料,培养条件在工业生产中也较易达到,这为B26菌株的发酵罐放大试验提供了理论依据,也为菌株的进一步工业化开发打下基础。
[1]赵桂华,李德伟,吴玉柱.木材变色和变色菌的研究现状[J].世界林业研究,2005,18(5):46-51.
[2]孙薇,常建民.木材变色生物防治技术研究进展[J].世界林业研究,2009,22(6):49-54.
[3]张雨,徐峰,罗建举.木材蓝变色生物控制研究的现状[J].广西农业生物科学,2007,26(增刊):145-149.
[4]Bruce A,Stewart D,Verrall S,et al.Effect of volatiles from bacteria and yeast on the growth and pigmentation of sapstain fungi[J].International Biodeterioration & Biodegradation,2003,51(2):101-108.
[5]Yang D Q,Wang X M,Wan H.Biological protection of hardwood logs destined for panel manufacturing using Gliocladium roseum against biodegradation[J].Bio Control,2007,52:559-571.
[6]Caldeira A T,Feio S S,Arteiro J M S,et al.Antimicrobial activity of steady-state cultures of Bacillus sp.CCMI 1051 against wood contaminant fungi[J].Biochemical Engineering Journal,2006,30:231-236.
[7]Feio S S,Barbosa A,Cabrita M,et al.Antifungal activity of Bacillus subtilis 355 against wood-surface contaminant fungi[J].Journal of Microbiol Biotechnology,2004,31:199-203.
[8]李晶,杨谦.生防枯草芽孢杆菌的研究进展[J].安徽农业科学,2008,36(1):106-111,132.
[9]李小清,常建民.白桦木材变色生防菌的筛选研究[J].木材工业,2008,22(5):11-13.
[10]张纪忠.微生物分类学[M].上海:复旦大学出版社,1990.
[11]陈年春.农药生物测定技术[M].北京:北京农业大学出版社,1991.

