人成肌细胞来源的神经前体细胞移植对大鼠脑梗死的治疗效果及意义
(1辽宁医学院附属第一医院,辽宁锦州 121000;2辽宁医学院组织胚胎学教研室)
研究证实神经干细胞是对中枢神经系统疾病进行细胞替代治疗的重要细胞来源[1],但由于其取材困难等原因,神经干细胞移植治疗神经疾病受到限制。近几年的研究发现,成肌细胞可以在一定条件下体外分化为神经前体细胞[2]。2009年3月~2010年6月,我们建立大鼠脑梗死模型,将成人成肌细胞来源的神经前体细胞移植于脑内,观察其疗效并探讨其意义。
1 材料与方法
1.1 主要实验材料 取6例行开颅手术患者(20~30岁)的正常颞肌组织(0.5~1.5 g)备用。SD雄性大鼠(辽宁医学院实验动物中心提供)。重组人碱性成纤维细胞生长因子(bFGF)、表皮生长因子(EGF)、白血病抑制因子(LIF)为GIBCO公司产品,FBS(Hyclone公司),小鼠抗人Nestin、兔抗人微管相关蛋白2(MAP-2)、兔抗人半乳糖脑苷脂(Galc)、小鼠抗人核抗体(Chemicon公司),兔抗结蛋白(Desmin)、胶质纤维酸性蛋白(GFAP)一抗、异硫氰酸荧光素(FITC)和罗丹明(TRITC)标记的羊抗小鼠和羊抗兔二抗(购于北京中山生物公司)。人MAP-2、Galc和GFAP基因引物由上海博亚生物技术有限公司合成。冷光源为北京泰克公司产品。滤去全部紫外线与红外线,投射出单一白色光束,波长(560±60)nm。
1.2 人成肌细胞的培养、诱导分化及鉴定 参考Baek等的研究方法[2],用所取的颞肌组织体外培养人成肌细胞,用有限稀释法对获取的细胞进行纯化,选取Desmin染色阳性的单细胞克隆进行扩增培养,并用诱导液进行诱导。人成肌细胞以原培养基培养者为对照。显微镜下观察细胞形态变化。诱导2周后,两组细胞行Nestin(神经干细胞标志物)免疫细胞化学染色鉴定,细胞质呈均匀红色荧光,细胞核蓝染为阳性。取诱导和对照细胞,分别接种在涂0.1%Poly-L-Lysine的盖玻片上,用分化培养液培养7~14 d,收取细胞,行免疫细胞化学染色检测细胞中MAP-2、GFAP、Galc的表达。均按试剂说明书操作,以PBS代替一抗作阴性对照。细胞质呈均匀红色荧光为阳性。
1.3 脑梗死模型建立及细胞脑内移植
1.3.1 模型建立及分组 选用雄性SD大鼠42只,体质量250~300 g。参照 Watson等[3]的方法制作脑梗死模型,根据肢体放置试验评分[4],将术后24 h评分>6分的大鼠淘汰,36只建模成功者随机分为三组,各12只:A组:肌源性神经前体细胞移植组;B组:成肌细胞移植组;C组:PBS注射组(为对照组)。
1.3.2 细胞脑内移植 细胞经台盼蓝染色鉴定活力>90%,用 PBS制备单细胞悬液(1×105/μl)。建模后第7天,三组用水合氯醛麻醉大鼠,固定在立体定向仪上,纵行切开头皮,在梗死灶的周围4点钻孔,位置为 AP 2.5,L 3.8;AP 0.1,L 1.7;AP-2,L 1.7;AP-4,L 4.5,V-1.0/-1.8。A、B 组用 10 μl注射器每点移植相应细胞2 μl,注射速度为2 min,注射后留针3 min。C组注射等量PBS。自细胞移植的前1 d始每只大鼠腹腔注射环孢素A(10 mg/kg)直到取材日。
1.4 神经功能评分 各组均于细胞移植前1 d及移植后每周参考Anna-Lena等[4]法予以动物肢体放置试验和触觉刺激试验,评价神经功能。观察至建模后第35天。
1.5 各组脑内移植细胞中人核抗原、MAP-2、GFAP、Galc的检测 建模后第36天,全麻大鼠,经左心室插管至升主动脉,快速灌入NS 100 ml,4%多聚甲醛快速灌流(10 ml/kg)固定。取出大脑,置于4%多聚甲醛液中固定24 h,30%蔗糖脱水48 h后冰冻切片,行全脑冠状连续切片,厚25 μm。采用免疫组化SABC法染色检测细胞人核抗原,观察移植细胞的迁移情况。采用免疫荧光组织化学染色检测细胞中MAP-2、GFAP、Galc的表达情况,按试剂盒说明书操作,以PBS代替一抗作阴性对照。抗人核抗体免疫阳性着色位于细胞核,呈绿色荧光,均呈均匀染色;MAP-2、GFAP、Galc免疫阳性着色位于细胞质和突起,呈红色荧光;双染色阳性分别着色于细胞核和细胞质。
1.6 统计学方法 采用SPSS17.0统计软件。数据分析用方差分析和q检验、t检验。α=0.05。
2 结果
2.1 细胞培养及纯化结果 在原代培养的第2天可见培养皿底有少量梭形细胞,体积偏小;第10~14天可见梭形或纺锤形细胞占皿底面积的70%~80%,传代后的细胞生长速度较快,平均每3~5 d传代1次。克隆培养的细胞在2~3周后长满96孔培养板中的小孔,移至24孔、6孔板及25 cm2培养瓶时生长较快,3~5 d转移1次。细胞均呈梭形,Desmin染色阳性。证明成肌细胞培养及纯化成功。
2.2 成肌细胞转化为神经前体细胞时的形态变化及染色鉴定结果 成肌细胞诱导处理的第2天即可见到大量细胞呈圆形或椭圆形状,突起缩短,部分细胞聚集;7 d后有细胞球形成,呈悬浮生长,之后细胞球数量逐渐增多,细胞球体积逐渐增大,梭形细胞数量越来越少。细胞球切片Nestin染色阳性,在分化条件下细胞呈MAP-2、GFAP和Galc阳性着色,着色部位为胞体和突起。MAP-2阳性细胞呈神经元的形态,圆形或椭圆形的细胞体,两端伸出细长的突起;GFAP阳性细胞胞体形态不规则,有较粗大突起;Galc阳性细胞伸出多个细小突起。证明人成肌细胞转化神经前体细胞成功。未诱导的细胞为梭形,未见细胞球形成,细胞中MAP-2、GFAP和Galc染色均呈阴性。
2.3 三组神经功能比较 在脑梗死后2周内,各组动物的运动功能评分无明显差异;3~5周时,A组肢体放置试验评分均高于B、C组,触觉刺激试验中的胶布移除时间均短于B、C组(P均<0.05);B组大鼠运动功能与C组相比,P>0.05。详见表1。
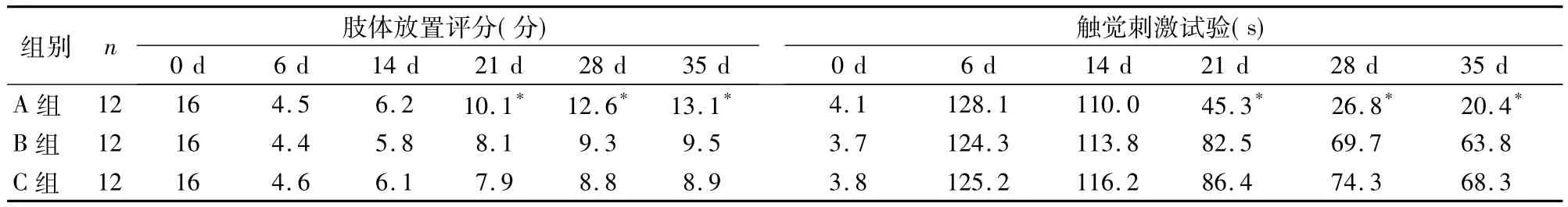
表1 三组细胞脑内移植后不同时点神经功能比较(均值)
2.4 各组脑内移植细胞中人核抗原、MAP-2、GFAP的表达 A组脑内移植细胞中可见抗MAP-2抗体、抗人核抗体和抗GFAP抗体及抗人核抗体均为阳性的细胞,B、C组未检测到双染色均阳性的细胞。
3 讨论
多年来,成肌细胞一直被认为只能够再生肌纤维,然而近年研究发现,成肌细胞具有多向分化潜能,能够分化为脂肪样细胞、成骨细胞和神经细胞等具有多种表型的细胞[5]。
本研究结果表明,从成人骨骼肌组织分离并能培养出表达成肌细胞标志物Desmin的成肌细胞,经纯化后用含有bFGF、EGF、LIF的诱导液诱导,可转化成能表达神经干细胞标志物Nestin的细胞球,形态与神经干细胞相似,同时表达神经元、星形胶质细胞和少突胶质细胞特异性标志物MAP-2、GFAP和Galc。提示人成肌细胞可以在体外分化为神经前体细胞。
将该肌源性神经前体细胞行脑梗死大鼠脑内移植发现,该细胞移植后能够存活,移植后3周,脑梗死大鼠的神经功能有所改善;移植后5周,能表达神经元和神经胶质细胞标志物MAP-2和GFAP。提示脑内移植的肌源性神经前体细胞能够分化为神经元和星形胶质细胞,具有治疗脑梗死的作用。但成肌细胞脑内移植后虽然能够存活,但是未见其向缺血区迁移,也未检测到向神经元和神经胶质细胞转化,移植动物神经功能没有改善。可以认为脑梗死的内环境尚不能引起成肌细胞向神经细胞的转化,这与文献[6]的研究结果一致。
干细胞移植促使神经功能恢复的机制有以下两点:①移植的干细胞发挥替代作用,扩大了神经环路;②移植的细胞释放营养因子。研究发现[7],神经干细胞来源的神经元能够在体内形成功能性突触,通过免疫组化和膜片钳技术,在脑内移植4周后可在皮层检测到移植细胞的神经元功能活动。本研究显示,肌源性神经前体细胞在脑内移植后2周即可观察到受体神经功能改善,这不能够通过功能性神经整合来解释。移植的细胞分泌一些分子可能激活脑内细胞自身修复。最近的实验发现[8],在人骨髓基质细胞脑梗死模型脑内移植后7 d,脑组织中脑源性神经营养因子和神经生长因子增加。我们认为,中枢神经系统内有一定的神经储备,移植的肌源性神经前体细胞可能激活了这些储备的神经元使受体神经功能恢复。
本研究采用了光化学法制备脑梗死模型[3],与目前制作脑梗死模型常用的线栓法和开颅法相比,该方法的优点是不需开颅,避免了手术造成的脑组织损伤;梗死部位发生在光照区,梗死灶的重复性和稳定性好。由于梗死灶位置恒定,可以准确的将细胞移植到脑梗死的外周部位,更适合于脑内细胞移植。因为干细胞移植的环境对其存活率有很大的影响,假如细胞移植到部位不恒定的缺血灶内,这种细胞将很难存活。
综上所述,肌源性神经前体细胞脑内移植可改善脑梗死大鼠的运动和感觉功能障碍。成人成肌细胞取材简单,来源丰富,在体外能够直接诱导为神经前体细胞,其自体移植可以解决免疫排斥问题,且能避免伦理学上的困扰,因此具有广阔的临床应用前景。
[1]Pluchino S,Quattrini A,Brambilla E,et al.Injection of adult neurospheres induces recovery in a chronic model of multiple sclerosis[J].Nature,2003,422(6933):688-694.
[2]Baek YS,Kang SH,Park JS,et al.Long-term cultured skeletal muscle-derived neural precursor cells and their neurogenic potentials[J].Neuroreport,2009,20(12):1109-1114.
[3]Watson BD,Dietrich WD,Busto R,et al.Induction of reproducible brain infarction by photochemically initiated thrombosis[J].Ann Neurol,1985,17(5):497-504.
[4]Ohlsson AL,Johansson BB.Environment influences functional outcome of cerebral infarction in rats[J].Stroke,1995,26(4):644-649.
[5]Saini A,Stewart CE.Adult stem cells:the therapeutic potential of skeletal muscle[J].Curr Stem Cell Res Ther,2006,1(2):157-171.
[6]Steffel J,Wernig M,Knauf U,et al.Migration and differentiation of myogenic precursors following transplantation into the developing rat brain[J].Stem Cells,2003,21(2):181-189.
[7]Li M,Zhang SZ,Guo YW.Human umbilical vein-derived dopaminergic-like cell transplantation with nerve growth factor ameliorates motor dysfunction in a rat model of Parkinson's disease[J].Neurochem Res,2010,35(10):1522-1529.
[8]Yasuhara T,Matsukawa N,Hara K,et al.Notch-induced rat and human bone marrow stromal cell grafts reduce ischemic cell loss and ameliorate behavioral deficits in chronic stroke animals[J].Stem Cells Dev,2009,18(10):1501-1514.

