环孢素A监测方案评价与选择
孙增先,邢晓东,赵利东,周金玉,高山,张骞峰,刘金永,洪荣(.江苏连云港市第一人民医院临床药学研究中心,连云港市 00;.南京理工大学化工学院,南京市 0094)
环孢素A(Cyclosporine A,CsA)的临床应用近30个年头,今天仍然作为主流免疫抑制剂用于各种器官移植术,临床对其免疫抑制效能和安全性的争论一直持续至今,故寻找简捷有效的CsA监测方案就促成了有限样本监测方案(Lim ited sampling strategies,LSS)的发展。笔者曾以肝肾移植患者的CsA药动学数据为基础,建立了多个预测药-时曲线下面积(AUC)0~12h的LSS回归模型,用Jackknife法对这些模型进行验证(内部验证)与评价[1]。David等[2,3]认为LSS跨移植类型应用是合适的,强调LSS的建立与验证必须是在不同的患者群体中完成。本文采用经典分析方法对文献[1]所建立的LSS回归模型在不同移植类型患者群体中进行验证(外部验证)和评价,以考察模型外推的准确性和敏感性,为LSS监测方案的选择提供理论依据,选择简便实用、能够准确反映CsA疗效的监测方案,便于临床给药方案的评价与调整。
1 材料
1.1 仪器
TDxFLx快速血药浓度分析仪(美国Abbott公司);高速离心机(美国Abbott公司);MS2振荡器(德国IKA公司)。
1.2 试药
CsA单克隆全血试剂盒、标准曲线盒、质控盒、附件盒(美国Abbott公司,批号分别为82169Q100、48044Q100、81115Q100、72054Q100);CsA微乳胶囊(Neoral,新山地明胶囊,瑞士Novartis公司)。
2 方法
2.1 病例资料
入选对象为12例本院血液科使用CsA治疗的相关病例,其中再生障碍性贫血6例、慢性粒细胞性白血病(行同胞异基因骨髓移植)4例、骨髓增生异常综合征2例,年龄22~57岁,状态稳定。采用CsA抗免疫治疗方案,剂量为100~350mg·d-1,分2次服用。所有受试患者在治疗期间每周至少检查1次肝肾功能、电解质、血常规、CsA血药浓度,且试验期间肝肾功能正常。每位受试患者先按临床经验剂量给药1周后,开始测定CsA血药浓度,如果CsA血药浓度不适合临床治疗要求,需要调整CsA给药剂量时,则在调整剂量前先行测定CsA药动学参数,经时采血后调整剂量(增加或减少剂量),1周后再行监测CsA药动学参数,并对CsA给药方案进行评估。
2.2 血样采集与血药浓度测定
每位受试患者于试验前1天晚7∶00禁食,试验当日晨留置静脉导管针,按正常服药时间用温开水将药物顿服,服药后2 h给予低脂饮食。受试患者于服药前0 h及服药后0.5、1、2、4、6、9 h时抽取静脉血1m L,置肝素抗凝管中。用荧光偏振免疫(FPIA)法在TDxFLx快速血药浓度分析仪上测定全血CsA浓度。
2.3 统计学处理
将每一受试者的2个剂量的药-时数据进行药动学模型拟合,计算药动学参数。采用梯形法计算AUC。用SPSS 13.0统计软件进行t检验和相关分析。
2.4 AUC0~12 h估算及准确性验证
对12例受试患者的2个剂量组下的血药浓度经时数据,用文献方案[1](见表1)估算不同剂量下的AUC0~12h。并计算AUC0~12h的预测误差(Prediction error,PE)、平均绝对估算误差(Mean absolute prediction error,MAE)、误差均方的平方根(Rootmean square prodiction error,RMSE),PE超过实测值±5%、±10%和±15%的病例数,以及预测值与实测值的均数比较、相关分析,以综合评价并验证各监测方案的准确性。PE及其标准偏差(SD)、MAE、RMSE越小,以及预测值与实测值无差异、相关性好,则模型的准确性和精密性就越好。
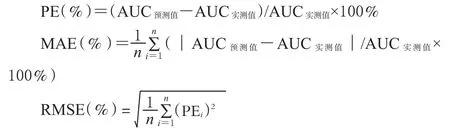

表1 简化AUC0~12 h监测方案[1]Tab1 Abbreviated AUC0~12 h monitoring strategy of CsA[1]
3 结果
12例受试患者2个剂量条件下的CsA血药浓度见表2。血药浓度经时数据经计算机拟合,所有受试者CsA的药动学过程均符合口服二房室模型,CsA药动学参数见表3。

表2 2个剂量组受试患者CsA的血药浓度Tab 2 Theblood concentration of CsA in two dosesgroups

表3 2个剂量组受试患者CsA药动学参数Tab 3 Pharmacokinetic parameters of CsA in two doses groups
用表1所示的简化AUC0~12h监测方案估算每一受试患者不同剂量下的AUC0~12h,用PE、MAE、RMSE等综合评价并验证各监测方案的准确性,结果,c0和c9监测方案的预测值和实测值存在显著性差异(P<0.01),其余各监测方案的预测值与实测值无差异(P>0.05)。各监测方案的预测值与实测值相关显著(P<0.01)。详见表4(表中,a示PE超过±5%的例数;b示PE超过±10%的例数;c示PE超过±15%的例数;d示AUC0~12h实测值为(3 812.0±1 838.4)μg·h·L-1;与AUC0~12h实测值比较:eP<0.01)。
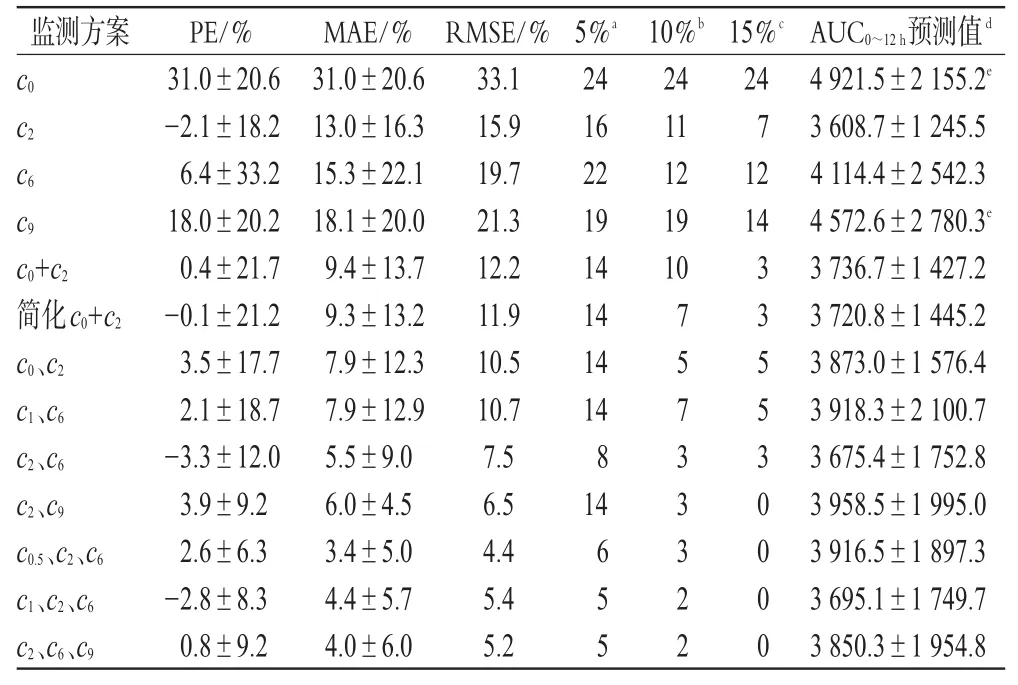
表4 简化AUC0~12 h监测方案的验证与评价Tab 4 Validation and evaluation of abbreviated AUC0~12 h monitoring strategy of CsA
4 讨论
表2显示,各点血药浓度变异非常大(平均RSD为76%),显著高于肝肾移植患者(平均RSD为40%)[1,4,5],低剂量组更为显著,平均RSD是高剂量组的1.5倍(分别为90%和61%),而c0.5变异最为突出(平均RSD为131%)。这主要与给药剂量差异有关,所有受试患者都是按照临床经验剂量给药的,当CsA血药浓度不符合治疗要求时,剂量调整采用增加或减少50mg或100mg方式进行,由于没有按照kg体重给药,血药浓度受受试患者体重影响较大。再者,不同受试患者的给药剂量本身差异就很大,尤其是低剂量组(低剂量组RSD为67%,高剂量组为44%),如果分别用低剂量组和高剂量组血药浓度变异比剂量变异,则比值很接近(1.34和1.39),说明血药浓度变异太大与剂量差异有关。另外,c0.5变异突出还与吸收滞后有关。
血药浓度经时数据分析显示CsA代谢呈二房室开放模型,与文献报道相同[1,4~7]。表3所示,主要药动学参数变异在40%以上,尤其是吸收相(ka、t1/2ka)和分布相(α、t1/2α),各主要参数(β、α、ka、t1/2β、t1/2α、t1/2ka)低剂量组和高剂量组间无差异(P>0.05),消除相参数(β、t1/2β)与肾移植患者相近(0.104 h-1、7.34 h)[1,4]。与剂量存在密切相关的浓度参数(c0、c2、css、c0+c2、AUC),高剂量组显著高于低剂量组(c0、css、AUC0~12h,P<0.01;c2、c0+c2、AUC0~4h,P<0.05)。
在CsA的治疗药物监测中,AUC0~12h监测已成为CsA疗效评判和剂量调整的金标准[8,9]。由于AUC0~12h监测的可操作性较差,寻找更简捷有效的CsA监测方案一直是治疗药物监测的研究热点。1990年Johnston等[10]首次将LSS用于CsA AUC的测量,促成了简化AUC监测方案的发展,如AUC0~4h、(c2、c6、c9)、(c0、c2、c8)、(c0、c2、c4)、(c0、c2、c3)、(c0、c1、c2)、(c2、c9)、(c2、c6)、(c2、c4)、(c1、c6)、(c1、c3)、(c0、c2)、(c0、c1)、c2、c3、c4等[1,8,11~17],这些方案都是建立在与AUC0~12h高度相关的基础上,其实质就是通过血药浓度监测间接的评价某一剂量下AUC0~12h的水平,以期对CsA疗效进行评判或剂量进行调整。David等[2,3]认为LSS可用于各种移植类型,包括稳定的、新的肾、肝移植,心脏和骨髓移植,成人和儿童,以及移植后早期或晚期。强调LSS的建立与验证必须是在不同的患者群体中进行,用一种移植类型数据建立的LSS,也可以在另一种移植类型患者群体中进行验证或应用,如用心脏移植或肾移植患者数据建立的LSS,可预测另一组心脏移植患者的AUC。本文使用12例血液科相关病例数据采用经典方法对文献[1]LSS回归模型进行外部验证,考察模型外推的准确性和敏感性,评价模型是否可外推至其他患者群体。
表4所示,c0、c9方案AUC0~12h预测值与实测值存在显著差异(P<0.01),c0方案的PE、MAE、RMSE数值最大,分别为31、31和33,且PE均在15%以上,该方案预测AUC0~12h的准确性和精密性最差。其次为c9方案,PE、MAE、RMSE分别为18、18和21,60%PE超过15%。在单点监测方案中,c2方案的准确性较好,PE、MAE、RMSE<c6方案,只有29%的PE超过15%。c0+c2可以作为单点复合变量,其预测AUC0~12h的准确性和精密性超过任一单点监测方案,PE为0.4%、SD为9.4%、RMSE为AUC0~12h实测值的12.2%,可与二点回归模型相比拟。而简化c0+c2监测方案,AUC0~12h预测值与实测值无差异(P>0.05),PE、MAE及RMSE分别为-0.1%、9.3%、11.9%,略优于c0+c2监测方案,表现出非常强的预测准确性和精密性。
在4组二点监测方案中,根据PE及其SD、MAE、RMSE数值越小,准确性越高的原则综合判断,其优劣顺序为(c2、c9)、(c2、c6)、(c0、c2)和(c1、c6),PE超过15%的百分数分别为0、12.5、20.8、20.8、12.5,二点监测方案的评价参数明显优于单点监测方案,且各监测方案差别不大,准确度<1.8%,SD<2.4%,精密度<4.2%。在3组三点监测方案中,从评价参数来看,(c0.5、c2、c6)方案要好于(c2、c6、c9)和(c1、c2、c6)方案,但三者预测结果非常接近,PE<5.4%,SD和精密度<1%,造成各方案PE相对偏大的原因是产生PE的偏离趋势不同所致(正负误差)。综合各评价参数,三点监测方案优于二点监测方案,而二点监测方案又要优于单点监测方案,与文献结论一致[1,11,12,15]。各监测方案预测 AUC0~12h的优劣顺序依次为:(c0.5、c2、c6)、(c2、c6、c9)、(c1、c2、c6)、(c2、c9)、(c2、c6)、(c0、c2)、(c1、c6)、(c0+c2)、c2、c6、c9、c0,和Jackknife验证(内部验证)顺序大体相近[1],单点监测方案c2、c0的位置没有改变,二点监测方案的顺序没有改变。虽然三点监测方案的准确度和精密度最高,但与二点监测方案相比,其准确度和精密度提高有限,以最好的三点监测方案和最差的二点监测方案计算,准确度、PE和精密度<8%。而4组二点监测方案预测AUC0~12h结果差别不大,准确度、PE和精密度<6%。另外,三点监测方案操作较为复杂,采血点较多,成本较高,常规实施较为困难,而二点监测方案(c2、c9)、(c2、c6)、(c1、c6)包含非常规采血点c1、c6和c9,推广起来则需要时间及医师接受的过程,有非常大的难度。因此,c0、c2二点监测方案更值得推荐,特别是简化c0+c2监测方案。该监测方案可操作性最强,推广最为容易,是临床医师最易接受的方案,且有很多患者本身就同时接受c0、c2二点监测,有80%~90%的患者预测AUC0~12h的PE在±15%以内,完全满足临床常规监测的需要,且精度远高于c2监测方案(有70%患者的PE在±15%以内),是优先选择的方案,为一些国外文献所推荐[12,15~17],尤其是简化c0+c2监测方案使用更加方便。
此外,c0、c2二点监测方案还可以计算css和c2/c0。css=(c0+c2)/3+40,计算简便,PE、MAE、RMSE分别为0.43、5.0、5.9,可用于给药方案的评价与调整。c2/c0是一个非常重要的参数,用于异质性吸收和代谢的识别与监测,尤其是移植术后早期[18,19];肝功能状态的判别与监测(探针药),尤其是肝移植,以及CsA肝毒性的监测[4,5,20]。由此可见,c0、c2二点监测方案不仅能够准确评价CsA的疗效,密切反映CsA暴露的峰谷水平,还可用于CsA代谢属性的判别(另文发表)和最佳个体化剂量的精确计算,使c0、c2信息得到了最充分的利用,这是其他监测方案所不能比拟的。
[1]孙增先,周金玉,张骞峰,等.肝肾移植受者环孢素AUC监测评估[J].中国药学杂志,2006,41(21):1 673.
[2]David OJ,Johnston A.Lim ited sampling strategies[J].ClinicalPharmacokinetics,2000,39(4):311.
[3]David OJ.Johnston A.Lim ited sampling strategies forestimating cyclosporin area under the concentration-time curve:review of current algorithms[J].Therapeutic Drug Monitoring,2001,23(2):100.
[4]孙增先,周金玉,张骞峰,等.肝肾移植受者环孢素稳态药动学比较[J].中国临床药学杂志,2005,14(6):364.
[5]孙增先,张骞峰,周金玉,等.肝移植术后环孢素治疗药物监测[J].中国医院药学杂志,2006,26(1):40.
[6]Irtan S,Saint-Marcoux F,Rousseau A,etal.Population pharmacokinetics and bayesian estimator of cyclosporine in pediatric renal transplant patients[J].Therapeutic Drug Monitoring,2007,29(1):96.
[7]Asberg A,Falck P,Undset LH,etal.Computer-assisted cyclosporine dosing performs better than traditional dosing in renal transplant recipients:results of a pilot study[J].Therapeutic Drug Monitoring,2010,32(2):152.
[8]Citterio F.Evolution of the therapeutic drugmonitoring of cyclosporine[J].Transplantation Proceedings,2004,36(2 Suppl):420S.
[9]Langers P,Cremers SC,den Hartigh J,et al.Sw itching monitoring of emulsified cyclosporine from trough level to 2-hour level in stable liver transplant patients[J].Liver Transplantation,2004,10(2):183.
[10]Johnston A,Sketris I,Marsden JT,et al.A lim ited sampling strategy for themeasurement of cyclosporine AUC[J].Transplantation Proceedings,1990,22(3):1 345.
[11]YangWC,Chen YF,King KL,etal.Optimization of cyclosporine therapy w ith abbreviated area under the curve method in renal transplant[J].Transplantation Proceedings,2000,32(7):1 685.
[12]Canadian Neoral Renal Transplantation Study Group.Absorption profiling of cyclosporine m icroemulsion(neoral)during the first 2 weeks after renal transplantation[J].Transplantation,2001,72(6):1 024.
[13]Mahalati K,Lawen J,Kiberd B,et al.Is 3-hour cyclosporine blood level superior to trough level in early post-renal transplantation period?[J].Journal ofUrology,2000,163(1):37.
[14]Barakat O,Peaston R,Rai R,et al.Clinical benefit of monitoring cyclosporine c2and c4in long-term liver transplant recipients[J].Transplantation Proceedings,2002,34(5):1 535.
[15]International Neoral Renal Transplantation Study Group.Cyclosporine m icroemulsion(Neoral)absorption profiling and sparse-sample predictors during the first3months after renal transplantation[J].American Journal of Transplantation,2002,2(2):148.
[16]Strong DK,LaiA,Primmett D,et al.Limited sampling strategy for cyclosporine(Neoral)area under the curve monitoring in pediatric kidney transplant recipients[J].Pediatric Transplantation,2005,9(5):566.
[17]Kazancioglu R,Goral S,Shockley SL,etal.A systematic examination of estimatesof cyclosporine area under the curve in renal transplant recipients[J].Transplantation,2002,73(2):301.
[18]Einecke G,Mai I,Diekmann F,et al.Cyclosporine absorption profiling and therapeutic drug monitoring using c2blood levels in stable renalallograft recipients[J].Transplantation Proceedings,2002,34(5):1 738.
[19]Büchler M,Chadban S,Cole E,et al.Evolution of the absorption profile of cyclosporine A in renal transplant recipients:a longitudinal study of the de novo and maintenance phases[J].Nephrology Dialysis Transplantation,2006,21(1):197.
[20]孙增先,刑晓东.环孢素A治疗药物监测研究进展[J].中国药房,2010,21(10):932.

