SBR法好氧段碳源浓度对吸磷的影响
唐旭光,王淑莹,彭永臻,张婧倩,李婕旦
(1.北京工业大学 北京市水质科学与水环境恢复工程重点实验室,北京,100124;2.环境保护部环境规划院,北京,100012)
生物强化除磷(EBPR)工艺已被广泛应用于污水处理中,是降低废水中磷排放量的经济有效的方法。EBPR最显著的特点是要实现系统的厌氧/好氧环境的交替,这也是除磷微生物(polyphosphate accumulating organisms, PAO)的优势生长模式。在厌氧状态下,PAO可吸收利用环境中的挥发性脂肪酸(Volatile fatty acids,VFAs),并利用自身体内的能量 ATP(Adenosinetriphosphate)来 合 成 内 碳 源 PHB(Poly-βhydroxybuyrate),结果导致 ATP被降解为ADP(Adenosine diphosphate),而磷被释放到环境中;在好氧状态下,PHB继续为ATP能量库提供能量,即在O2存在下吸收环境中的磷使其与ADP结合生成能量源ATP,以便于能量的贮存[1−5]。但是,由于在实际水的处理中有机碳源含量很少,并不能够满足PAO的厌氧释磷的需要,所以,能够进入好氧段的有机底物含量很低,好氧段的C/P比对好氧吸磷的影响并不能显现出来。而在采用配水的试验中,近期研究[6−8]显示出了与传统理论不同的结果,发现PAO在好氧环境中可以吸收有机底物进行PHB的富集,并伴随着磷的释放。所以,在EBPR理论中,好氧段的C/P比对吸磷过程的影响有待进一步研究。在本试验中,通过人为改变在好氧吸磷时的C/P比,在对厌氧−好氧(A/O)周期循环条件下磷的好氧吸收进行研究,并对其与好氧吸收磷酸盐、微生物胞内聚合物代谢之间的变化规律以及控制参数 ORP在好氧阶段的变化情况进行分析研究。
1 试验材料与方法
1.1 试验装置
SBR反应器采用有机玻璃制成,内径为18 cm,有效高度为65 cm,工作容积为10 L。反应器内设搅拌装置,底部有一组微孔曝气头,采用空气压缩机供气,通过转子流量计控制气量。运行中进水、搅拌、曝气、排水等工序通过时间控制器和电磁阀实现自动切换。试验采用 A/O(即厌氧−好氧)型 SBR工艺,运行周期为6 h,每个周期包括:瞬间进水、厌氧搅拌(2 h)、好氧曝气(2~3 h)、沉淀排水(1 h),周期换水量为8 L,污泥质量浓度维持在(3 000±200)mg/L。
1.2 进水水质
该研究使用实际生活污水,在试验阶段不投加任何碳源、营养物等。试验用水取自北京工业大学生活小区化粪池,水质指标与实际城市生活污水的近似,并随时间季节有一定的波动。水质指标(质量浓度)见表1。
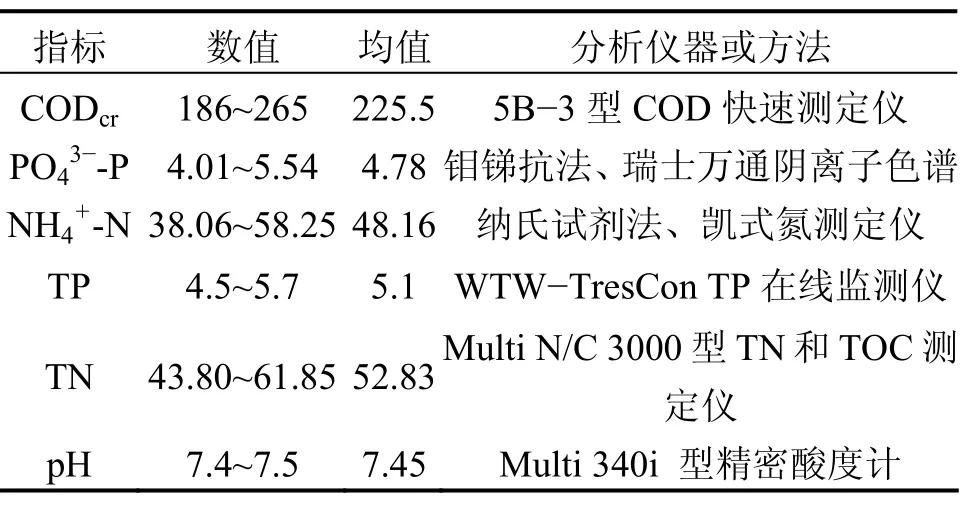
表1 某生活小区生活污水的水质指标Table1 Characterics of real domestic wastewater mg/L
2 结果与分析
2.1 有机负荷对系统内好氧段PHAs合成的影响
好氧初始 VFAs质量浓度为 0,20.00和 149.32 mg/L时的各种物质质量浓度变化分别如图1~3所示。从图1~3可以看出:在厌氧2 h内,系统中的变化遵循传统生物除磷理论,磷浓度在 VFAs转化为 PAOs体内PHAs(包含PHB和PHV)的过程中逐渐增加。其中,在前1 h内,释磷速率为6.64 mg/(g·h),为后1 h释磷速率2.11 mg/(g·h)的3倍,这是由于系统中在厌氧1 h后VFA的含量由17.70 mg/L降至0.91 mg/L,几乎被利用完,而在后1 h中的利用量仅为0.91 mg/L,可利用的有机底物几乎耗尽,释磷速率也因此受到限制。系统中胞内聚合物PHB和PHV的含量在厌氧阶段逐渐增加,从2种内含物的合成速率可以看出,两者以较为均匀的速率进行合成,分别为7.665 mg/(g·h)和3.21 mg/(g·h),可以看出前者大约为后者的2倍。这是由于在实际生活污水中的VFAs主要由乙酸(HAc)组成,占总VFAs的80%以上,丙酸(HPr)及其他VFAs的含量只与总含量的比低于20%,所以,在合成的聚合物PHA中主要以PHB为主,而只合成少量的PHV;从PHB的合成速率来看,并不受到有机底物浓度变化的影响,均保持在恒定速率合成,没有因为在厌氧后期VFAs浓度的降低而使速率下降,说明PHB的合成反应为零级反应,有机底物的浓度对其影响较小。

图1 好氧初始VFAs质量浓度为0 mg/L时各种物质含量的变化Fig.1 Experimental profiles of different compounds during anaerobic/aerobic cycle when mass concentration of VFAs is 0 mg/L

图2 好氧初始VFAs质量浓度为20 mg/L时各种物质含量的变化Fig.2 Experimental profiles of different compounds during the anaerobic/aerobic cycle when mass concentration of VFAs is 20 mg/L

图3 好氧初始VFAs质量浓度为149.32 mg/L时各种物质含量的变化Fig.3 Experimental profiles of different compounds during anaerobic/aerobic cycle when mass concentration of VFAs is 149.32 mg/L
在进入好氧阶段后,可以采用投加碳源乙酸钠(NaAc)的方法来改变好氧段C/P比,使好氧初始VFAs质量浓度分别为0,20和149.32 mg/L。从图1可以看出:吸磷在进入好氧状态后正常进行,并保持较高的吸磷速率11.72 mg/(g·h),污泥内PHB的含量也在45 min 内由 0.035 mg/(g·h)降至 0.024 mg/(g·h),占好氧段PHB消耗总量的74%,说明系统中好氧段VFAs质量浓度为0 mg/L时,即没有PHB的富集发生,也可发生高效地吸磷反应,使出水磷浓度为0 mg/L。而当好氧初始VFAs质量浓度调节至20 mg/L时(见图2),PHB在好氧初期 20 min内出现富集现象,由 0.046 8 mg/(g·h)增至 0.059 1 mg/(g·h),而磷在此阶段亦处于吸收状态,但吸磷速率明显低于前者,并且可看出存在吸磷拐点P1,前后吸磷速率相差很大。所以,将好氧初始VFAs质量浓度增大至149.32 mg/L时,这种现象更加明显。从图3可以看到:随着VFAs含量的骤降,在好氧曝气 40 min时其含量即降为 0,降解速率为89.59 mg/(g·h),其中VFAs的转化途径包括2种生化反应:
(1)OHO在好氧状态下对VFAs的降解,主要用于OHO自身生长和能量获得,但是,根据上述分析,在该系统中,由于长期的厌氧/好氧交替运行模式,OHO的活动性被抑制,在好氧段对 VFAs的降解很有限。
(2)PAO对VFAs的转化贮存。在对系统中PHB的监测发现,其在好氧初期即VFAs骤降的过程中仍有大量生成,而且合成速率很高,为36.97 mg/(g·h),由此可以看出,在好氧条件下,PHB仍可以保持较高速率进行合成,这有别于传统EBPR理论中好氧PHB降解理论。从磷浓度变化可以看出:在图3中亦出现吸磷速率拐点P2,在该拐点前后吸磷速率与图2中的一样相差很大。结合系统内PHB变化曲线可以看出,吸磷拐点P1和P2对应的是好氧PHB合成的结束,即微生物在好氧状态下可以高速地利用环境中的有机底物进行同化作用,并且在很大程度上影响了好氧吸磷反应。
另外,可以从厌氧阶段和好氧阶段单位污泥中合成的PHB量(η)来比较在2种状态下PAO的对有机底物利用能力,在此进行以下假设:
(1)在厌氧阶段,VFAs全部用于PAOs体内PHB的合成。
(2)在好氧阶段,VFAs的转化全部用于2种生化反应。其中:一种为 OHO的好氧降解。但是,由于在厌氧、好氧运行的系统中,PAO在厌氧段就开始利用有机底物进行生物合成作用,贮存用于自身生长的PHA,并在此过程中产生ATP以维持其在厌氧的不利条件下生存并处于较强活性状态,这也使得PAO在厌氧/好氧交替运行系统中具有与活性污泥中大多数其它异养微生物进行竞争的能力,使得其他异养菌在好氧段得不到有效生长,并使自身逐渐生长成为系统的优势菌群。所以,在长期的厌氧好氧交替运行的系统中,PAO在异养菌中占有优势,普通异养菌对于PAO的影响很小,不至于影响在好氧段对氧和有机底物的竞争。
另一种为PAO体内PHB的合成为主要转化VFAs的反应。在厌氧阶段,ηAn为 7.665 mg/(g·h),而在好氧阶段,ηO为 36.97 mg/(g·h),ηO大约为 ηAn的 5 倍。PAO在好氧条件下的合成能力明显比在厌氧环境中PHB的强,所以说,在好氧环境中当有足够的VFAs存在时,PAOs即可利用其进行PHAs的合成,而且速率明显高于厌氧状态下的合成速率。其具体原因有待进一步研究。
2.2 A/O运行模式对系统中菌群的影响分析
从功能来看,污水生物处理系统中的微生物主要有氨氧化菌(AOB)、亚硝酸盐氧化菌(NOB)、聚磷菌(PAO)和一般的异养好氧菌(OHO)等,但在除磷系统中起主要作用的菌群只有PAO,其他菌群的优势生长都会影响到系统的除磷效能。在该SBR系统中,采取厌氧/好氧交替运行模式,系统中的菌群竞争持续进行,在系统的启动过程中,首先是自养菌AOB和NOB被淘洗出系统,致使在好氧段几乎没有硝化作用的发生,这是短污泥龄和低温(系统运行温度维持在13 ℃左右)所致。在低温下自养菌本身处于劣势增长环境,并且较长时间使其在系统中得不到优势增长,通过每周期的排泥很快被淘洗出去;其次,由于系统在投加生活污水后,首先进入厌氧阶段,而此时PAO能够在厌氧环境中充分利用原水中的有机底物,将其贮存于体内,主要遵循“吸收—储存—利用”的增长模式。即当基质浓度较高时,微生物将基质的部分或全部首先快速吸收,并以胞内聚合物的形式储存,然后,当基质缺乏时,利用储存的聚合物进行增殖[9−10],但是,对于一般的异养菌来说,这种增长模式不起主导作用,而是以“直接利用”增殖模式为主,即这些菌群只有在好氧环境中并且有大量底物存在时才可以优势增长,可见,相对PAO这种异养菌来说,OHO的增长将受到抑制,生长速率缓慢。所以,在该系统中,通过A/O运行模式的培养,有效地富集了对除磷有贡献的菌群PAO,而明显抑制了其他好氧异养菌OHO的反应活性。
2.3 不同C/P比下VORP的好氧指示作用
国内外大多数研究对于厌氧释磷条件的控制一般用ORP指标VORP来反映,当VORP为正值时,聚磷菌不释磷;当VORP为负值时,绝对值越高,则其释磷能力越强。一般认为,应把VORP控制在−200~−300 mV。以好氧段为例最大限度地发挥聚磷菌地吸磷作用,必须提供足够含量的DO以满足聚磷菌对其贮存的PHB进行降解时对氧气作为最终电子受体的需求量,实现最大限度地转化PHB而释放出足够的ATP,供其过量吸磷所需。一般应将此段的 DO质量浓度控制在 2 mg/L以上。但是,将VORP用于好氧吸磷中的控制并不多见。在该研究中,在不同好氧段C/P比条件下发现了不同的 VORP变化规律,并能够指示吸磷反应进程。
选择好氧段初始VFAs质量浓度分别为0,20.00和149.32 mg/L时的典型周期内的VORP变化规律,见图4。试验结果表明:在反应刚开始的5~10 min内,VORP迅速由开始的−300 mV降低至−375 mV左右,这是由于存在于生活污水中少量的DO迅速耗尽,以及少量氧化态硝(NOx−)不断被还原成氮气,导致整个反应器中的氧化还原电位不断降低;由于无氧呼吸即反硝化的进行,硝态氮不断减少,在整个反应器中,氧化还原状态的变化不如反硝化初期氧化还原状态的变化幅度大,所以,VORP的变化越来越小。当反硝化结束时 VORP迅速下降,表现在曲线上为一拐点(如图点D),这一点指示出系统缺氧呼吸过程的结束,分子态氧消失,系统进入厌氧状态,可以用来判断系统进入厌氧释磷阶段。

图4 不同有机负荷ORP变化情况Fig.4 Experimental profiles of ORP during the anaerobic/aerobic cycle at different OLR
在结束厌氧搅拌并分别增加系统有机负荷后,系统进入好氧吸磷阶段,在此过程中VORP的变化为:在好氧阶段的开始10 min内,由于曝气DO质量浓度迅速升高,此时VORP升高的速率也很大,由−375 mV迅速升高至−100 mV;在此之后的曝气阶段,3种不同有机负荷在好氧段的VORP变化出现差异,在经过短期VORP迅速上升之后,好氧段VFAs质量浓度为0 mg/L的系统首先达到拐点A,历时最短,说明在C/P比为0时,微生物可在好氧环境中利用氧气降解PHAs获得能量进行吸磷反应,使吸磷速率保持在较高水平,而在好氧初始VFAs质量浓度分别为20 mg/L和149 mg/L的系统内,VORP经过缓慢攀升达到拐点B和C,经分析得知:好氧初始的高C/P比会对聚磷微生物的生理活动产生影响,其可在底物丰富的条件下继续在好氧环境中吸收有机底物进行PHAs的合成,而影响到吸磷速率,从而导致吸磷拐点的滞后。
由于以往将VORP作为控制参数的研究中,多将其作为好氧硝化结束的特征点以便于实现短程硝化[11−13],或者用于反硝化吸磷过程用厌氧释磷结束和缺氧吸磷结束的指示参数[14−15],并没有得出VORP在好氧吸磷过程中的变化过程及特征点指示作用。由于在该试验中,以A/O交替运行的SBR系统中,在好氧过程中起主要生化作用的是聚磷微生物 PAOs,OHO的活性被明显抑制,所以,VORP的变化点能有效指示出好氧段碳源对 PHB合成结束即系统开始进入快速吸磷阶段。
3 结论
(1)在3种不同好氧段C/P比条件下,系统表现出有别于传统好氧吸磷的现象,即PHAs的好氧富集与吸磷同时进行,并且厌氧阶段PHB合成速率ηAn为7.665 mg/(g·h),而在好氧阶段 ηO为 36.97 mg/(g·h),ηO大约为ηAn的5倍,PAO在好氧条件下的合成能力明显比在厌氧环境中PHB的合成能力强。所以说,在好氧环境中,当有足够的VFAs存在时,PAO即可利用其进行PHA的合成,而且速率明显高于其在厌氧状态下的合成速率。
(2)在利用实际生活污水的 SBR系统中,通过A/O运行模式的培养,有效地富集了对除磷有贡献的菌群PAO,而明显抑制了其他好氧异养菌OHO的反应活性。
(3)在该试验中,以A/O交替运行的SBR系统中,由于起主要生化反应的微生物群体为PAO,所以 ORP的拐点能有效指示出 PHB合成的结束阶段和系统开始进入的快速吸磷阶段。
[1]Satoh H, Mino T, Matsuo T.Uptake of organic substrates and accumulation of poly-hydroxyalkanoates linked with glycolysis of intracellular carbohydrates under anaerobic conditions in the biological excess phosphate removal processes[J].Water Sci Technol, 1992, 26(5/6): 933−942.
[2]Smolders G J F, van der Meij J, van Loosdrecht M C M, et al.Model of the anaerobic metabolism of the biological phosphorus removal process: Stoichiometry and pH influence[J].Biotechnol Bioeng, 1994, 43(6): 461−470.
[3]Smolders G J F, van der Meij J, van Loosdrecht M C M, et al Stoichiometric model of the aerobic metabolism of the biological phosphorus removal process[J].Biotechnol Bioeng, 1994, 44(7):837−848.
[4]Pereira H, Lemos P C, Reis M A M, et al.Model for carbon metabolism in biological phosphorus removal processes based on in vivo 13 C-NMR[J].Water Res, 1996, 30(9): 2128−2138.
[5]Smolders G J F, van der Meij J, van Loosdrecht M C M, et al.A structured metabolic model for anaerobic and aerobic stoichiometry and kinetics of the biological phosphorous removal process[J].Biotechnol Bioeng, 1995, 47(3): 277−287.
[6]Brdjanovic D, Slamet A, van Loosdrecht M C M, et al.Impact of excessive aeration on biological phosphorous removal from wastewater[J].Water Res, 1998, 32(1): 200−208.
[7]Guisasola A, Pijuan M, Baeza J A, et al.Aerobic phosphorus release linked to acetate uptake in bio-P sludge: Process modeling using oxygen uptake rate[J].Biotechnol Bioeng, 2004,85(7): 722−733.
[8]Ahn J, Daidou T, Tsuneda S, et al.Transformation of phosphorus and relevant intracellular compounds by a phosphorus accumulating enrichment culture in the presence of both the electron acceptor and electron donor[J].Biotechnol Bioeng, 2002, 79(1): 83−93.
[9]van Loosdrecht M C M, Pot M A, Heijnen J J.Importance of bacterial storage polymers in bioprocesses[J].Water Science and Technology, 1997, 35(1): 41−47.
[10]Majone M, Assanisso P M, Ramadori R.Comparison of carbon storage under aerobic and anoxic conditions[J].Water Science and Technology, 1998, 38(8/9): 77−84.
[11]高景峰, 彭永臻, 王淑莹.DO和ORP与SBR法硝化反硝化的相关关系[J].哈尔滨建筑大学学报, 2002, 35(1): 61−65.GAO Jing-feng, PENG Yong-zhen, WANG Shu-ying.Relationships between DO, ORP and nitrification, denitrification in SBR processes[J].Journal of Harbin University of Civil Engineering and Architecture, 2002, 35(1): 61−65.
[12]高大文, 彭永臻, 郑庆柱.SBR工艺中短程硝化反硝化的过程控制[J].中国给水排水, 2002, 18(11): 13−18.GAO Da-wen, PENG Yong-zhen, ZHENG Qing-zhu.Process control of shortcut nitrification-denitrification in sequencing batch reactor process[J].China Water & Wastewater, 2002,18(11): 13−18.
[13]Chang C H, Hao O J.Sequencing batch reactor system for nutrient removal: ORP and pH profiles[J].Journal of Chemical Technology and Biotechnology, 1996, 67(1): 27−38.
[14]王亚宜, 彭永臻, 王淑莹, 等.碳源和硝态氮浓度对反硝化除磷的影响及 ORP的变化规律[J].环境科学, 2004, 25(4):54−58.WANG Ya-yi, PENG Yong-zhen, WANG Shu-ying, et al.Effect of carbon source and nitrate concentration on denitrifying dephosphorus removal and variation of ORP[J].Environmental Science, 2004, 25(4): 54−58.
[15]Schon G, Geywitz S, Mertens F.Influence of dissolved oxygen and oxidation-reduction potential on phosphorus release and uptake by activated sludge from sewage plants with enhanced biological phosphorus removal[J].Wat Res, 1993, 27(3):349−354.

