外扰作用下细胞内稳态鲁棒性实验研究
杨国平 应 磊 包家立* 朱朝阳(浙江中医药大学 信息技术学院,杭州 30053)
2(浙江大学医学部 浙江省生物电磁学重点实验室,杭州 310058)
引言
内稳态是生理学的一个重要理论,1932年美国生理学家坎农(W.B.Cannon)在出版的《人体的智慧》一书中明确提出了内稳态(homeostasis)概念,被认为是20世纪生理学最重要的理论之一。内稳态理论描述了生物体维持内环境稳定的自我调节过程,揭示了生物体对环境变化的一种耐受限度,但没有在数量上对耐受性加以阐述。内稳态的产生机制是负反馈,控制论创始人、美国数学家维纳和生理学家罗森布吕特认为,负反馈是保持稳态的基本条件,稳态是动态平衡的结果[1]。
鲁棒性原是统计学中的一个专门术语,20世纪70年代初开始在控制理论领域研究,用以表征控制系统对系统特性或参数摄动的不敏感性。生物体作为一种由多组分、多层次、多尺度组成的高度复杂的控制系统,具有控制系统的一般共性,其中内稳态就是控制理论所阐述的稳定性,但生理学中的内稳态分析还缺乏控制理论的方法。控制理论表明,鲁棒性是一切类型控制系统所必须考虑的一个基本问题。生物体遭受着外界环境变化而导致特性改变,因此鲁棒性同样也是生物系统分析中必须考虑的。
1997年,Barkai和Leibler首次报导了细菌趋化的生物鲁棒性,说明细菌可以适应化学诱导剂在一个较宽浓度范围内的变化,并且总是根据化学诱导剂浓度的变化来调节自身行为,认为鲁棒性是生物体的基本特性[2-3]。之后,关于生物鲁棒性的研究逐渐增多,总结起来有几个方向:一是以生物网络为基础的鲁棒性研究,如生化网络[4]、基因网络[5]、神经网络[6]、p53网络[7]等;二是以控制理论为基础的方法学研究,如定量模型[8]、反馈控制[9-10]、非线性分岔[8,11-13]、鲁棒区域[6,14-16]等;三是以生物物种为基础的生物个案研究,如细菌[2-3,9]、p53基因[7]、盘基网柄菌[4]、体节极性基因[17]、血压调节系统[18]等。Laub和Loomis提出的趋化盘基网柄菌细胞cAMP振荡网络模型,是目前方法学研究中用得较多的一种生物鲁棒模型[4,8,13-17]。生物鲁棒性对医疗技术的发展具有潜在的应用价值,为肿瘤治疗[19]和糖尿病治疗[20]等提供了新思路。
稳定是生物维生的基础,本研究以内皮细胞为对象,用H2O2作为外源扰动剂,研究在外扰作用下细胞内钙稳态鲁棒性实验的技术路径,为其他扰动剂(如电磁场)扰动生物系统稳态的实验研究奠定基础。研究表明,运用控制理论分析生物系统的鲁棒性是一种可行的方法。
1 原理
1.1 生物系统的数学描述
设生物系统是一个开放系统,系统边界将系统与环境分割开来,并且系统与环境通过系统边界有物质、能量、信息的交换,如图1所示。生物系统运行的状况称为状态,系统的行为通过状态的获取、保持和改变来体现。研究生物系统就是要研究系统所处的状态、状态可能的变化、不同状态之间的转移等,而生物系统状态可以用一组状态变量来表示,如生理或生化指标。在一个稳定的生物系统中,系统与环境之间的物质、能量、信息交换保持着动态平衡,其生理行为是内稳态。当外界扰动剂(简称扰动剂)改变了环境,生物系统与环境之间的物质、能量、信息交换就发生变化,生物系统原有的内稳态可能被打破,也就是说生物系统状态可能发生转移。生物系统状态是否转移取决于扰动剂的强度,以及生物系统本身对扰动剂的耐受性,这种耐受性就是一种生物的鲁棒性。当扰动剂强度较大时,如果生物系统的状态不转移,表明系统仍保持稳定,可以判定该系统有较大的鲁棒性。

图1 生物系统与环境交互作用模型Fig.1 Model of interaction between biological system and environment
根据上述原理,设内皮细胞内钙浓度[Ca2+]i为状态x,双氧水浓度[H2O2]为扰动剂量u。内皮细胞所处的内钙状态x及其可能的变化可以用动态非线性微分方程表示,有
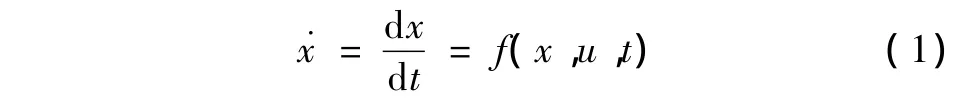
式中,f(x,u,t)是x、u和时间t的非线性函数。
当扰动剂不作用于细胞系统(u=0)时,式(1)演变为标称系统,有
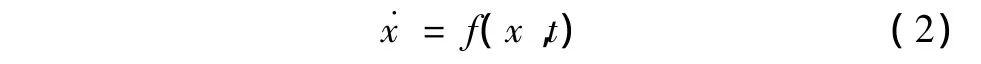
实际上,生物系统是一个时变系统,系统状态x、状态变化率以及扰动剂u均随时间t变化,式(1)和式(2)中的变量x和u均是t的函数。
1.2 Lyapunov稳定性理论[21]
基于内稳态是生物系统与环境之间物质、能量、信息交换动态平衡的结果,可以认为生物系统是一种动力学系统,具有动力学系统的一般特性。Lyapunov稳定性理论是描述动力学系统稳定性的理论,可以用来分析细胞内钙的稳定性。设x=φ(t)是式(1)的解,定义在时间域(t0,∞)内,解初态为φ(t0);带扰初态为x0=x(t0),对应的轨线为x(t,t0,x0)。如果对于足够小的ε>0,总有δ>0,使得只要
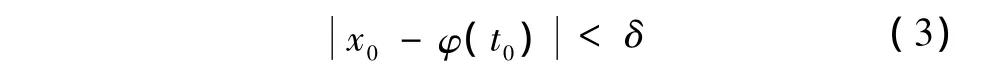
1)如果有
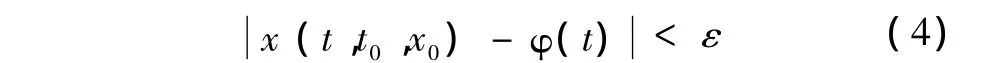
则称解φ(t)是Lyapunov稳定的,否则,称φ(t)是Lyapunov不稳定的。
2)如果t→∞,有
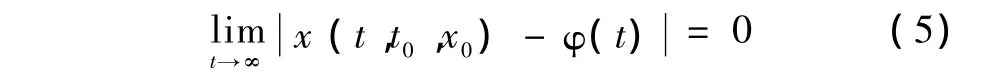
则称解φ(t)是Lyapunov渐近稳定的。
Lyapunov稳定的物理意义:φ(t)是从解初态φ(t0)出发的式(1)解,x(t)是从带扰初态x0=x(t0)(扰动的结果)出发的解。式(3)表示这两种初态偏离小于δ,式(4)表示两个解在全过程中每一时刻t的偏差都小于任意指定的小数ε。Lyapunov稳定意味着只要扰动(初态偏离)足够小,系统在时间域上的行为偏离也会足够小。初值小的扰动只能引起轨线的小偏离,这样系统就有能力保存自己并发挥功能。式(5)表示带扰初态x0引起的轨线偏离随时间延伸而趋于0,这种稳定要求偏差最终完全消除,回到原定态。
1.3 鲁棒性理论[22-23]
考虑式(1)的非线性系统,扰动剂u的施加是依赖于系统状态x(t),有

式中,θ[x(t)]称为标称控制量。
事实上,扰动剂u包括加性扰动Φ和增益扰动Ψ(Φ和Ψ随机),即
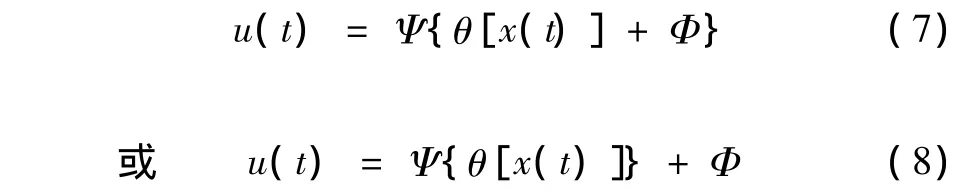
为了方便,统一记为

这样,式(1)的系统在受到扰动剂作用后为
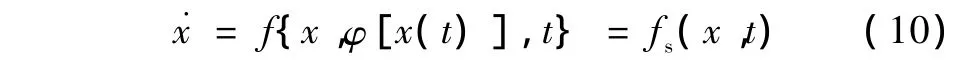
根据文献[22],设式(1)系统在稳态点的Lyapunov函数为V(x),则该系统必然存在一个扰动量集合,即
D={u:V(fs(x,t))-V(x)<0;∀x≠0∈Rn,fs(x,t)}

2 实验方法
2.1 内皮细胞传代培养
细胞为永生化的人脐静脉内皮细胞株(浙江大学医学院病理与病理生理学系馈赠)。
2.1.1 复苏
从-80℃冰箱中取出冻存的内皮细胞,迅速置于37℃水浴锅并不断搅动。使冻存管中的冻存物在1min之内融化。打开冻存管,将细胞悬液吸到离心管中。900r/min离心5min,弃去上清液。沉淀加适当培养基胎牛血清(杭州四季青生物工程材料有限公司)后将细胞转移至培养瓶中,37℃培养。
2.1.2 培养
待复苏后的内皮细胞在培养瓶是长成致密单层后,吸除瓶内的旧培养液。取1mL含EDTA的0.25%胰酶(吉诺生物医药技术有限公司)溶液润洗培养瓶,然后加入3mL胰酶溶液消化。当在显微镜下观察到细胞质回缩、细胞间隙增大时,加入含10%胎牛血清的RPMI.1640培养液(吉诺生物医药技术有限公司)和胰酶。用吸管轻轻反复吹打瓶壁细胞,使之从瓶壁脱离形成细胞悬液。900r/min离心细胞悬液,5min后弃去上清液。加入含10%胎牛血清的RPMI1640培养液,用吸管将沉淀重新制成细胞悬液。计数板计数后,把细胞悬液分成等份分装入数个培养瓶中,或以1×105cells/皿的密度接种于35mm培养皿中(细胞复苏第3代之后用于实验),接种24h后用于实验。
2.1.3 冻存
用含EDTA的0.25%胰酶溶液消化内皮细胞,将细胞悬液收集至离心管中。900r/min离心5min,弃上清液。沉淀加入冻存保护液(含20%胎牛血清的RPMI.1640培养液+二甲基亚砜DMSO(美国Sigma公司),计数,调整至5×106cells/mL左右。将悬液分至冻存管中,每管1mL。将冻存管口封严,贴上标签,写明细胞种类,冻存日期,放入-80℃冰箱中冻存。
2.2 细胞内钙测定
基础细胞外液配制:NaCl(140mmol/L),MgCl2(1mmol/L),CaCl2(1.8mmol/L),HEPES(10mmol/L),葡萄糖(10mmol/L)。实验细胞外液为:在基础细胞外液中,加1、10、30、50和100μmol/L五种不同剂量的H2O2作为扰动剂。
培养的内皮细胞用基础细胞外液漂洗2~3次,洗掉细胞表面的残渣,每皿细胞加入1mL荧光负载液(5μmol/LFluo-3/Am(美国Invitrogen公司)),37℃负载30min,再次用基础细胞外液洗涤2~3次,充分洗掉没有进入细胞内的荧光探针,加入1mL基础细胞外液,上机待测。
将负载好的细胞放在激光共聚焦显微镜(德国Leica)载物台上,扫描条件为:激发波长488nm,物镜20X,扫描速度为快速扫描,扫描密度512×512,扫描模式为时间序列扫描,扫描间隔时间Ts=3.6s。这样,可以获得细胞内钙变化的时序图,细胞内钙浓度用荧光强度Fluo-3表示。
2.3 实验方法
取6皿细胞分别用于全局对照皿,1、10、30、50、100μmol/L剂量H2O2扰动实验。每个实验在加入扰动剂前,先记录10min胞内钙荧光用于自身对照。然后,移开显微镜头,加入扰动剂,再记录50min胞内钙荧光。全局对照,连续记录60min。
2.4 细胞内钙状态图绘制
根据文中1.3鲁棒性理论,建立细胞内钙状态图作为鲁棒性分析的基础。将所获得的细胞内钙时序图分自身对照期(时长t=10min)、扰动期(t≤20s)和扰动响应期(时长t=50min)3个时段。在采样时刻t=0,Ts,2Ts,…,NTs(或采样点0,1,2,…,N),获得所对应的细胞内钙状态数据x(0),x(Ts),x(2Ts),…,x(NTs),组成细胞内钙状态向量数据集为

式中,x(0),x(1),…,x(m)(mTs=10min)为自身对照期数据集;x(n),x(n+1),…,x(N)(NTsnTs=50min)为扰动响应期数据集。x(m+1),…,x(n-1)为扰动期,即移开显微镜头加入扰动剂所需的时间,其数据不参与分析。
这样,细胞内钙状态变化率数据集为

根据式(11)和式(12)的数据集,以细胞内钙状态x为横坐标、细胞内钙状态变化率为纵坐标,绘制-x的细胞内钙状态图。这样,式(1)或式(2)系统是一种以x和为变量的二维系统。
2.5 标称系统稳态点和稳定域的实验确定
根据式(2),标称系统是指加扰动剂前的细胞系统。研究细胞内稳态的前提是:细胞在遭受外源因素扰动前,标称系统是稳定的。用以下方法,对标称系统的稳定性作定量判断。
在自身对照期,取细胞内钙状态x在所遍历时间(0,mTs)内的均值xe和方差σ2分别为
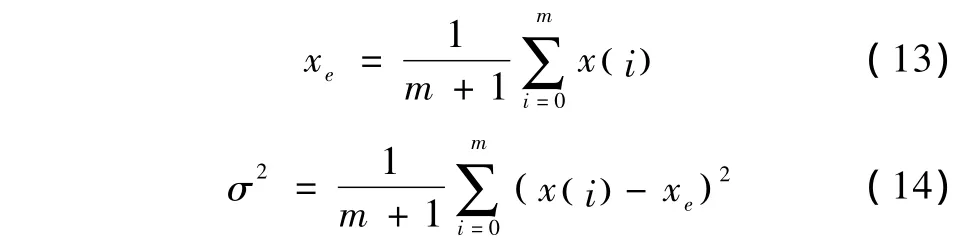
式中,xe为稳态点,表征标称系统在遍历时间(0,mTs)内细胞内钙所处的稳态。

由于式(2)标称系统是二维系统,根据Lyapunov稳定性和鲁棒性理论,其稳定点是一种封闭轨道线形成的中心点。该中心点是一个以(xe,0)为中心,以
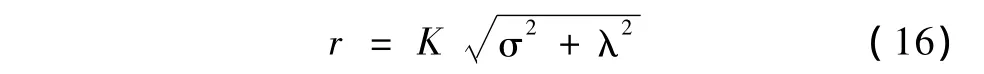
为半径的圆域A,K为置信系数,且Lyapunov稳定。因此,该圆域A即为稳定域。
2.6 扰动作用下细胞内钙状态转移的实验判断
在扰动响应期(nTs,NTs),细胞内钙状态x是关于以带扰初态x0=x(t0)=xe为起点,在遍历时间(nTs,NTs)内对应的轨线x(t,t0,xe)。该轨线的每一个采样点(x(i),(i))(i=n,n+1,…,N)距离标称系统稳定点中心(xe,0)的距离为
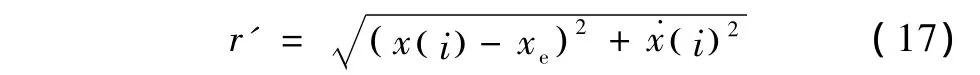
如果r’<r,可以判断细胞在遭受扰动剂作用后,内钙状态仍保持在稳定域A内,是Lyapunov稳定的。否则,可以判断细胞内钙状态发生转移。
2.7 扰动剂稳定鲁棒域的实验确定
对6皿细胞分别编号1~6号,其中1号为全局对照,2~6号分别为1、10、30、50、100μmol/L剂量H2O2扰动。每皿分别选择8个细胞做记录,每个细胞通过自身对照期确定了稳态点(xe,0)和稳定域A。扰动响应期内每一个细胞的内钙状态x均为以带扰初态x(t0)=xe为起点的一条轨线x(t,t0,xe)。每种剂量的扰动均对应8条这种轨线,判断每条轨线是否处于Lyapunov渐进稳定。
若轨线x(t,t0,xe)处于Lyapunov稳定,表明该扰动剂剂量对该细胞作用在稳定鲁棒域D内,否则,不在D内。若轨线x(t,t0,xe)处于Lyapunov渐进稳定,表明该剂量的扰动剂对该细胞作用在稳定鲁棒域D边界。这样,以进入Lyapunov渐进稳定所对应的扰动剂剂量确定为稳定鲁棒域D。
3 结果与讨论
3.1 钙荧光负载
内皮细胞经荧光探针Fluo-3/AM负载30min后,进行钙荧光强度测定。可见荧光负载的背景值低,荧光在细胞中负载均匀,胞体清晰可见。同一皿中的细胞初始荧光强度并不一致,表明对不同细胞初始胞内浓度[Ca2+]i是不相等的。
3.2 标称系统的内稳态与稳定域
按式(13)~式(16)获得6皿48个细胞在遭受扰动剂作用前,细胞内钙的稳态点xe和稳定域r如表1所示。这48个细胞自然生长条件相同(即来源于同一种源,在同一环境中培养),然而,细胞内钙的稳态点却从0.709到8.189不等,相差1个数量级,表明不同细胞即使在同一条件下生长,其内钙状态有较大的差别,表现出强烈的个体差异。另一方面,稳定域半径从0.654到2.650不等分布,相差3倍,表明这48个细胞的稳定性较好,可以排除后续扰动实验中细胞不稳定对结果的影响。
根据控制理论,稳定域半径r是一种欧几里得范数(2-范数),具有齐次性。因此,我们根据本例实际设置式(16)中置信系数K=2。
3.3 扰动作用下细胞内钙状态转移
图2是6个细胞皿中其中一个细胞内钙的全景时序图和相应的状态图,一张完整的全景时序图有自身对照期(0~mTs)、扰动期((m+1)Ts~(n-1)Ts)和扰动响应期(nTs~NTs)3个时期。从时序图中可见:当按2.3实验方法移开镜头加扰动剂期间,细胞荧光为0,对应的状态图回到了原点。
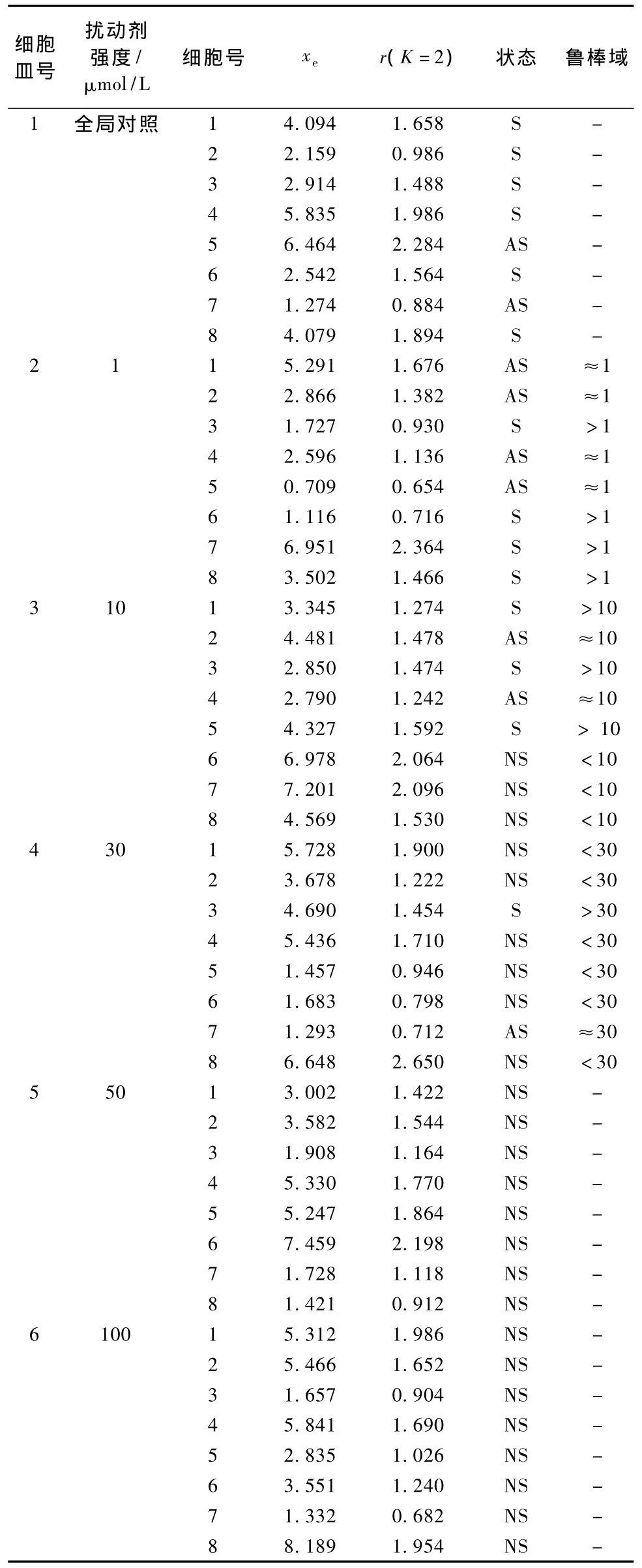
表1 内皮细胞内钙稳态与鲁棒性Tab.1 Inner calcium homeostasis and robustness domain of H2O2on endothelial cells
用式(17)可以判断2~6号细胞皿中共40个细胞内钙稳定状态如表1所示。结果表明:1μmol/L扰动剂扰动内皮细胞,在8个细胞中,4个细胞内钙状态稳定,4个渐近稳定,表明1μmol/L扰动剂不足以引起细胞内钙状态的变化。10μmol/L扰动剂扰动,8个细胞中,有3个细胞内钙状态稳定,2个渐近稳定,3个不稳定,表明10μmol/L已经可以扰动使一些细胞内钙状态不稳定。30μmol/L扰动剂扰动,8个细胞中,只有1个细胞内钙状态稳定,1个渐近稳定,6个不稳定,表明30μmol/L已经使多数细胞内钙状态不稳定。50和100μmol/L扰动,全部细胞状态均不稳定,表明这两个剂量的扰动剂已经足以使细胞内钙状态转移。
表1结果显示,细胞内钙初态x0=xe较小或较大的细胞受扰动后内钙状态有的稳定或渐进稳定,有的不稳定。表明初态x0=xe对细胞受扰后状态稳定性影响不大。
3.4 扰动剂的稳定鲁棒域
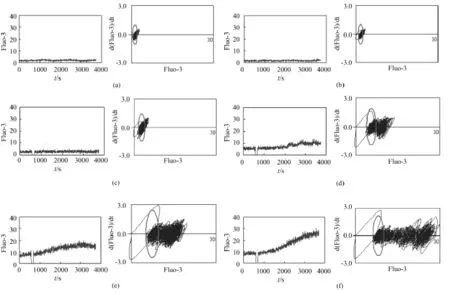
图2 细胞内钙的全景时序图(左)及其状态图(右):(a)对照;(b)1μmol/L;(c)10μmol/L;(d)30μmol/L;(e)50μmol/L;(f)100μmol/L。Fig.2 Whole time sequence(left)and state-chart(right)of inner calcium on the endothelial cells,(a)control;(b)1μmol/L;(c)10μmol/L;(d)30μmol/L;(e)50μmol/L;(f)100μmol/L。
从表1可见,1μmol/L的扰动剂可以使4个细胞发生渐进稳定,表明1μmol/L扰动剂是这4个细胞可能的鲁棒域。10μmol/L扰动剂可以使2个细胞渐近稳定,表明10μmol/L扰动剂是这2个细胞可能的鲁棒域。30μmol/L扰动剂可以使1个细胞渐近稳定,表明30μmol/L扰动剂是这个细胞可能的鲁棒域。从而可得,稳定鲁棒域D与细胞个体有关,并且不同细胞个体所对应的D差别较大,进一步表明个体差异对稳定鲁棒域D的影响。
另一方面,对内皮细胞群体来说,超过50μmol/L的扰动剂均不能使细胞状态回到标称系统的稳定点,这表明内皮细胞种族的内钙稳态鲁棒域D至少在50μmol/L以内。因此,实验表明内皮细胞种族的稳态鲁棒域D至少在50μmol/L以内,但个体的稳态鲁棒域D需因个体而定。
4 结论
通过以用H2O2扰动内皮细胞内钙稳态为例,证明利用控制理论的结论设计生物鲁棒性实验,以及用Lyapunov稳定性理论和鲁棒性理论实现细胞内钙稳态定量化分析是一种有效的方法。
[1]维纳,著.控制论(关于在动物和机器中控制和通信的科学)[M].北京:北京大学出版社,2007:13-30,83-96.
[2]Barkai N,Leibler S.Robustness in simple biochemical networks[J].Nature,1997,387:913-917.
[3]Alon U,Surette MG,Barkai N,et al.Robustness in bacterial chemotaxis[J].Nature,1999,397:168-171.
[4]Laub MT,Loomis WF,A molecular network that produces spontaneous oscillations in excitable cells of dictyostelium[J].Mol.Biol.Cell,1998,9:3521-3532.
[5]Von Dassow G,Meir E,Munro EM,et al.The segment polarity network is a robust developmental module[J].Nature,2000,406:188-192.
[6]Meir E,vonDassow G,Munro EM,et al.Robustness,flexibility,and the role of lateral inhibition in the neurogenic network[J].Curr Biol,2002,12:778-786.
[7]Dartnella L,Simeonidisb E,Hubankc M,et al.Robustness of the p53 network and biological hackers[J].FEBS,2005,579:3037-3042.
[8]Ma L,Iglesias PA.Quantifying robustness of biochemical network models[J].BMC Bioinformatics,2002,3:38.
[9]Yi TM,Huang Y,Simon MI,et al.Robust perfect adaptation in bacterial chemotaxis through integral feedback control[J].PNAS,2000,97(9):4649-4653.
[10]Freeman M.Feedback control of intercellular signalling in development[J].Nature,2000,408:313-9.
[11]Radde N.The impact of time delays on the robustness of biological oscillators and the effect of bifurcations on the inverse problem[J],EURASIP J Bioin for Sys Biol,2009,2009:1-14.
[12]Borisuk MT,Tyson JJ,Bifurcation analysis of a model of mitotic control in frog eggs[J].J Theor Biol,1998,195:69-85.
[13]Apri M,Molenaar J,Gee M,et al.Efficient estimation of the robustness region of biological models with oscillatory behavior[J].PLoS ONE,2010,5(4):e9865.
[14]Kim J,Bates DG,Postlethwaite I,et al.Robustness analysis of biochemical network models[J].IEE Proc Syst Biol,2006,153(3):96-104.
[15]Kitano H,Cancer as a robust system:implications for anticancer therapy[J].Nature Reviews,2004,4:227-235.
[16]朱炳,包家立,应磊.生物鲁棒性的研究进展[J].生物物理学报,2007,23(5):357-362.
[17]Chen BS,Wang YC,Wu WS,et al.A new measure of the robustness of biochemical networks[J],Bioinformatics,2005,21(11):2698-2705.
[18]毛连根,朱朝阳,包家立,等.一种血压反馈控制系统的状态分析方法[J].中国生物医学工程学报,2010,29(2):259-264.
[19]Kitano H,Cancer as a robust system:implications for anticancer therapy[J].Nature Reviews,2004,4:227-235.
[20]Kitano H,Oda K,Kimura T,et al.Metabolic syndrome and robustness tradeoffs[J].Diabetes,2004,53(Suppl 3):S6-S15.
[21]苗东升,著.系统科学精要[M].北京:中国人民大学出版社,1998:62-68.
[22]De Nicolao G,Magni L,Scattolini R,On the Robustness of receding-horizon control with terminal cnonstraints[J].IEEE Trans Automatic Control,1996,41(3):451-453.
[23]李阳春,许晓鸣,杨煜普.一类非线性预测控制系统的鲁棒稳定性[J].自动化学报,1999,25(6):852-855.

