重组人促红细胞生成素对脑出血患者神经元再生的影响
王世金,赵海滨
脑出血是严重的急性脑血管事件,往往导致严重的神经功能障碍,使患者丧失劳动力甚至生活自理能力,严重影响其生活质量,并导致严重的社会负担[1]。大量的神经元和神经胶质细胞死亡及神经传导通路损伤是其病理基础,长期以来人们发现中枢神经系统自身修复能力十分有限,随着脑内神经干细胞的发现,受损中枢神经系统的修复和再生研究也取得了重大进展。神经元再生成了神经科学研究的热点,也是临床亟待解决的重大课题。本研究观察脑出血患者经腰椎穿刺注入重组人促红细胞生成素 (rhEPO)后血清血管内皮细胞生长因子(VEGF)、碱性成纤维细胞生长因子 (bFGF)的水平变化及欧洲卒中量表 (ESS)评分变化,分析rhEPO对神经元再生的影响。
1 资料与方法
1.1 一般资料 选择2007-07-01—2010-06-30在济阳县人民医院住院的急性高血压性脑出血患者41例为研究对象,病例入选标准:(1)均符合全国第四届脑血管病会议制定的脑出血的诊断标准[2],并经颅脑CT扫描确诊;(2)出血量少于20 ml;(3)首次发病者或既往发病但未留下肢体瘫痪后遗症的再发病者;(4)发病在24 h之内;(5)年龄在40~75岁。病例排除标准:(1)脑梗死后出血;(2)继发于其他系统疾病 (如血液病、肿瘤等)的脑出血; (3)后颅凹部位出血;(4)严重肝、肾功能损害;(5)心房纤颤患者或有严重心功能不全者;(6)并发严重消化道出血者;(7)并发严重感染者;(8)近3个月内未服用抗凝、抗血小板、溶栓及降糖类药物者;(9)过敏体质者。将41例患者随机分成两组,对照组20例,男12例,女8例,平均年龄 (55.1±10.6)岁,出血量(13.5±5.9)ml,入院时ESS评分 (54±8)分。治疗组21例,男13例,女8例,平均年龄 (56.1±11.2)岁,出血量(13.8±5.7)ml,入院时ESS评分 (53±9)分。入院时两组患者的性别、年龄、脑出血量、ESS评分有均衡性。
1.2 方法
1.2.1 治疗方法 对照组和治疗组均给予脑出血的常规处理,包括降低颅内压、防治并发症、支持治疗等,在此基础上治疗组每例患者给予rhEPO 5 000 U,经腰椎穿刺鞘内注入,分别于第1、4、7、10、14、17、21天给予1次。
1.2.2 检测方法 两组患者分别于鞘内注药的第1、4、7、10、14、17、21天,采集清晨空腹肘静脉血3 ml(生化管),室温放置待凝固后,以3 000 r/min离心10 min,分离血清,置于-20℃冰箱保存待测VEGF、bFGF,并采用ESS评定患者的神经功能变化。
1.3 统计学方法 所有数据的处理应用SPSS 12.0统计软件,计量资料以 (±s)表示,两组均数的比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的各观察指标比较 治疗的第1、4天两组患者的血清VEGF、bFGF水平间差异均无统计学意义 (P>0.05),而治疗的第7、10、14、17、21天两组患者的血清VEGF、bFGF水平间差异均有统计学意义 (P<0.05,见表1、表2)。治疗的第1、4、7天两组患者的ESS评分间差异无统计学意义(P>0.05),而治疗的第10、14、17、21天两组患者的ESS评分间差异均有统计学意义 (P<0.05,见表3)。
2.2 安全性 腰椎穿刺注入rhEPO治疗脑出血的过程中未发现有病情加重者。
3 讨论
脑出血是一种严重危害人类健康的中枢神经系统疾病,近几年脑出血的损伤机制及脑出血后神经功能恢复的研究不断深入[3-5]。本研究主要探讨了rhEPO对脑出血后神经元再生及神经功能恢复的作用。
表1 两组患者的血清VEGF水平比较 (±s,pg/ml)Table1 Comparison of VEGF in serum between two groups

表1 两组患者的血清VEGF水平比较 (±s,pg/ml)Table1 Comparison of VEGF in serum between two groups
组别 例数 第1天 第4天 第7天 第10天 第14天 第17天 第21天对照组 20 200±65 265±76 354±84 457±73 415±89 357± 87 324±88治疗组 21 208±74 289±85 589±88 759±76 846±84 984±102 894±105 t 值0.367 0.951 8.74 12.96 15.76 21.13 18.79 P值 >0.05 >0.05 <0.05 <0.05 <0.05 <0.05 <0.05
表2 两组患者的血清bFGF水平比较 (±s,pg/ml)Table2 Comparison of bFGF in serum between two groups

表2 两组患者的血清bFGF水平比较 (±s,pg/ml)Table2 Comparison of bFGF in serum between two groups
组别 例数 第1天 第4天 第7天 第10天 第14天 第17天 第21天对照组 20 8.4±0.2 15.6±0.5 16.4±0.8 15.3±0.6 15.9±1.1 14.8±1.0 15.4±0.9治疗组 21 8.3±0.2 15.9±0.6 26.7±1.2 30.5±1.0 40.8±1.6 40.9±1.3 39.5±1.2 t 值1.100 1.735 32.17 58.64 35.04 44.29 72.46 P值 >0.05 >0.05 <0.05 <0.05 <0.05 <0.05 <0.05
表3 两组患者的ESS评分比较 (±s,分)Table3 Comparison of ESS scroes between two groups
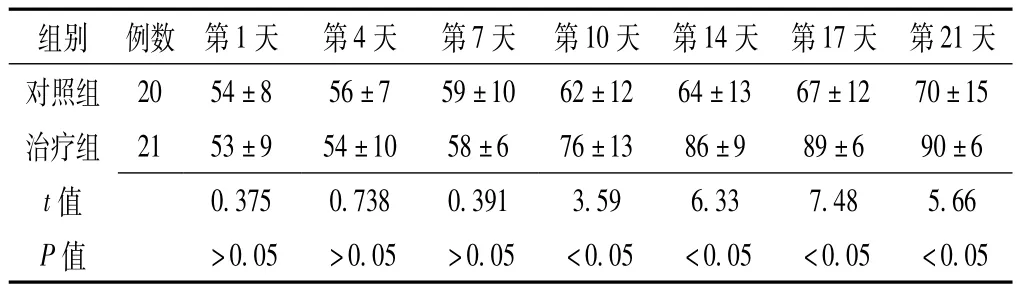
表3 两组患者的ESS评分比较 (±s,分)Table3 Comparison of ESS scroes between two groups
组别 例数 第1天 第4天 第7天 第10天 第14天 第17天 第21天对照组20 54±8 56±7 59±10 62±12 64±13 67±12 70±15治疗组 21 53±9 54±10 58±6 76±13 86±9 89±6 90±6 t 值0.375 0.738 0.391 3.59 6.33 7.48 5.66 P值 >0.05 >0.05 >0.05 <0.05 <0.05 <0.05 <0.05
脑出血造成局部脑组织软化和胶质细胞增生形成胶质瘢痕,并引起相应的神经功能缺失。近一个世纪以来,国内外医学界把脑病治疗的重点放在了脑血管上,而对神经元修复的研究则相对滞后。神经干细胞的发现为脑出血的治疗开辟了一条崭新的道路。20世纪90年代初,Reynolds等[6]从成年小鼠脑纹状体中分离出能在体外不断分裂增殖,且具有多种分化潜能的细胞群,并正式提出了神经干细胞的概念,从而打破了认为神经元不能再生的传统理论。脑出血后神经可塑性主要体现在神经元再生、突起再生、突触可塑、神经网络重塑、功能重组和功能脑区转移等方面,而神经元再生的作用越来越受到重视。目前已公认,成体哺乳动物神经元再生主要位于脑内的两个区域,即侧脑室外侧壁的脑室下带 (SVZ)和海马齿状回(DG)的颗粒细胞下层 (SGZ)。这两个区域起源的神经干细胞终生存在,持续有神经元再生现象,学习、运动、复杂的环境以及一些病理状况、细胞因子等均可促进神经元再生。DG的神经元再生与记忆有关,而生理状态下SVZ一般是为嗅球提供替代的神经元,在脑损伤后可见部分神经元前体细胞从SVZ向邻近的受损区移行。与啮齿类动物相似,在人类的脑内也发现了SVZ的神经元再生,并有大量新生神经元向嗅球移行[7]。如何利用内源性的神经元再生促进脑损伤后的神经功能恢复是近年来神经科学研究的热点。
多种细胞因子参与多种内源性神经干细胞的增殖和分化[8-9],目前研究较多的有 VEGF、bFGF、表皮生长因子(EGF)、成纤维细胞生长因子 (FGF)、脑源性神经营养因子(BDNF)、神经生长因子 (NGF)、胰岛素样生长因子 (IGF)、血小板源性生长因子 (PDGF)、维甲酸等。Tarasenko等[10]研究不同的生长因子单独或联合运用〔如EGF、白血病抑制因子 (LIF)、bFGF等〕对人类神经干细胞分化的影响,发现层黏连蛋白促进神经干细胞向神经元分化;应用EGF和bFGF或EGF、bFGF和LIF后神经干细胞能显著分化产生胆碱能神经元,该研究结果提示神经干细胞有很高的可塑性,其增殖和分化依赖不同的生长因子。
近10年来研究发现,EPO及其受体(EPOR)在脑内也有表达,其被作为神经系统的一种新型保护剂而受到越来越多的关注[11]。在实验性蛛网膜下腔出血的模型中,应用EPO能缓解基底动脉痉挛和降低神经元坏死的数量[12],并且防止自主神经调节的脑血流量的丢失[13]。所以在本研究中采用血清bFGF、VEGF测定和ESS评分反映神经元再生,鉴于成体哺乳动物神经元再生主要位于侧脑室外侧壁的SVZ和DG的SGZ,所以在本研究中采用rhEPO,通过腰椎穿刺的方法,把rhEPO输送到脑室周围,起到调控神经元再生的目的。
各种脑损伤后神经前体细胞增殖发生、发展的时间可能也因原发损伤类型、应用的动物模型等不同而异。有研究表明沙鼠中DG的神经元再生在短暂脑缺血后11 d达到高峰[14]。而在大鼠的大脑中动脉梗死模型中,脑缺血后14 d同侧SVZ及基底核脑缺血区神经元再生显著增加[15]。大鼠的颅脑创伤模型在创伤后3 d即可观察到神经元再生的增加[16]。在小鼠的蛛网膜下腔出血模型中,出血后最初3 d神经元再生明显受到抑制,出血7 d后恢复并开始增生[17]。
本研究结果表明,腰椎穿刺输送rhEPO能有效地促进脑神经元的再生。通过观察两组ESS评分:第1、4、7天两组ESS评分无明显差别,第10、14、17、21天治疗组的ESS评分明显高于对照组,说明rhEPO能有效改善神经功能,减轻患者的后遗症,达到治疗的目的,其原因是rhEPO能促进神经元再生,改善神经功能。
本研究纳入的脑出血患者样本量较小,临床观察时间较短,并且鉴于再生部位的限制,我们采用腰椎穿刺注入rhEPO,在临床中不甚方便,能否采用皮下注射的方法,有待于进一步研究;还有,本研究中我们采用血清bFGF、VEGF的水平反映神经元再生,不如做病理图片反映再生确切,但现在临床中还没有找到能和病理图片相媲美的指标,所以积极寻找神经再生的临床指标也非常迫切。
1 He J,Gu D,Wu X,et al.Major causes of death among men and women in China[J].N Engl J Med,2005,353:1124-1134.
2 中华神经科学会中华神经外科学会.各类脑血管病诊断要点[J].中华神经科杂志,1996,29(6):379-380.
3 Yang S,Nakamura T,Hua Y,et al.The role of Complement C3 in intracerebral hemorrhage-einduced brain injury[J].J Cereb Blood Flow Metab,2006,26(12):1490-1495.
4 Qin Z,Song S,Xi G,et al.Preconditioning with hyperbaric oxygen attenuates brain edema after experimental intracerebral hemorrhage[J].Neurosurgical Focus,2007,22(5):E13.
5 Lee HJ,Kim KS,Kim EJ,et al.Brain transplantation of immortalized human neural stem cells promotes functional recovery in mouse intracerebral hemorrhage stroke model[J].Stem Cells(Dayton Ohio),2007,25(5):1204-1212.
6 Reynolds BA,Weiss S.Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system[J].Seienee,1992,255(5052):1707-1710.
7 Curtis MA,Kam M,Nannmark U,et al.Human neuroblasts migrate to the olfactory bulb via a lateral ventricular extension[J].Science,2007,315(5816):1243-1249.
8 Kalluri HS,Dempsey RJ.Growth factors, stem cells,and stroke[J].Neurosurgical Focus,2008,24(3-4):E14.
9 Pencea V,Bingaman KD,Wiegand SJ,et al.Infusion of brain-derived neurotrophic factor into the lateral ventricle of the adult rat leads to new neurons in the parenchyma of the striatum,septum,thalamus,and hypothalamus[J].J Neurosci,2001,21(17):6706-6717.
10 Tarasenko YI,Yu Y,Jordan PM,et al.Effect of growth factors on proliferation and phenotypic differentiation of human fetal neural stem cells[J].Journal of Neuroscience Research,2004,78(5):625-636.
11 CseteM,Rodriguez L,WilcoxM,et al.Erythropoietin receptor is expressed on adult rat dopaminergic neurons and erythropoietin is neurotrophic in cultured dopaminergic neuroblasts[J].Neurosci Lett,2004,359(1-2):124-126.
12 Assandri R,Egger M,Gassmann M,et al.Erythropoietin modulates intracellular calcium in a human neuroblastoma cell line[J].J Physiol,1999,516(Pt 2):343-352.
13 Springborg JB,Ma X,Rochat P,et al.A single subcutaneous bolus of erythropoietin normalizes cerebral blood flow regulation after subarachnoid haemorrhage in rats[J].Br J Pharmacol,2002,135(3):823-829.
14 Liu J,Solway K,Messing RO,et al.Increased neurogenesis in the dentate Gyrus after transient global ischemia in gerbils[J].J Neurosei,1998,18(19):7768-7778.
15 Parent JM,Vexler ZS,Gong C,et al.Rat forebrain neurogenesis and striatal neuron replacement after focal stroke[J].Annals of Neurology,2002,52(6):802-813.
16 Dash PK,Mach SA,Moore AN.Enhanced neurogenesis in the rodent hippocampus following traumatic brain injury[J].Journal of Neuroscience Research,2001,63(4):313-319.
17 Mino M,Kamii H,Fujimura M,et al.Temporal changes of neuro genesis in the mouse hippocampus after experimental subarachnoid hemorrhage[J].Neurological Researeh,2003,25(8):839-845.

