氧化硼对铁磷酸盐玻璃陶瓷固化体的影响
秦红梅,廖其龙,*,潘社奇,王 巍
(1.西南科技大学 四川省非金属复合与功能材料重点实验室-省部共建国家重点实验室培育基地,四川 绵阳 621010;2.表面物理与化学国家重点实验室,四川 绵阳 621907)
高放废物(HLW)是一多组分的复杂体系,不可能用同一种方法将不同高放废物进行固化[1]。玻璃陶瓷固化兼有玻璃固化和陶瓷固化的优点,可固化长寿命的放射性核素(如锕系元素),使它们进入更具耐久性的晶相中,而其他大部分的核素则容纳在不具有选择性固化的玻璃相中。研究[2-4]表明,铁磷酸盐(IP)玻璃具有很好的化学稳定性,因含有大量磷酸盐、氧化铁、氧化铬和其他一些贵金属氧化物或稀土金属氧化物的核废料在IP玻璃中有较大的溶解度,用它作为高放废物固化基础玻璃,很多性能都优于硼硅酸盐基础玻璃。Bingham 等[5-6]将B2O3掺入到40Fe2O3-60P2O5体系玻璃中,并对其热稳定性、铁离子环境、浸出性能和辐照稳定性等进行评价,研究结果表明,在Fe2O3-P2O5体系玻璃中加入一定量B2O3,对该体系玻璃化学稳定性的影响较小,但基础玻璃的热稳定性大幅提高,辐照稳定性也较好。另外,B2O3具有增加低温黏度、降低高温黏度的作用,还有很高的热中子吸收系数和质量吸收系数。本研究拟在组成为36Fe2O3-54P2O5-10CaF2的玻璃中直接加入B2O3或以B2O3代替部分Fe2O3加入,以此为基础玻璃来固化模拟的高放废物,以探讨B2O3掺量对IP玻璃陶瓷固化体结构与性能的影响。
1 实验
1.1 模拟高放废物组成的确定
在实验室模拟高放废物固化研究中,TRU+U为超铀元素,有很强的放射性,常用与其化学性质相似的Zr代替[7]。三价和四价的锕系元素用Ce来模拟,且Ce和Pu具有相似的化学性质,也可用于模拟武器级Pu[8]。根据我国高放废液的特点[1],确定研究的模拟高放废物组成列于表1。
1.2 玻璃陶瓷固化体的制备
1)基础玻璃的制备
在组成为36Fe2O3-54P2O5-10CaF2的玻璃中加入B2O3作为基础玻璃,加入方式为:1)以36Fe2O3-54P2O5-10CaF2为基准,直接加入 0、5%、10%、15%(摩尔分数,余同)的 B2O3(记为0B、5B、10B和15B);2)以B2O3直接代替5%、10%、15% 的 Fe2O3(记 为 5BF、10BF 和15BF)。配方中加入10%的CaF2作为助熔剂。由分析纯原料(>99%的Fe2O3、NH4H2PO4、H3BO3、CaF2)按表2所设计的玻璃组成进行配料,将配料混合均匀后置于粘土坩埚中,在高温炉中升温至1 100℃并保温1~2h后将玻璃液水淬,烘干,磨细,过200目筛备用。

表1 高放废物的模拟金属氧化物配方Table 1 Composition of simulated HLW

表2 基础玻璃的氧化物组成Table 2 Composition of glass matric
2)玻璃陶瓷固化体的制备
将高放废物模拟金属氧化物(表1)和玻璃粉按80∶20(质量比)的比例配料,以无水乙醇为分散剂,球磨10h混合均匀,加入5%的PVA作粘结剂造粒,过80目筛,在40MPa下成型为直径12mm的圆柱(长径比约为1),烘干的固化坯体以1℃/min的速率升温,在500℃下保温1h排胶,然后以3℃/min的速率升温至920℃保温3h,最后随炉冷却至室温。
1.3 样品性能测试与结构分析
试样的DTA测试用仪器为德国耐驰仪器公司STA499C“热重/差热”同步热分析仪。测试温度为室温~1 000℃,升温速率为10℃/min,空气气氛。
用游标卡尺测量试样的直径、厚度,电子天平测量试样的质量,计算试样的体积密度。
试样的XRD测试用日本理学公司的D/max-RB型 X射线衍射仪,2θ角为10°~80°。
采用KBr压片法用270-30红外光谱仪对所制备的试样在2 000~400cm-1范围进行红外吸收光谱(FTIR)测试。
用溶解速率法(DR)测定玻璃陶瓷固化体的化学稳定性,其测试方法为:将样品(φ12mm,高径比约为1的圆柱体)分别在去离子水和无水乙醇中超声清洗3次,每次3~5min,清洗后放入110℃的烘箱中干燥2h,在干燥器内冷却至室温,称其重量(±0.1mg)。将试样用细塑料线拴住悬挂于聚乙烯塑料瓶中,加入去离子水的体积V水和试样表面积S试样的比值V水/S试样=10cm,置于(90±2)℃的烘箱中,分别在3、7、14、28d将样品取出称量(每次称量前都要干燥至恒重)。由下式计算试样质量损失速率:

式中:DR为块体试样的质量损失速率,g/(cm2·min);ΔW为每个浸泡周期试样的失重,g;SA为试样表面积,cm2;t为浸泡时间,min。
2 结果与讨论
2.1 DTA分析
部分试样的DTA曲线如图1所示。玻璃的DTA曲线通常有至少1个吸热峰,在吸热峰对应温度的更高温度会出现至少1个放热峰。吸热归因于玻璃在该温度发生了结构松弛,在吸热开始的温度对应于该玻璃试样的玻璃转变温度tg,低于该温度玻璃的结构是完整的。放热归因于玻璃试样的析晶,第1个开始放热的温度对应于玻璃的开始析晶温度tc1。通常,tg增加表明玻璃网络结构得到了增强,玻璃网络结构更不易调整,tg减小表明加入离子减弱了玻璃的网络结构。在DTA分析中,Hruby理论[9]可用来定性地表征玻璃的形成性和热稳定性。根据该理论,tc1-tg越大,玻璃的热稳定性和玻璃形成性越好。
从图1可看出,固化体试样有1个吸热峰出现在360~400℃之间,但玻璃转变温度不是很明显,可见固化体中玻璃相含量较少。放热峰位于700~900℃之间,通过大量实验得出,在920℃下保温3h制得的固化体最好,所以,将析晶温度定为920℃,保温时间为3h。

图1 部分试样的DTA曲线Fig.1 DTA curves for some samples
2.2 体积密度
图2示出固化体的密度随B2O3掺量及不同掺入方式的变化。可看出,直接加入B2O3时,随掺量的增大,密度先增大后减小,在B2O3掺量为10%时密度达到最大,约为2.32g/cm3。而B2O3代替Fe2O3掺入时,试样的密度随其掺量的增大也是先增大后减小,在10BF时达到极值点,即10%的B2O3代替Fe2O3时密度达到最大,为2.75g/cm3。

图2 掺不同含量B2O3的固化体试样密度Fig.2 Density for wasteform samples doped with different B2O3contents
由于存在硼反常现象,开始时有较多的非玻璃网络形成体氧化物,硼的存在形式由硼氧三角体转变为硼氧四面体,从而加强了网络结构,更多的金属氧化物进入网络间隙中,所以固化体密度逐渐增大。随着硼掺量的增加,网络修饰体提供的氧不是用于形成硼氧四面体,而是以非桥氧形式出现于三角体中,结构网络连接减弱,密度也随之下降。
在B2O3代替Fe2O3掺入时,由于玻璃网络中间体Fe2O3大量被玻璃网络形成体B2O3取代,这样基础玻璃便可容纳更多的非玻璃网络形成体氧化物,所以密度较高。
固化体的密度主要取决于它的组成和结构,与原子的质量、堆积密度及配位数等有关,是表征其结构的一个指标。固化体的密度较高,有利于减小高放废物固化体的体积,从而便于固化核废料。因此,以10%的B2O3代替Fe2O3掺入时,在920℃下保温3h烧成的固化体试样密度较高,更有利于固化放射性废物。
2.3 化学稳定性分析
经浸泡后样品颜色、形状基本无变化,浸出液为无色透明液体,与浸出前无异,浸出液pH变化也不大。只有15B试样容器底部观测到部分沉淀,样品有开裂和掉渣,pH由浸出前的6变为4;15BF表面有白色浸出物,pH变化较大,由浸出前的6变为2~4。这两组配方制备的固化体试样体积密度相对来说有所降低,尤其是15B试样密度是7组试样中最低的,结构不是很致密,易受浸出液侵蚀,15B和15BF试样的浸出液pH随浸泡时间的延长而降低,表明固化体与去离子水存在离子交换,固化体中的碱性离子浸出,使得浸出液显酸性。
图3为试样在90℃去离子水中不同浸泡周期的质量损失速率。3~14d的质量损失速率逐渐降低,浸出率为10-7~10-8g/(cm2·min),可见固化体的化学稳定性较好。然而在14~28d的过程中,浸出率有升有降,较为稳定的是10BF试样,28d的质量浸出率为7.81×10-9g/(cm2·min),表明至少在 28d时试样还具有很好的化学稳定性。一般来说,试样在3d时浸出率均较高,随着时间的延长会迅速下降,直到趋于稳定,达到平衡。存在反常的原因是:15B试样体积密度较小,结构不是很致密,较易受浸出液侵蚀,浸泡28d结构还未达到稳定,容器底部还有少量掉渣,降低的幅度较大还有可能是未充分烘干。另外,以B2O3代替Fe2O3掺入的试样28d的浸出率较直接掺入B2O3的都低,化学稳定性较好。这与固化体试样密度较高有关。

图3 试样在90℃去离子水中不同浸泡周期的质量损失速率Fig.3 Dissolution rate for samples measured in DIW at 90 ℃in different periods
2.4 XRD分析
图4为部分试样的XRD图谱。从图4可知,固化体试样的主晶相为独居石。另外,样品中还引入了少量SiO2,是由于用粘土坩埚熔融玻璃以及玻璃粉和原料的研磨过程中引入的。天然自生的独居石常含有许多放射性元素,在自然界中历经了上亿年的地质作用却依旧稳定存在,具有很好的化学稳定性,有利于固化高放废物。在独居石结构中,Ce、La等位于[PO4]四面体的包围之中,这样就使得高放废物中半衰期很长的锕系、镧系元素等作为独居石型结构矿物的主要成分而固化。
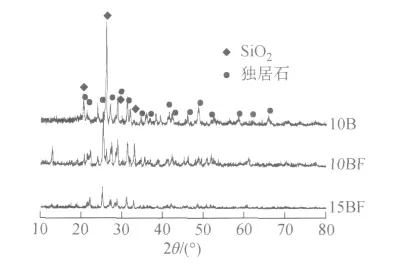
图4 部分固化体试样的XRD图谱Fig.4 XRD patterns for some wasteform samples
2.5 红外光谱分析
图5为部分玻璃基体(用G标出)和固化体试样的FTIR谱图。由文献[10]可知,天然独居石的吸收峰分别是:位于1 092~1 090、1 059~1 056、1 019~1 017cm-1的 3 个[PO4]3-的非对称伸缩振动,位于995~997cm-1的O—P伸缩振动,位于953~954cm-1和615~618cm-1的两个Ln—O位移振动,以及位于561、538~541cm-1的2~3个[PO4]3-的弯曲振动。有研究[11]表明,偏磷酸基团[PO3]- 的特征吸收峰在1 250~1 280cm-1处,而焦磷酸基团[P2O7]4-的特征吸收峰位于700~800cm-1。从图5可看出,独居石的红外特征峰几乎全部出现,证明独居石相的大量存在,这从XRD分析中也可看出;在690cm-1处微弱的吸收峰可归结为焦磷酸盐[P2O7]4- 的吸收峰,在1 250~1 280cm-1处未发现偏磷酸基团[PO3]- 的吸收峰存在。因此,可推测固化体试样中含有大量的正磷酸基团[PO4]3-和少量焦磷酸基团[P2O7]4-,而无偏磷酸基团[PO3]- 存在。这也是固化体具有较高化学稳定性的原因所在。

图5 部分玻璃陶瓷固化体试样的FTIR图谱Fig.5 FTIR spectra for some glass-ceramic wasteform samples
此外,从图5还可看出,直接掺入10%的B2O3和以10%的B2O3代替Fe2O3掺入对玻璃基体的网络结构几乎无任何影响。而包容HLW的氧化物进行析晶之后的固化体试样10BF和10B的FTIR图谱差异较大。
10BF试样的图谱各吸收峰均较强,10BF在1 300cm-1附近有明显的吸收峰,表明结构中有大量B—O—B键形成[12],而10B试样在此处的吸收峰则不很明显,由此可推断该试样结构中含有大量的单个[BO3]三角体。另外,10BF试样在红外光谱上表征[BO4]四面体弯曲振动的690cm-1处的吸收峰明显较强,表明结构中[BO4]四面体较多。
在固化体的结构中,孤岛状[PO4]3-阴离子团增加,使得在结构中形成了许多“孔洞”(或网络中未被占据的位置),这些“孔洞”更适合于被金属阳离子所占据,使固化体中能够容纳大量的不同尺寸、不同电荷的阳离子,容纳在“孔洞”中的金属离子能改善固化体的化学稳定性。化学稳定性测试结果也表明,10BF试样具有更高的化学稳定性。
3 结论
在 组 成 为 36Fe2O3-54P2O5-10CaF2的 玻璃中加入B2O3作为基础玻璃,用来固化20%(质量分数)的模拟高放废物,B2O3掺入量和掺入方式对铁磷酸盐玻璃陶瓷固化体有较大影响。
1)无论直接掺入B2O3还是代替Fe2O3掺入时,随着硼掺量的增大,密度均是先增大后减小,以10%(摩尔分数)B2O3代替Fe2O3掺入制备的固化体试样较为致密,为2.75g/cm3,28d的浸出率约为7.81×10-9g·cm-2·min-1,化学稳定性最好。
2)固化体的主晶相为独居石;固化体试样中含有大量正磷酸基团[PO4]3-和少量焦磷酸基团[P2O7]4-,无偏磷酸基团[PO3]- 存在,试样中部分B主要是以[BO4]四面体存在,有利于提高试样的化学稳定性。同时,高放废物中的金属氧化物填充了结构中的“孔洞”,改善了固化体的化学稳定性,使得试样具有非常好的化学稳定性。
[1]宋崇立.分离法处理我国高放废液概念流程[J].原子能科学技术,1995,29(3):201-208.SONG Chongli.The concept flowsheet of partitioning process for the Chinese high-level liquid waste[J].Atomic Energy Science and Technolo-gy,1995,29(3):201-208(in Chinese).
[2]MARASINGHE G K,KARABULUT M,RAY C S,et al.Properties and structure of vitrified iron phosphate nuclear wasteforms[J].Journal of Non-Crystalline Solids,2000,263&264:146-154.
[3]HUANG Wenhai,DAY D E,RAY C S,et al.Vitrification of high chrome oxide nuclear waste in iron phosphate glasses[J].Journal of Nuclear Materials,2004,327(1):46-57.
[4]黄文旵,周萘,Day D E,等.Cr2O3对高放核废料磷酸盐玻璃固化体的影响[J].无机材料学报,2005,20(4):842-850.HUANG Wenhai,ZHOU Nai,DAY D E,et al.Effect of Cr2O3on the HLW iron phosphate glass wasteforms[J].Journal of Inorganic Materials,2005,20(4):842-850(in Chinese).
[5]BINGHAM P A,HAND R J.Structure and properties of iron borophosphate glasses[J].Phys Chem Glasses:Eur J Glass Sci Technol B,2006,47(4):313-317.
[6]BINGHAM P A,YANG G,HAND R J,et al.Boron environments and irradiation stability of iron borophosphate glasses analysed by EELS[J].Solid State Sciences,2008,10:1 194-1 199.
[7]吕彦杰.模拟α-高放废液独居石磷酸盐玻璃陶瓷固化体的研究[D].武汉:中国地质大学,2008.
[8]LOPEZ C,DESCHANELS X,BARTA J M,et al.Solubility of actinide surrogates in nuclear glasses[J].Journal of Nuclear Materials,2003,312(1):76-80.
[9]HRUBY A.Evaluation of glass-forming tendency by means of DTA[J].Czechoslovak Journal of Physics,1972,22(11):1 187-1 193.
[10]Minerals infrared grating spectra:Vol.l[M].Philadelphia,PA,USA:Sadtler Research Laboratories,Inc.,1973.
[11]何涌,张保民.独居石微晶玻璃中玻璃相含量的红外光谱定量测定[J].光谱学与光谱分析,2003,23(2):262-264.HE Yong,ZHANG Baomin.Quantitative determination of glass content in monazite glass-ceramics by IR technique[J].Spectroscopy and Spectral Analysis,2003,23(2):262-264(in Chinese).
[12]法默V C.矿物的红外光谱学[M].应育浦,汪寿松,李春庚,译.北京:科学出版社,1982:159.

