胰岛素样生长因子-1对痴呆模型大鼠额叶、海马Caspase-3 P20活性片段及 Bcl-2蛋白表达的影响
石广滨, 刘 群, 张 昱, 刘洪敏
阿尔茨海默病(AD)是一种神经退行性疾病,其病理特征是神经原纤维缠结、老年斑产生和神经元丢失。其中细胞凋亡是神经元丢失的重要途径,并受 caspases家族和 Bcl-2家族调控。在老年动物中枢神经系统中,尤其是海马结构中 IGF-1表达呈年龄相关性下降[1],有研究证实给予 IGF-1抗体的大鼠学习记忆能力显著下降[2]。因此,认为 IGF-1具有改善老龄动物学习、记忆的能力[3]。研究表明IGF-1可抑制体外培养的神经细胞凋亡[4],IGF-1改善老龄动物学习记忆能力可能与抑制细胞凋亡有关。本实验观察穹隆海马伞切断后 caspase-3 P20活性片段及 Bcl-2表达的变化,并研究 IGF-1对其影响,探讨 IGF-1治疗 AD的机制。
1 材料与方法
1.1 材料 大鼠脑立体定位仪(韩国),Colded CCD图像采集系统(日本),Image-pro p lus图像分析系统(美国),大鼠特异胰岛素样生长因子-1(Peprotech EC公司,英国),兔抗鼠 Caspase-3 P20多克隆抗体(Santa Cruz公司),生物素化羊抗兔 IgG/Bio(Sigma公司),羊抗鼠 Bcl-2多克隆抗体(Santa Cruz公司),生物素化兔抗羊 IgG/Bio(Sigma公司),DAB显色剂(天津灏洋生物公司),双刃刀(自制)。
1.2 方法
1.2.1 动物分组与模型建立 Wistar雄性大鼠,鼠龄 3~4个月,体重 200~250g,全部大鼠在正常温控、光照及自由摄食条件下饲养。用水迷宫筛选反应迅速、活跃的大鼠随机分为正常对照组、假手术组、痴呆组、小剂量 IGF-1组、大剂量 IGF-1组,每组 10只大鼠。用 10%水合氯醛 0.33m l/100g腹腔麻醉动物;将其固定在大鼠脑立体定位仪上;常规剪毛、消毒;正中切开头皮,暴露出颅骨。参照大鼠脑立体定位图谱[5],取前囟后 2.2mm,中线左右各旁开 1.0mm处,牙钻钻开颅骨,切开骨膜;用双刃刀片(宽3.0mm、长30.0mm)置于上述部位的脑表面,行冠状切口;然后降刀 4.5mm,外移 1.0mm,再降刀 1.0mm,外移1.5 mm;接着上下提插刀 20次,以保证双侧海马伞外侧缘完全切断;最后抽出刀片,注意无菌操作,皮肤切开处给予少许青霉素粉剂,缝合切口。假手术组只钻开颅骨,不切断海马伞。正常对照组不给予任何处置。所有实验动物都给予常规饲养。
1.2.2 侧脑室给药方法 参照上述立体定位图谱,在大鼠脑立体定位仪下取前囟后 0.8mm,中线左旁开 1.8mm处,钻开颅骨,垂直埋入剪短的硬膜外导管,深度为硬膜下 3.7mm,去掉导丝回抽见脑脊液后,牙粉固定导管,缝合皮肤。以后给药时可拔除导丝,用 10μl微量进样器注射,注射结束后重新插入导丝,消毒包扎固定。痴呆模型制备 1d后开始侧脑室给药,连续 21d。小剂量 IGF-1组给予IGF-1 10μl(0.2μg/μl),大剂量 IGF-1组给予 IGF-1 10μl(0.5μg/μl),痴呆组和假手术组则同时间给予生理盐水 10μl。注射时间大约为 10min,注射完后停留 2min再迅速拔针。正常对照组不给予任何处置。实验结束后,注射亚甲蓝溶液 2μl证实注射部位确实在侧脑室。
1.2.3 标本制作及观察 给药 21d后将实验动物进行如下处置:4%多聚甲醛灌注取脑,制成蜡块,每只鼠在靶区附近连续切片,片厚 4~5μm,分别行 Bcl-2、caspase-3免疫组化染色;切片脱蜡后经30g/L H2O2处理,正常羊血清封闭后,分别滴加羊抗鼠 Bcl-2、兔抗鼠 caspase-3,按 SABC法操作然后应用电子计算机数字图像系统进行分析。
2 结 果
2.1 IGF-1对痴呆模型大鼠额叶、海马caspase-3 P20活性片段的影响 (1)正常对照组和假手术组额叶、海马 caspase-3 P20阳性细胞数很少,阳性反应弱(见表1、表2);(2)穹隆海马伞切断术后 3d,大鼠额叶、海马均可见 caspase-3 P20阳性神经元明显增多,呈强阳性表达,14d后 caspase-3 P20阳性神经元开始减少,但 21d时额叶、海马神经元中 caspase-3 P20仍有一定表达(见表1、表2),多数 caspase-3 P20阳性神经元胞膜、胞质着色较深,部分神经元胞核着色,呈棕色或棕黄色,多伴胞体萎缩,说明穹隆海马切断后启动了凋亡机制;(3)小剂量 IGF-1组和大剂量 IGF-1组与痴呆组相比,细胞阳性反应显著减弱,IOD值明显降低,具有显著差异(P<0.001)(见表1、表2),说明 IGF-1能够抑制caspase-3 P20活性片段的表达,减少细胞凋亡的发生;(4)小剂量 IGF-1组与大剂量 IGF-1组比较,Caspase-3 P20阳性神经元 IOD值明显降低,具有显著性差异(P<0.05或 P<0.01)(见表1、表2),说明小剂量 IGF-1对caspase-3 P20的抑制作用较大剂量 IGF-1更显著。
2.2 IGF-1对痴呆模型大鼠额叶、海马 Bcl-2蛋白表达的影响 (1)正常对照组和假手术组额叶、海马 Bcl-2阳性细胞数很少(表3、表4);(2)痴呆组额叶、海马 Bcl-2蛋白在术后 3d表达量最高,持续到 14d,21d阳性神经元免疫反应强度下降(见表3、表4),Bcl-2阳性神经元胞浆呈棕黄色,部分神经元胞核着色;(3)小剂量 IGF-1组和大剂量 IGF-1组与痴呆组相比,额叶、海马 Bcl-2阳性神经元明显增多,着色变深,IOD值明显增加,具有显著差异(P<0.001)(见表3、表4);(4)小剂量 IGF-1组与大剂量 IGF-1组比较,Bcl-2阳性细胞增多,IOD值明显增高,差异显著 (P<0.05或 P<0.01)(见表3、表4),说明小剂量 IGF-1能够更加显著的促进 Bcl-2蛋白的表达。
表1 各组大鼠额叶caspase-3 P20阳性细胞光密度值(±s,n=10)(×106)
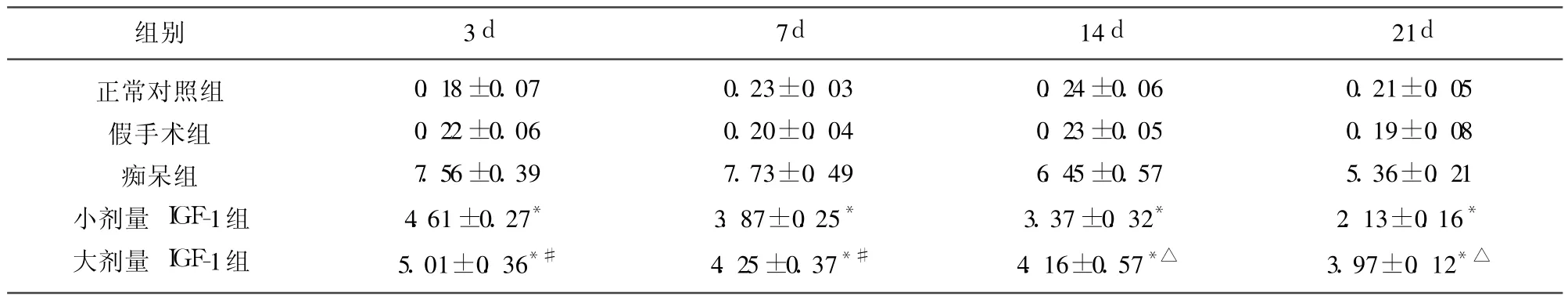
表1 各组大鼠额叶caspase-3 P20阳性细胞光密度值(±s,n=10)(×106)
与痴呆组相比*P<0.001;与小剂量 IGF-1组相比△P<0.01,#P<0.05
组别 3d 7d 14d 21d正常对照组假手术组痴呆组小剂量 IGF-1组大剂量 IGF-1组0.18±0.07 0.22±0.06 7.56±0.39 4.61±0.27*5.01±0.36*#0.23±0.03 0.20±0.04 7.73±0.49 3.87±0.25*4.25±0.37*#0.24±0.06 0.23±0.05 6.45±0.57 3.37±0.32*4.16±0.57*△0.21±0.05 0.19±0.08 5.36±0.21 2.13±0.16*3.97±0.12*△
表2 各组大鼠海马caspase-3 P20阳性细胞光密度值(±s,n=10)(×106)

表2 各组大鼠海马caspase-3 P20阳性细胞光密度值(±s,n=10)(×106)
与痴呆组相比*P<0.001;与小剂量 IGF-1组相比△P<0.01,#P<0.05
组别 3d 7d 14d 21d正常对照组假手术组痴呆组小剂量 IGF-1组大剂量 IGF-1组0.19±0.02 0.18±0.03 8.43±0.72 4.52±0.45*5.12±0.57*#0.21±0.05 0.16±0.06 7.67±0.78 3.36±0.16*4.05±0.76*#0.18±0.06 0.17±0.05 7.89±0.12 4.39±0.46*5.11±0.68*#0.20±0.05 0.19±0.04 5.39±0.32 1.67±0.15*3.89±0.27*△
表3 各组大鼠额叶Bcl-2阳性细胞光密度值(±s,n=10)(×106)

表3 各组大鼠额叶Bcl-2阳性细胞光密度值(±s,n=10)(×106)
与痴呆组相比*P<0.001;与小剂量 IGF-1组相比△P<0.01,#P<0.05
组别 3d 7d 14d 21d正常对照组假手术组痴呆组小剂量 IGF-1组大剂量 IGF-1组0.71±0.21 0.70±0.25 5.26±1.17 9.97±2.13*8.37±1.29*△0.68±0.17 0.72±0.31 4.97±1.25 9.36±2.53*7.26±1.27*#0.73±0.24 0.69±0.22 4.22±1.31 8.49±1.77*6.37±1.35*△0.74±0.29 0.73±0.26 3.09±1.02 7.21±1.23*5.86±1.38*#
表4 各组大鼠海马Bcl-2阳性细胞光密度值(±s,n=10)(×106)
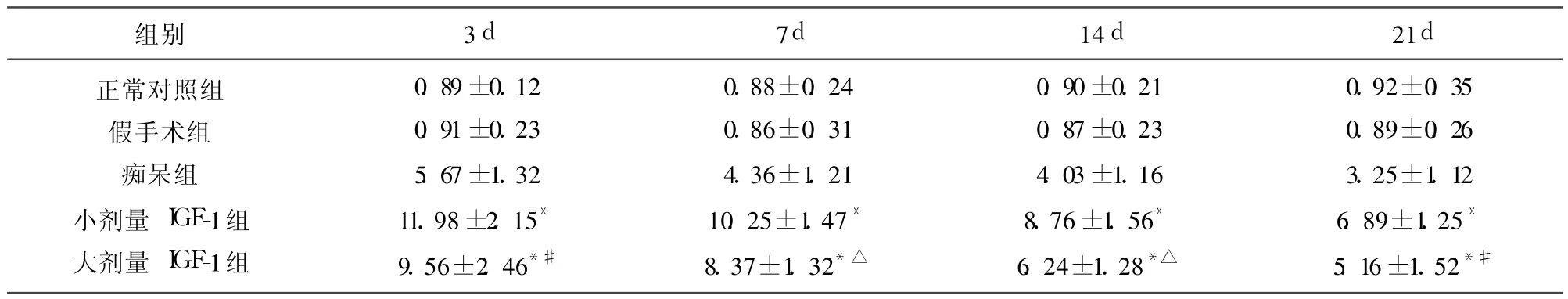
表4 各组大鼠海马Bcl-2阳性细胞光密度值(±s,n=10)(×106)
与痴呆组相比*P<0.001;与小剂量 IGF-1组相比△P<0.01,#P<0.05
组别 3d 7d 14d 21d正常对照组假手术组痴呆组小剂量 IGF-1组大剂量 IGF-1组0.89±0.12 0.91±0.23 5.67±1.32 11.98±2.15*9.56±2.46*#0.88±0.24 0.86±0.31 4.36±1.21 10.25±1.47*8.37±1.32*△0.90±0.21 0.87±0.23 4.03±1.16 8.76±1.56*6.24±1.28*△0.92±0.35 0.89±0.26 3.25±1.12 6.89±1.25*5.16±1.52*#
3 讨 论
细胞凋亡是 AD神经元丢失及其它病理学特征形成的主要原因。Smale等[6]研究发现,AD患者脑内海马区细胞凋亡明显增加,而正常脑内几乎没有或很少有细胞凋亡。
细胞根据所处环境条件不同和启动细胞凋亡刺激不同,通过不同的途径发生凋亡,如死亡受体转接蛋白途径、线粒体-细胞色素 C途径,caspases家族在介导细胞凋亡的过程中起着非常重要作用,无论通过哪种途径,caspase-3都是凋亡的执行者。Shimohama观察到,AD患者大脑中 caspase-3蛋白水平较正常对照组明显增加[7],在细胞培养中,caspase-3可被 Aβ25-35、活性氧 (ROS)及钙稳态的失衡而激活[8]。在低浓度时,三羟基异黄酮 (genistein)能通过活化雌激素受体(ER),有效地抑制 thapsigargin(内质网 Ca2+-ATP酶抑制物)诱导的 caspase-3激活,阻止细胞凋亡[9]。随着对细胞凋亡的深入研究,目前很多学者认为 caspases的激活是细胞凋亡不可逆转的标志[10],因此对这一激活步骤的阻断是药物发挥保护作用的关键机制之一。
本实验研究发现正常大鼠额叶、海马有少量caspase-3 P20弱阳性细胞分布,痴呆组术后 3d大鼠额叶、海马均可见 caspase-3 P20阳性神经元明显增多,呈强阳性表达,14d后 caspase-3 P20阳性神经元开始减少,但 21d时神经元中 caspase-3 P20仍有一定表达,说明穹隆海马伞切断术可以触发 caspase-3调亡途径,引起细胞凋亡发生。IGF-1小剂量组和IGF-1大剂量组与痴呆组比较,caspase-3 P20阳性神经元数量显著减少,细胞着色变浅,提示 IGF-1能够通过抑制 caspase-3活化,进而抑制细胞凋亡,促进额叶、海马内神经元存活。
B细胞淋巴瘤/白血病-2(B-cell lymphone/leukemia-2,Bcl-2)蛋白可抑制 caspase-3裂解活化。发挥其抑制凋亡的作用。也有研究证实 Bcl-2作用于神经系统的发育过程,具有抑制细胞凋亡及类神经营养的作用[11]。
本研究结果发现正常大鼠海马 Bcl-2蛋白表达较少,痴呆组大鼠 Bcl-2蛋白表达反应性增多,IGF-1小剂量组和 IGF-1大剂量组与痴呆组比较,大鼠额叶、海马 Bcl-2蛋白表达明显增加,同时 caspase-3 P20活性片段表达较少,差异显著,提示 IGF-1通过增强 Bcl-2蛋白表达,减少 caspase-3的裂解活化,抑制细胞凋亡,促进额叶、海马内神经元存活及损伤修复。IGF-1引起 Bcl-2基因表达改变的作用机制尚不完全清楚。
有研究认为 IGF-1能激活细胞核转录因子cAMP反应元件结合蛋白(CREB),调节 Bcl-2启动子,因此可能在转录水平提高 Bcl-2表达[12]。也有研究认为 IGF-1可以通过 PI3-Kinase/Akt途径改变Bcl-2的表达,抑制 NO诱导的原代海马神经元凋亡[13]。
本研究结果证实,小剂量 IGF-1比大剂量 IGF-1能更有效地抑制 caspase-3 P20表达,并促进 Bcl-2表达,由此,本研究推测 IGF-1发挥其神经保护作用存在着一个最佳剂量,但最佳剂量尚需今后做大量研究工作来确定。
本研究表明 IGF-1能够通过抑制 caspase-3的裂解活化,促进 Bcl-2的表达,减少神经细胞的凋亡。因此,IGF-1有可能成为 AD治疗的神经保护性药物之一。
[1]SonntagWE,BennettSA,Khan AS,etal.Age and insulin-like growth factor-1modulate N-methyl-D-aspartate receptor subtype expression in rats[J].Brain Res Bull,2000,51(4):331-338.
[2]Lupien SB,Bluhm EJ,Ishii DN.System ic insulin-like growth factor-I administration prevents cognitive impairment in diabetic rats,and brain IGF regulates learning/memory in normal adult rats[J].JNeurosci Res,2003,74(4):512-523.
[3]Sonntag WE,Lynch C,Thornton P,etal.The effects of growth hormone and IGF-1 deficiency on cerebrovascular and brain aging[J].J Anat,2000,197(4):575-585.
[4]Quevedo C,Alcazar A,Salinas M.Two different signal transduction pathways are implicated in the regulation of initiation factor 2B activity in insulin-like growth factor-1-stimulated neuronal cells[J].JBiol Chem,2000,275(25):19192-19197.
[5]包新民,舒斯云.大鼠脑立体定位图谱[M].北京:人民卫生出版社,1991.37-43.
[6]Smale G,Nichols NR,Brady DR,etal.Evidence for apoptotic cell death in Alzheimer's disease[J].Exp Neurol,1995,133(2):225-230.
[7]Shimohama S,Tanino H,Fujimoto S.Changes in caspase expression in Alzheimer's disease:comparison with developmentand aging[J].Biochem Biophys Res Commun,1999,256(2):381-384.
[8]Harada J,Sugimoto M.Activation of caspase-3 in beta-amyloid-induced apoptosis of cultured rat cortical neurons[J].Brain Res,1999,842(2):311-323.
[9]Linford NJ,Dorsa DM.17beta-Estradiol and the phytoestrogen genistein attenuate neuronal apoptosis induced by the endoplasm ic reticulum calcium-ATPase inhibitor thapsigargin[J].Steroids,2002,67(13):1029-1040.
[10]张学敏 .细胞凋亡研究中的一些热点问题[J].中国药理学与毒理学杂志,2000,14(2):81-85.
[11]姜 泊.细胞凋亡基础与临床[M].北京:人民军医出版社,1997.16-20.
[12]Pugazhenthi S,Miller E,Sable C,etal.Insulin-like growth factor-I induces bcl-2 promoter through the transcription factor cAMP-response element-binding protein[J].JBiol Chem,1999,274(39):27529-27535.
[13]Matsuzaki H,TamataniM,Mitsuda N,etal.Activation of Akt kinase inhibitsapoptosisand changes in Bcl-2 and Bax expression induced by nitric oxide in primary hippocampal neurons[J].J Neurochem,1999,73(5):2037-2046.
