玉米弯孢叶斑病菌ATMT转化条件优化及转GFP单孢的获得
陈茂功,林小虎,李洪杰,王晓鸣* ,周印富*
(1河北科技师范学院生命科技学院,河北秦皇岛,066004;2中国农业科学院作物科学研究所)
由新月弯孢(Curvularia lunata(Wakker)Boed)引起的玉米弯孢叶斑病已成为一种重要的叶部病害,对我国玉米生产造成了严重的损失,一般会促使玉米减产20%~30%,严重为害时减产50%以上,甚至绝收[1~4]。目前对该病害研究主要集中在抗病品种与变异和致病机理等方面[5,6],但对该病菌在玉米叶片上的侵染及发育过程仍不十分清楚。
GFP基因作为一种活体报告基因,其应用已深入到植物病害研究中的各个方面,如对植物病原体的侵染、致病机理的研究[7,8]。本研究拟建立一套农杆菌介导弯孢菌的转化方法,同时将GFP基因转入到弯孢叶斑病菌中,获得该菌转化子,以便进行侵入机理研究。
1 材料和方法
1.1 菌株
玉米弯孢叶斑病菌(C.lunata)由中国农业科学院作物科学研究所检疫基地保存;农杆菌菌株为AGL-1,质粒以pCAMBIAI300为骨架构建了pCAMDGFP[9],并含有潮霉素B(HyB)和卡那霉素(kan)抗性,由 Marina Franceschetti(john inner Center,UK)惠赠。
1.2 主要试剂
潮霉素B、头孢噻肟钠、卡那霉素、乙酰丁香酮、MES购自北京鼎国生物技术有限责任公司;其他所用试剂均购于北京万鑫化业商贸中心。
1.3 方法
1.3.1 头孢噻肟钠对农杆菌抑菌浓度的测定 将农杆菌接种于LB液体培养基中,37℃摇培至OD600约为0.6后,取100 μL分别涂于含有头孢噻肟钠 (0,50,100,150,200 mg/L)的 PDA 培养基上,每个浓度3次重复,25℃下培养4 d后观察农杆菌菌落的生长情况,确定头孢噻肟钠的抑菌浓度。
1.3.2 潮霉素B对弯孢菌菌落生长的抑制测定 在含不同质量浓度潮霉素B(0,30,50,75,100,150 mg/L)的PDA培养基上,接种直径4 mm的菌饼,每个浓度3次重复,25℃下培养6 d,每隔36 h测量1次菌落直径,观察潮霉素B对菌落生长的抑制。
1.3.3 潮霉素B对弯孢菌分生孢子萌发的抑制测定 取100 μL的分生孢子悬浊液(109个/L)分别涂于含有潮霉素 B(0,30,50,75,100,150 mg/L)的 PDA 培养基上,每个浓度3次重复,25 ℃下培养48 h,观察潮霉素B对分生孢子萌发的抑制。
1.3.4 不同转化条件对弯孢菌ATMT转化效率的影响 转化方法参照赵培宝等的方法进行[10],并稍作修改。取诱导后的农杆菌菌液与萌发弯孢叶斑病菌分生孢子悬浮液等体积混合,均匀涂布于IM固体培养基的微孔滤膜上,黑暗培养一定时间后将滤膜转移到含有200 mg/L的头孢噻肟钠和50 mg/L潮霉素的PDA培养基上,25℃培养7 d后将生长出来的菌落转移到含有50 mg/L潮霉素的PDA培养基上进行二次筛选。
①孢子萌发时间。采用萌发0,6,12,24 h的分生孢子分别进行遗传转化,其它操作同上。
②共培养介质。分别覆有玻璃纸、微孔滤膜、定性滤纸的共培养基进行共培养,其它操作同上。③共培养温度和时间。分别设置共培养温度20,23,25,28℃,培养24,48,72 h,其它操作同上。
④受体材料。参照王赓等的方法制备弯孢菌原生质体[11]。分别采用孢子悬浮液、菌丝、原生质体进行遗传转化,其它操作同上。以上试验均设置3次重复。
1.3.5 转化子稳定性分析 用单孢分离的方法获得转化子,随机选择10个转化子分别在含有50 mg/L潮霉素和不含有潮霉素的PDA平板上连续传代5代,然后接种于含有50 mg/L潮霉素的平板上,观察转化子是否生长及性状是否稳定。
1.3.6 转化子的PCR检测和荧光观察 随机挑取遗传稳定的10个转化子菌落,以野生型弯孢菌为对照,在PDA培养基上培养7 d后收集菌丝体。分别提取基因组DNA后进行gfp基因和潮霉素B抗性基因的 PCR检测,程序为:95℃预变性10 min;95℃变性30 s,56℃复性30 s,72℃延伸2 min,35个循环;72℃延伸10 min;经10 g/L琼脂糖电泳检测。挑取转化子的菌丝制成玻片,在Olympus荧光显微镜下进行荧光观察,同时以野生型菌株为对照。
1.3.7 转化子致病性的测定 感病自交系黄早四长至四叶期,以接种液(蔗糖:20 g/L;Tween 20:0.2 g/L;无菌水)调节病菌分生孢子浓度至1.0×109个/L,用高压喷雾装置喷雾接种。实验选取5个转化子,设置阴性对照(无菌接种液)及阳性对照(野生型菌株孢子悬液)。接种处理后黑暗保湿48 h。每天观察植株发病情况并记录。
2 结果和分析
2.1 头孢噻肟钠对农杆菌抑菌浓度的测定
农杆菌菌液涂于含有不同浓度的头孢噻肟钠的PDA培养基中25℃培养4 d后,在头孢噻肟钠质量浓度为0,50,100 mg/L的处理中均出现菌落,其他浓度无菌落出现。当头孢噻肟钠为150 mg/L时,在短时间内可抑制农杆菌的生长。但考虑弯孢菌ATMT的转化周期及细菌生长特性,本次试验选用比临界浓度稍高的抗生素浓度,确定头孢噻肟钠质量浓度为200 mg/L作为病菌ATMT转化时农杆菌抑菌浓度。
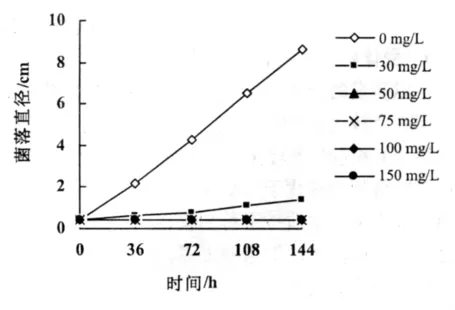
图1 不同浓度潮霉素B对于菌落生长的抑制影响
2.2 潮霉素B最适浓度的选择
潮霉素B可以有效地抑制真菌分生孢子的萌发。将弯孢菌的分生孢子接种于5种不同的潮霉素浓度的PDA培养基中25℃连续培养2 d。当潮霉素质量浓度达到50 mg/L以上时,分生孢子萌发受到完全抑制。将直径4 mm的弯孢菌落接种于不同的潮霉素B浓度的PDA培养基中,25℃下连续培养6 d。当质量浓度到达50 mg/L时,菌落的生长受到了完全的抑制。本试验确定以50 mg/L作为筛选转化子的有效浓度(图1)。
2.3 分生孢子萌发时间对转化效率的影响
采用不同萌发程度的分生孢子进行转化。利用未萌发的分生孢子进行转化得到32个转化子;利用萌发6 h的孢子转化得到67个转化子;利用萌发12 h的孢子得到106个转化子,利用萌发24 h的孢子得到71个转化子。萌发12 h的孢子的转化效率是最高的,说明萌发的孢子有利于农杆菌转化,萌发12 h的孢子是农杆菌介导转化的最佳材料(图2)。
2.4 共培养介质对转化效率的影响
在定性滤纸上进行共培养转化效率为55个转化子/106个孢子,显著低于在微孔滤膜和玻璃纸;微孔滤膜的转化效率(108个转化子/106个孢子)高于玻璃纸的转化效率(98个转化子/106个孢子)(图3)。

图2 孢子萌发时间对转化效率的影响
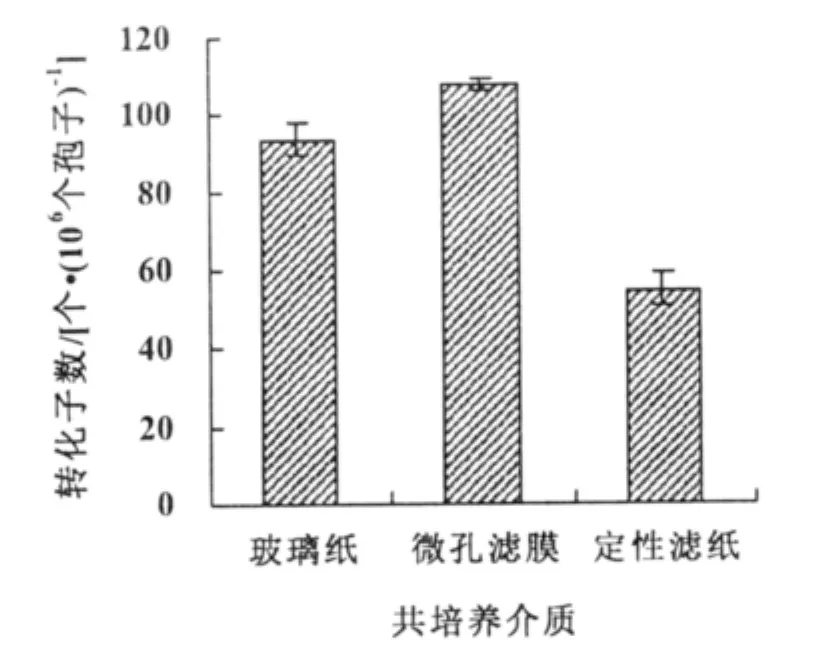
图3 介质类型对转化效率的影响
2.5 共培养温度和时间对转化效率的影响
当共培养温度为19℃和28℃时,转化效率较低。在共培养时间为24 h时,在19,23,25,28℃分别得到了43,64,78,58个转化子;在共培养时间为48 h时,分别得到58,89,106,78个转化子;在共培养时间为72 h时,分别得到47,79,67,43个转化子。结果表明,农杆菌介导的遗传转化最佳条件为共培养温度25℃,共培养时间48 h(图4)。
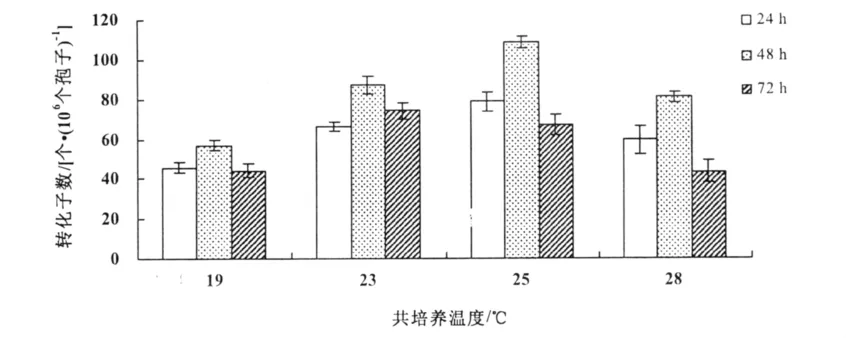
图4 共培养时间和温度对转化效率的影响

图5 受体材料对转化效率的影响
2.6 受体材料对转化效率的影响
以萌发的分生孢子为受体材料进行转化,转化效率可达108个转化子/106个孢子,显著高于以原生质体为受体的转化效率(65个转化子/106个原生质体),而以菌丝为受体材料得到的转化子为0(图5)。原生质体转化效率低可能是弯孢菌原生质体不易制备,且数量较少;菌丝转化为0可能是弯孢菌菌丝细胞壁太厚,农杆菌不易侵染,不能作为农杆菌转化的受体材料。
2.7 弯孢菌转化子稳定性分析
随机选择的10个转化子,在PDA和含50 mg/L潮霉素的PDA上分别转代5次后转接到含50 mg/L潮霉素的PDA观察菌落生长。结果表明:转代后转化子都能在含潮霉素B的培养基上生长,且菌落形态正常,表明转化子在遗传上是稳定的。
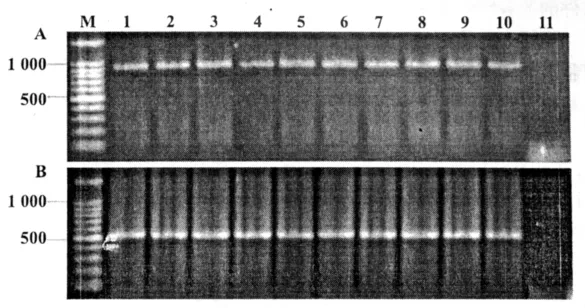
图6 弯孢菌转化子中gfp基因、潮霉素B抗性基因的PCR扩增A为潮霉素B抗性基因扩增产物;B为gfp基因扩增产物;M为标准分子量;1~10为转化子的扩增产物;11为野生型对照
2.8 弯孢菌转化子的PCR检测
以弯孢菌转化子和野生菌株的基因组DNA为模板进行PCR检测,结果10个转化子均扩增出gfp基因和潮霉素B抗性基因,而野生菌株则没有任何扩增产物(图6)。
2.9 弯孢菌转化子的荧光观察
挑取转化子G1和野生菌株的菌丝在488 nm波长下进行荧光观察,结果野生菌株没有观察到任何荧光,转化子的菌丝和分生孢子均能发出绿色荧光(图7)。

图7 绿色荧光蛋白在弯孢菌转化子中不同时期的表达
2.10 转化子致病性的测定
接种实验结果,野生型菌株、转化子1和转化子2表现出较强的毒性和侵染力,在接种后第3天,寄主植物黄早四即开始产生典型病斑,第4天症状明显加重,第5天病害级别即达到3级~4级;转化子3和转化子4也可以在寄主植物上引起典型病斑,但是菌株侵袭力和致病力较弱,分别在第4天、第5天开始出现症状且发病轻,第5天病害级别为1级~2级;转化子5则致病力完全丧失(图8)。

图8 玉米孢子悬浊液喷雾接种结果
3 讨 论
农杆菌介导转化是农杆菌与真菌相互作用的结果,凡能影响真菌转化、农杆菌侵染以及转化子再生的各种因素都会影响其转化效率。因此,农杆菌转化效率的提高依赖于对各种影响因子的优化和转化条件的改善[12,13]。
不同真菌使用抗生素的浓度不同。完全抑制木霉生长的潮霉素B最低质量浓度为150 mg/L,完全抑制玉米大斑病菌的潮霉素B为100 mg/L。本研究中抑制弯孢菌生长的潮霉素B质量浓度为50 mg/L,相对于已报道的真菌抑制生长潮霉素B浓度是比较低的[14,15]。
受体材料是农杆菌转化的关键步骤。原生质体、分生孢子、菌丝乃至蘑菇子实体均可作为受体材料,某些真菌以原生质体或分生孢子为受体材料均可成功转化,而有些真菌转化只能以原生质体作为受体材料[16~21]。本研究表明,以萌发12 h的分生孢子为受体材料,转化效率高。萌发时间过短或过长都会降低转化效率,这可能由于弯孢叶斑病菌分生孢子壁较厚,而萌发的芽管在一定时间内管壁较薄,农杆菌易侵染;萌发时间过长,管壁增厚,使农杆菌不易侵染所致。
共培养条件也是影响转化的关键,包括共培养时间及温度、共培养介质等。共培养时间的增加会提高转化效率,但时间过长会导致T-DNA插入的拷贝数增加;时间过短,农杆菌侵染受体材料尚未完成[22]。过高的转化温度会使农杆菌的转化功能丧失,即T-DNA插入宿主能力的丢失,导致转化效率降低;过低的温度会导致各种菌体活性降低[22]。对于弯孢叶斑病菌而言,在25℃黑暗条件下共培养48 h转化效率最高。本试验还发现,以微孔滤膜为介质转化效率最高,可能由于微孔滤膜有较好的通透性,使弯孢叶斑病菌分生孢子与农杆菌均获得充足营养。
本研究利用农杆菌介导的转化系统,成功将绿色荧光蛋白标记基因插入到弯孢叶斑病菌的基因组DNA中,获得了gfp稳定遗传的弯孢叶斑病菌突变株,为研究该病原菌的侵染循环和致病机制提供了基础性研究材料。通过本研究建立的弯孢菌转化系统还可以用来进行其功能基因的研究。农杆菌介导转化以T-DNA随机插入受体菌基因组中,从而可能导致相应功能的丧失或减弱,进而根据表型变化来研究该基因的功能,为开展玉米弯孢叶斑病菌基因功能的研究奠定了基础。
[1]戴法超,高卫东,王晓鸣,等.玉米弯孢菌叶斑病的初步研究简报[J].植物保护,1996,22(4):36-37.
[2]戴法超,王晓鸣,朱振东,等.玉米弯孢菌叶斑病研究[J].植物病理学报,1998,28(2):123-129.
[3]吕国忠,刘志恒,何富刚,等.辽宁省爆发一种新病害-玉米弯孢菌叶斑病[J].沈阳农业大学学报,1997,28(1):75-76.
[4]MACRI F,LENNA P.Leaf corn blight incited by Curvularia lunata(Wakk.)Boed[J].Jounral of Plant Pathology,1974,10:27-35.
[5]XU S F,CHEN J,LIU L X,et al.Proteomics associated with virulence differentiation of Curvularia lunata in maize(Zea maydis)in China[J].J Integr Plant Biol,2007,49(4):487-496.
[6]LIU T,LIU L X,JIANG X,et al.A new furanoid toxin produced by Curvularia lunata,the causal agent of maize Curvularia leaf spot[J].Can J Plant Pathol,2009(31):22-27.
[7]汪恒英,周守标,常志州,等.绿色荧光蛋白(GFP)研究进展[J].生物技术,2004,14(3):70-71,73.
[8]吴瑞,张树珍.绿色荧光蛋白及其在植物分子生物学中的应用[J].分子植物育种,2005,3(2):240-244.
[9]SESMA A,OSBOURN,A E.The rice leaf blast pathogen undergoes developmental processes typical of root-infecting fung[J].Nature,2004,431:582-586.
[10]赵培宝,周庆新,任爱芝,等.根癌农杆菌介导的轮枝镰孢菌遗传转化及T-DNA插入突变体的筛选[J].菌物学报,2008,27(2):258-266.
[11]王赓,杜连祥.新月弯孢霉原生质体制备及再生条件的研究[J].微生物学通报,1999,26(1):21-23.
[12]方为国,张永军,杨星勇,等.根癌农杆菌介导真菌遗传转化的研究进展[J].中国生物工程杂志,2002,22(5):40-44.
[13]彭姗,李静,杜娟,等.棉花黄萎病菌遗传转化载体构建和农杆菌转化[J].石河子大学学报:自然科学版,2007,25(1):34-38.
[14]MICHIELSE C B,HOOYKASS P J J,HONDEL C J J,et al.Agrobacterium-mediated transformation as a tool for functionalgenomics in fungi[J].Curr Genet,2005,48:1-17.
[15]李卫,郭光沁,郑国锠.根癌农杆菌介导遗传转化研究的若干新进展[J].科学通报,2000,45(8):798-807.
[16]ABUODEH R O,ORBACH M J,MANDEL M A,et al.Genet-ic transformation of Coccidioides immitisfacilitated by Agrobacterium tumefaciens[J].The Journal of Infectious Diseases,2000,181(6):2 106-2 110.
[17]DE GROOT M J,BUNDOCK P,HOOYKAAS P J,et al.Agrobacteriumtumefaciens-mediated transformation of filamentous fungi[J].Nature Biotechnology,1998,16(9):839-842.
[18]CHI M H,PARK S Y,KIM S,et al.A novel pathogenicity gene is required in the rice blast fungus to suppress the basal defenses of the host[J].PLoS Pathogens,2009,5(4):1-16.
[19]刘朋娟,王政逸,王秋华,等.农杆菌介导的稻瘟病菌转化及致病缺陷突变体筛选[J].中国水稻科学,2006,20(3):231-237.
[20]孙晓红,姚泉洪,陈明杰,等.含绿色荧光蛋白及trp3iar基因的草菇表达载体的构建[J].上海水产大学学报,2006,15(1):12-16.
[21]MICHIELSE C B,RAM A F J,HOOYKAAS P J,et al.Roleof bacterial virulence proteins in Agrobacteriumme diated transformation of Aspergillus awamori[J].Fungal Genetics and Biology,2004,45(4):571-578.
[22]张震,杜新法,柴荣耀,等.根癌农杆菌介导丝状真菌遗传转化因素的研究进展[J].微生物学杂志,2007,27(6):88-91.

