毛霉AS3.2778脯氨酸氨肽酶的部分纯化及性质研究*
潘进权
(湛江师范学院生命科学与技术学院,广东 湛江,524048)
毛霉AS3.2778脯氨酸氨肽酶的部分纯化及性质研究*
潘进权
(湛江师范学院生命科学与技术学院,广东 湛江,524048)
毛霉蛋白酶对大豆蛋白有较高的水解效率并对蛋白水解物有良好的脱苦效果,因此在大豆多肽的制备方面显示出很好的应用前景。为了开发这一蛋白酶系,实验中P采用硫酸铵盐析、离子交换层析、疏水层析及凝胶层析等方法对其进行了分离纯化,从雅致放射毛霉AS3.2778的发酵麸曲中部分纯化得到一氨肽酶组分,并对其性质进行了探讨。纯化的毛霉氨肽酶是一典型的脯氨酸氨肽酶,它对小肽N端的脯氨酸有非常强的水解能力;该氨肽酶在40~45℃、pH6.5有最大催化活性,在30℃以内,pH5.0~8.0有很好的稳定性;在所试验的几种蛋白酶抑制剂中,仅1 mmol/L的苯甲基磺酰氟(PMSF)对毛霉氨肽酶有抑制作用,由此说明纯化的毛霉氨肽酶可能是一种丝氨酸蛋白酶;常见金属离子对该氨肽酶活性的影响不明显;脱苦实验结果表明,纯化的毛霉氨肽酶对于大豆蛋白水解物的苦味有明显的去除效果。
雅致放射毛霉,脯氨酸氨肽酶,纯化,性质。脱苦
毛霉是腐乳发酵生产的主要菌种之一,在腐乳生产工艺中主要是分泌蛋白酶水解豆腐胚内的大豆蛋白。腐乳成品中的蛋白质主要是以多肽形式存在,具有相当高的水解程度,已经从中分离出多种具有生理活性的多肽[1-2]。对众多腐乳产品的感官分析表明,腐乳产品通常不具有一般蛋白水解物所特有的苦味。因此毛霉蛋白酶在解决植物蛋白(尤其是大豆蛋白)水解率低、水解产物具有强烈的苦味等难题方面具有很大的潜力。
目前行业内仅有少数学者对毛霉的发酵产酶特性以及粗酶的催化、水解特性进行过探讨[3-4]。然而,毛霉由于长期受到高蛋白环境条件的驯化,它通常具有合成及分泌多种胞外蛋白酶的能力,其胞外的蛋白酶系是由多种蛋白酶所构成的复杂体系,因此,单纯从总体上(即粗酶的研究)并不能完全了解其内在的特性。为全面了解这一蛋白酶系的组分构成、各组分的催化特性以及相互之间的作用,课题组开展了相关的研究。在前期的工作中,对毛霉胞外的内肽酶组分进行了分离纯化及性质分析,并考察了它们对大豆蛋白的水解特性[5-6]。结果表明,毛霉胞外主要有3个内肽酶组分,包括一个碱性蛋白酶和两个酸性蛋白酶,碱性蛋白酶与酸性蛋白酶之间有一定的肽键选择互补性,两者共同作用于大豆蛋白可以实现大豆蛋白的深度水解。然而,感官分析却发现,大豆蛋白的毛霉内肽酶水解物也有强烈的苦味。由此看来,在毛霉胞外可能存在一些具有脱苦效果的蛋白酶组分[7],为此,我们对毛霉胞外的氨肽酶组分进行了分离纯化并对其性质进行了研究。
1 材料与方法
1.1 实验材料
雅致放射毛霉Actinomucor elegans AS3.2778(发酵工程实验室保藏菌种);DEAE-Sepharosee、Phenyl-Sepharose、Sephadex G50购自Pharmacia公司;苯甲基磺酰氟(PMSF)、EDTA、E-64、Pepstatin,购自 Amersco公司;Gly-Pro-pNA、Gly-pNA、Pro-pNA、Arg-pNA、LeupNA、Val-pNA等,购自 Sigma公司;大豆分离蛋白(SPI,蛋白质量分数为87.35%),购自哈尔滨高科大豆食品有限公司;Alcalase蛋白酶,购自Novo公司;其他试剂均为分析纯或生化试剂。
1.2 试验方法
1.2.1 蛋白酶活性测定
采用 Folin-酚法[8]。1.5 mL离心管中加入0.3 mL适当稀释的酶液及0.3 mL 1.5%酪蛋白(溶于0.05 mol/L pH5.5的乙酸-乙酸钠缓冲液),40℃反应l0min,再加0.6 mL 0.4mo1/L的三氯乙酸终止反应,静置15 min后14 000×g离心10min,取上清液0.6 mL,加入3 mL 0.4 mol/L NaCO3溶液及0.6 mL福林酚试剂,于40℃显色20 min,于680 nm测其吸光值,根据标准曲线计算酶活单位。
1.2.2 氨肽酶活性测定[9]
150 μL 酶液加入 150 μL 0.2 mmol/L L-脯氨酸-对硝基苯胺,混匀后置于35℃水浴反应20 min,沸水浴灭活3 min。然后用微量比色皿测定405 nm吸光度。以150 μL灭活的酶液加150 μL 0.2 mmol/L L-脯氨酸-对硝基苯胺作为空白对照。根据标准曲线计算酶活。
酶活定义:实验条件下,每分钟水解L-脯氨酸-对硝基苯胺(Pro-pNA)产生1μg对硝基苯胺所需酶量即为1个酶活单位。
1.2.3 粗酶的提取
称取一定量干麸曲(发酵方法见文献[10])加入10倍体积的0.3 mol/L NaCl溶液,混匀后于30℃水浴中抽提1.5h,纱布过滤后在4℃,7 000×g离心10 min,取上清液即得到粗酶液。
1.2.4 毛霉氨肽酶的纯化
1.2.4.1 (NH4)2SO4分段盐析
取一定体积的粗酶液,在冰水浴上缓慢加入固体(NH4)2SO4到饱和度为50%,充分溶解后在4℃冰箱中静置4h,于4℃,12 000×g离心20 min,取上清液继续加入固体(NH4)2SO4至饱和度为70%,4℃冰箱中静置12 h,然后于4℃,12 000×g离心20 min,蛋白沉淀用0.02 mol/L,pH值7.5的Tris-HCl缓冲液溶解,并透析脱盐。
1.2.4.2 DEAE-Sepharose阴离子交换
用0.02 mol/L,pH7.5的 Tris-HCl缓冲液平衡DEAE-Sepharose阴离子交换柱(3.0 cm×30 cm),取一定量盐析脱盐后的酶液,加样阴离子交换柱。用平衡缓冲液充分洗柱后,用A液:0.02 mol/L,pH7.5的Tris-HCl缓冲液;B液:0.5 mol/L NaCl溶液(溶于0.02 mol/L,pH7.5的Tris-HCl缓冲液)进行阶梯等度洗脱,流速1.5 mL/min,收集50%B阶梯洗脱蛋白峰,然后用超滤离心管浓缩收集液。
1.2.4.3 Phenyl-Sepharose疏水层析
用1.2 mol/L(NH4)2SO4溶液(溶于0.05 mol/L,pH 7.5的PBS缓冲液)平衡Phenyl-Sepharose疏水层析柱(1.6 cm×20 cm)。将上一步收集的浓缩酶液与2.4 mol/L(NH4)2SO4溶液(溶于0.1 mol/L,pH7.5的PBS缓冲液)等体积混和后加样Phenyl-Sepharose疏水层析柱,用平衡缓冲液充分冲洗疏水柱,然后用A液:0.05 mol/L,pH7.5的PBS缓冲液;B液:1.2 mol/L(NH4)2SO4溶液(溶于0.05 mol/L,pH7.5的PBS缓冲液)进行阶梯等度洗脱,流速1.0 mL/min。收集60%B阶梯洗脱蛋白峰(即脯氨酸氨肽酶蛋白峰)。
1.2.4.4 Sephadex G50凝胶过滤层析
用0.02 mol/L,pH7.5 PBS缓冲液平衡Sephadex G50凝胶柱(1.6 cm×100 cm),分别加样1.2.4.2和1.2.4.3的浓缩酶液,用0.02 mol/L,pH7.5的 PBS缓冲液洗脱,流速0.5 mL/min。收集活性蛋白峰,用超滤离心管浓缩收集的样品。
1.2.5 毛霉氨肽酶的催化性质
1.2.5.1 毛霉氨肽酶的底物选择性
按照氨肽酶活性测定方法,分别以Gly-Pro-pNA、Gly-pNA、Pro-pNA、Arg-pNA、Leu-pNA、Val-pNA 等为底物,测定毛霉氨肽酶对不同底物的水解活性。
1.2.5.2 毛霉氨肽酶的最适作用温度
按照酶活测定方法分别于不同的温度(30~70℃)下测定毛霉氨肽酶的活性,考察温度对毛霉氨肽酶活性的影响。根据实验结果绘制温度-活力曲线,并由此确定毛霉氨肽酶的最适作用温度。
1.2.5.3 毛霉氨肽酶的最适作用pH
按照酶活测定方法分别于不同pH缓冲条件下(pH 3.0~5.0,0.05 mol/L乙酸缓冲盐;pH6.0~7.0,0.05 mol/L 磷酸缓冲盐;pH 8.0~9.0,0.02 mol/L Tris-HCl;pH 9.5 ~10.5,0.02 mol/L glycine-NaOH)测定毛霉氨肽酶的活性,考察pH对毛霉氨肽酶活性的影响。根据实验结果绘制pH-活力曲线,并由此确定毛霉氨肽酶的最适作用pH范围。
1.2.5.4 毛霉氨肽酶的热稳定性
在氨肽酶的稳定pH条件下,将酶液分别于不同温度(30~70℃)下保温30 min,测定保温前后氨肽酶活性的变化,考察温度对氨肽酶稳定性的影响。以酶活残留率对温度作图,绘制氨肽酶热失活曲线。
1.2.5.5 pH值对毛霉氨肽酶稳定性的影响
用不同的缓冲液分别调节酶液的pH值为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,于25℃放置约1 h,测定放置前后酶活,计算酶活残留率。以酶活残留率对pH值作图,绘制氨肽酶的pH稳定曲线。
1.2.5.6 抑制剂对毛霉氨肽酶活性的影响
在酶的稳定pH值条件下,将酶液与不同类型的抑制剂混和,25℃下放置约30 min,测定加入抑制剂保温后氨肽酶的活性。考察抑制剂对氨肽酶活性的影响。
1.2.5.7 金属离子对蛋白酶活性的影响
在酶的稳定pH值条件下,将酶液与不同的金属离子溶液混和,于室温中放置30min后测定酶活,比较各种金属离子对氨肽酶活性的影响。
1.2.6 大豆多肽的制备
用蒸馏水配制5 g/100 mL大豆分离蛋白,用1 mol/LNaOH调节pH至pH值11.0,置于90℃恒温水浴中预处理15min,冷却后按酶活与底物比为3 000 u/g加入Alcalase碱性蛋白酶,置于50℃的水浴中保温酶解5h。水解结束后直接加热煮沸,并趁热过滤,滤液冷冻干燥,即得到大豆多肽样品。
1.2.7 苦味评价方法
以硫酸奎宁为标准对照物,采用感官分析的方法对大豆多肽的苦味进行了评价,大豆多肽苦味强度以具有相同苦味的硫酸奎宁摩尔浓度表示[11]。配制一定摩尔浓度的硫酸奎宁溶液,分别稀释到 10-4、10-5、10-6、10-7、10-8mol/L,对应的苦味强度分别为:强、较强、中、弱、无。感官评定小组由8人组成,评定人员用蒸馏水漱口后,取待测水解液3~5 mL置于口中,10 s后吐出,漱口后取与之苦味程度相近的标准液品尝,如确认两苦味相近,即可把待测水解液定义为该标准液的苦味值,否则取其他标准液品尝,直至确定其苦味值。
1.2.8 毛霉氨肽酶脱苦效果的分析
用pH6.5,0.02 mol/L磷酸盐缓冲液配制3%大豆多肽溶液,按氨肽酶酶活与底物比为3 000 u/g加入纯化后的氨肽酶,置于35℃水浴保温3 h,每隔一定时间取样进行苦味感官分析。
2 结果与分析
2.1 毛霉氨肽酶的初步纯化
采用层析的方法对毛霉胞外的氨肽酶进行了初步的分组分离及纯化。首先,采用DEAE-Sepharose阴离子交换层析对盐析后样品进行了初步的分离纯化,通过对其洗脱方法进行优化,最终使氨肽酶组分完全集中在50%B的洗脱峰(如图1示),并实现了内肽酶与氨肽酶的分离,同时使氨肽酶得到了浓缩;然后,采用疏水层析的方法对上一步收集的氨肽酶样品做进一步的分离(如图2),结果发现在疏水层析中可以分离得到2个有活性的洗脱峰,即60%B洗脱峰(活性峰1)和20%B洗脱峰(活性峰2),据此可以初步确定,毛霉胞外至少有2个不同的氨肽酶组分;相比而言,峰1的氨肽酶活性要强得多,峰2仅为其活性的30%左右;最后,采用凝胶层析的方法对疏水层析收集的活性峰1进行了进一步的纯化(如图3),并同时对样品进行脱盐处理。

图1 氨肽酶DEAE-Sepharose离子交换洗脱曲线

图2 氨肽酶Phenyl-Sepharose疏水层析洗脱曲线

图3 氨肽酶组分AP1凝胶层析洗脱曲线
通过以上一系列的纯化操作,虽然可以实现内肽酶与氨肽酶的分离,2个氨肽酶组分之间也得以分开,氨肽酶的纯度有所提高,但是最终并不能完全纯化出目标蛋白。纯化得到的氨肽酶样品中仍然含有一定量的杂蛋白。因此,对毛霉氨肽酶的纯化还需考虑其他的方法。
2.2 毛霉氨肽酶的底物专一性
毛霉氨肽酶对不同底物的水解活性如表1所示。毛霉氨肽酶对不同底物的水解活性显示出一定的差异。总的来看,毛霉氨肽酶主要对小肽N端疏水性氨基酸,如Pro、Leu、Ile、Phe构成的肽键有很强的水解活性;而对小肽N端非疏水性氨基酸,如Arg、Ala、Gly构成的肽键水解活性非常弱,甚至无水解活性。比较毛霉氨肽酶对表中底物的水解活性来看,该氨肽酶对Pro-pNA有最大的水解活性,是一脯氨酸氨肽酶。

表1 毛霉氨肽酶的底物专一性
2.3 抑制剂及金属离子对毛霉氨肽酶活性的影响
抑制剂及金属离子对毛霉氨肽酶活性的影响见表2。结果表明,在所试验的几种蛋白酶抑制剂中,仅1 mmol/L的PMSF对氨肽酶有部分抑制作用,但不能完全抑制其活性。由此说明,毛霉氨肽酶可能是一种丝氨酸蛋白酶,但其催化特性及结构不同于一般的丝氨酸蛋白酶;常见金属离子对毛霉氨肽酶活性的影响不明显。

表2 抑制剂及金属离子对毛霉氨肽酶活性的影响
2.4 pH值对毛霉氨肽酶活性及稳定性的影响
pH值对毛霉氨肽酶活性及稳定性的影响如图4所示。与毛霉内肽酶相比,毛霉氨肽酶的pH-活性曲线相对较窄,pH值对其活性的影响非常显著。毛霉氨肽酶在pH值6.5左右有最大催化活性,而在pH值5.0时,氨肽酶的活性仅为最大活性的50%左右。此外,毛霉氨肽酶在中性附近(pH值5.0~8.0)有相对较好的稳定性,当pH值低于5.0时该氨肽酶会迅速的变性失活。

图4 pH对毛霉氨肽酶活性及稳定性的影响
2.5 温度对毛霉氨肽酶活性及稳定性的影响
温度对毛霉氨肽酶活性及稳定性的影响如图5所示。在相对较低的温度(25~45℃)下,毛霉氨肽酶活性随温度的升高变化的幅度较平缓;当温度超过45℃后,酶活会迅速下降;该氨肽酶在40~45℃的范围内有最大催化活性,然而其在25℃下也显示出相对较高的活性,约为最大活性的50%,这可能与该酶相对较低的热稳定性有一定的关系。由于在相对较低的温度(25~45℃)下,酶已经有一定程度的失活,因此表现出温度升高对促进反应速度的加速效应不显著。图5B的结果确实显示,毛霉氨肽酶的热稳定性相对较差,其在30℃以内有较好的稳定性,当温度超过40℃酶会迅速失活。例如,在40℃保温30 min后,酶活大约有10%的损失;在50℃保温30min后,酶活完全丧失。
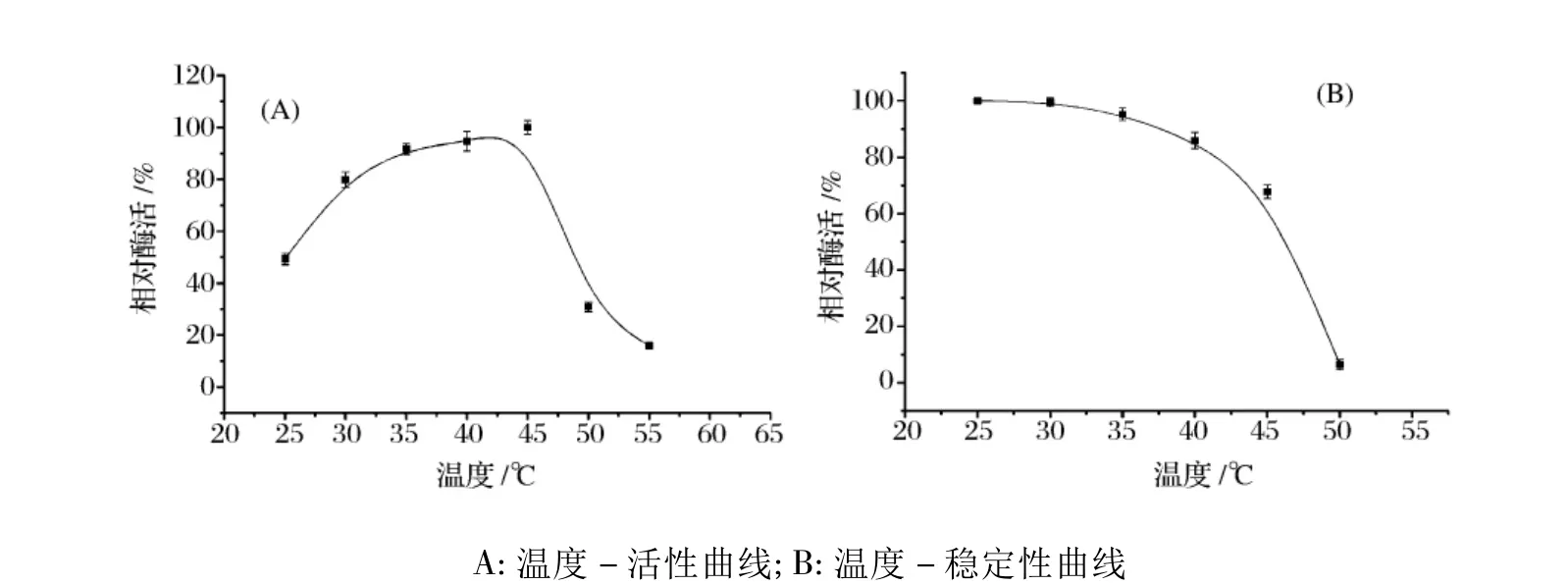
图5 温度对毛霉氨肽酶活性及稳定性的影响
2.6 毛霉氨肽酶脱苦效果的分析
纯化的毛霉氨肽酶对大豆多肽的脱苦效果如图6所示。毛霉氨肽酶对大豆多肽有显著的脱苦效果,随着脱苦反应的进行,大豆多肽的苦味逐渐减弱并最终消除。在氨肽酶脱苦的初期,大豆多肽的苦味变化极为显著;初始3%的大豆多肽溶液有很强烈的苦味,用氨肽酶脱苦处理0.5 h后,其苦味明显减弱为中等强度;脱苦处理1 h后,其苦味已非常弱(略有微弱的苦味);脱苦处理3 h后,大豆多肽的苦味完全消失。

图6 大豆多肽脱苦过程中苦味的变化
毛霉氨肽酶对大豆多肽有显著的脱苦效果,这应该与该氨肽酶选择性切除小肽N端的疏水性氨基酸有密切关系。已有的研究表明,多肽之所以有苦味主要与其疏水性有关,尤其是位于小肽分子两端的疏水性氨基酸对肽的苦味有很大的贡献[12-13]。因此,氨肽酶对小肽N端疏水性氨基酸的切除可以从根本上解除小肽的苦味,这一结论已为较多的实验结果所证实[14-16]。此外,从毛霉氨肽酶的底物专一性来看,毛霉氨肽酶对小肽N端的非疏水性氨基酸作用甚微,这将可以有效避免脱苦过程中对小肽的过度水解,脱苦后水解液中依然以小肽为主,这对于小肽类产品功能特性的保留有重要的意义。综合来看,毛霉氨肽酶作为新型的风味酶在多肽的脱苦方面有较好的应用前景。
3 结论
利用多种层析操作相结合的方法从雅致放射毛霉AS3.2778的发酵麸曲中分离纯化出一氨肽酶组分,并对其性质及脱苦效果进行了分析。结果表明:该蛋白酶是一脯氨酸氨肽酶;在40~45℃、pH6.5有最大催化活性,在30℃以内,pH5.0~8.0有很好的稳定性;该氨肽酶对小肽N端的疏水性氨基酸有很强的水解活性,而对小肽N端非疏水性氨基酸的水解活性极弱;脱苦实验结果表明,毛霉氨肽酶对大豆蛋白水解物有显著的脱苦效果。在3%的大豆多肽溶液中,按酶活与底物比3 000u/g加入毛霉氨肽酶处理3h可以完全消除大豆多肽的苦味。以上结果表明,毛霉氨肽酶酶组分作为新型的风味酶在多肽的脱苦方面有较好的应用潜力。
[1] 陈躬瑞,陈儒明,赵晴,等.毛霉红腐乳蛋白质的研究[J].营养学报,1997,19(1):100-103.
[2] 倪莉,饶平凡,王璋.腐乳中生理活性多肽的分离和表征[J].浙江农业大学学报,1997,23(增刊):93-97.
[3] 鲁绯,孙君社,王丽英.雅致放射毛霉胞外蛋白酶特性的研究[J].中国酿造,2004,141(12):8-10.
[4] 李理,罗泽民,卢向阳.梨形毛霉蛋白酶在大豆多肽制备中的应用[J].中国粮油学报,2001,16(1):55-58.
[5] 潘进权,罗晓春,谢明权.雅致放射毛霉AS3.2778碱性蛋白酶的纯化及水解特性[J].华南理工大学学报,2008,36(12):106-111.
[6] 潘进权,罗晓春,谢明权.毛霉蛋白酶的组分特性及对大豆蛋白水解的研究[J].中国粮油学报,2009,24(5):31-35.
[7] Li L,Yang Z Y,Yang X Q,et al.Debittering effect of Actinomucor elegans peptidases on soybean protein hydroly-sates[J].J Ind Microbiol.Biotechnol,2008,35(1):41-47
[8] Sierecha J K.Purification and partial characterization of a neutral protease from a virulent strain of Bacillus cereus[J].The International Journal of Biochemistry& Cell Biology,1998,30(5):579-595.
[9] 田亚平,须瑛敏.一种枯草芽孢杆菌氨肽酶的纯化及酶学性质[J].食品与发酵工业,2006,32(3):7-10.
[10] 潘进权,罗晓春,谢明权.基于序贯设计的毛霉AS3.2778发酵产蛋白酶工艺优化[J].食品科学,2008,29(12):481 -485.
[11] Hiroatsu M,Yoko F,Shuichi K,et al.Purification and debittering effect of aminopeptidaseⅡfrom Penicillium caseicolum[J].J Agric food chem,1991,39:1 392-1 395.
[12] Ishibashi N,Ono I,Kato K,et al.Role of the hydrophobic amino acid residue in the bitterness of peptides[J].Agric Biol Chem,1988,52(1):91 -94.
[13] Aldler Nissen J.A review of food protein hydrolysis specific areas.In:Enzymic hydrolysis of food proteins[M].London and New York:Lsevier Applied Science Publishers,1986:57 -107.
[14] Fitz Gerald R J,O'cuinn G.Enzymatic debittering of food protein hydrolysates[J].Biotechnol Adv,2006,24:234-237
[15] Minagawa E.Debittering mechanism in bitter peptides of enzymatic hydrolysates from milk casein by aminopeptidase T[J].J Food Sci,1989,54(5):1 125 -1 129.
[16] Lzawa N.Debittering of protein hydrolysates using Aeromonas caviae aminopeptidase[J].J Agric Food Chem,1997,45:543-545.
Partial Purification and Properties of One Prolyl-aminopeptidase from Mucor AS3.2778
Pan Jin-quan
(School of Life Science and Technology,Zhanjiang Normal University,Zhanjiang 524048,China)
Proteases from Mucor had a good application prospect in the production of soy-polypeptides for their high hydrolysis efficiency to soy protein and debittering effect to hydrolysate.To explore these proteases,this study used ammonium sulfate precipitation,ion exchange chromatography,hydrophobic chromatography and gel filtration chromatography,and investigated the properties of one aminopeptidase purified from the fermented wheat bran by Actinomucor elegans AS3.2778.The purified aminopeptidase was a particular prolyl-aminopeptidase,which had a very high hydrolysis activity to N-terminal proline of peptides.It had the maximum activity at pH6.5 40 ~45℃,was stable in the pH range of 5.0 ~8.0 at <30℃,and could be inhibited by the serine protease inhibitor,PMSF,indicated that it may belong to the serine protease family.The effect of debittering for bitter peptides among SPI hydrolysate with Alcalase was clearly found by proly-aminopeptidase treatment for 3 h.
Actinomucor elegans,prolyl-aminopeptidase,purification,properties,debittering
博士研究生,讲师。
*广东省自然科学基金项目(9452404801001943);湛江师范学院基金项目(ZL0912)
2010-11-09,改回日期:2010-12-09

