微量热法研究环境NaCl浓度对盐生盐杆菌生长代谢的影响
曾 驰 朱建裕
(1武汉工业学院生物与制药工程学院,武汉430023;2中南大学资源加工与生物工程学院,长沙410083)
微量热法研究环境NaCl浓度对盐生盐杆菌生长代谢的影响
曾 驰1,*朱建裕2,*
(1武汉工业学院生物与制药工程学院,武汉430023;2中南大学资源加工与生物工程学院,长沙410083)
采用TAM air微量热系统和安瓿法测定了盐生盐杆菌在不同NaCl浓度中生长的生长产热曲线,拟合得到盐生盐杆菌在不同NaCl浓度中生长的热动力学方程和热动力学参数,并分析了盐生盐杆菌生长的各种热动力学参数与环境NaCl浓度的关系.由此发现,盐生盐杆菌生长的最适NaCl浓度并不是传统认为的一个宽泛的范围——3.5 mol·L-1至约5.2 mol·L-1(NaCl饱和),而是约3.9 mol·L-1.在环境NaCl浓度由3.9 mol·L-1逐步升高至饱和的过程中,盐生盐杆菌的生长代谢持续减弱.进一步的透射电镜观察发现在近饱和的NaCl浓度中生长的盐生盐杆菌细胞发生了质壁分离,较好地解释了微量热研究的结果.由此对NaCl浓度变化导致嗜盐古生菌表面结构改变提出了新的解释.
微量热;嗜盐古生菌;环境NaCl浓度;细胞表面结构
1 引言
嗜盐古生菌是古生菌的主要类群之一,主要生存于各种高盐环境中,尤其在一些盐浓度接近饱和的环境(例如盐湖、晒盐场和盐腌食品)中以较高密度存在.1嗜盐古生菌最早被发现和最显著的特征是对高浓度NaCl的绝对依赖.2嗜盐古生菌的大多数种都惯于近饱和的环境NaCl浓度,在NaCl浓度低于2.5-3 mol·L-1时无法生长.1,2以典型的嗜盐古生菌——盐生盐杆菌(Halobacterium halobium,简称为Hbt.halobium)为例,盐生盐杆菌在环境NaCl浓度为3.5 mol·L-1至约5.2 mol·L-1(饱和浓度)时生长良好,当NaCl浓度低于3 mol·L-1时不生长.1,2此外,大量研究表明嗜盐古生菌生长的“NaCl依赖”是特异性的,NaCl不能被其它的盐或溶质所代替.1,2
从20世纪60年代至今,很多研究致力于阐明嗜盐古生菌“NaCl依赖”的细胞和分子基础.人们观察到当环境NaCl浓度逐步降低时,菌体形状先由杆状变得不规则,再变为球状,最后裂解.3对此现象的解释一度引发争论.一种观点认为,细胞表面有较高电荷密度,一旦去除反荷离子(counterions),细胞表面结构即被破坏.另一种观点认为,以细胞膜半透性为基础的渗透现象才是菌体形状改变乃至嗜盐古生菌停止生长的主要原因.1,2
后来发现,菌体由杆状变为球状过程中,细菌大小不变.将分离的细胞壁碎片置于可使整个细胞裂解的条件下,细胞壁碎片会分裂成更小的部分.1,2人们对全细胞和亚细胞组分进行化学分析,发现嗜盐古生菌(盐球菌除外)细胞壁不含肽聚糖,其主要成分为一种高分子量的糖蛋白.这种蛋白中酸性氨基酸(如Glu、Asp)量极高,带大量负电荷,只在高浓度的Na+中稳定.1,2因此前一种观点被普遍接受,即嗜盐古生菌的“NaCl依赖”主要是为了维持其糖蛋白细胞壁结构.嗜盐古生菌细胞壁糖蛋白中的酸性氨基酸需与基质中的Na+结合以平衡其电荷.在Na+浓度较低时,电荷相斥,细胞壁解体,导致细胞不能维持形状.1,2这是目前的主流观点.
值得注意的是,已有大量研究1,2探讨嗜盐古生菌的“NaCl依赖”,但是却没有文献深入研究环境NaCl浓度“过高”(例如近饱和)是否会对嗜盐古生菌的细胞结构和生理状态造成影响.4在人们传统认识中,高浓度NaCl对嗜盐古生菌有益无害.4最新的微生物学权威教材——《Prescott微生物学》(第8版)中称“一般微生物在环境渗透压过高时会发生质壁分离,但嗜盐古生菌却可以很好的适应高盐浓度,而且其生长还依赖于高盐浓度”.5迄今仅有本课题组报道了一株嗜盐古生菌——盐沼盐杆菌(Halobacterium salinarum NRC817)在盐浓度较高的培养条件下发生了细胞脱水的现象.6
微量热法是热力学研究的一种重要方法,目前在生命科学的各个领域获得广泛应用.7微生物生长过程伴随着产热.产热是细胞代谢的重要生理参数.借助足够灵敏的微量热仪,可以研究活细胞代谢过程和相关性质.8通过对微生物生长的热效应进行连续测定,可以得到微生物生长的产热功率-时间曲线(细菌生长热谱).获得细菌生长热谱后,进一步根据反应动力学的基本原理对这些生长热谱进行剖析,则可获得细菌生长的动力学信息.同样用物理化学的基本原理对这些热谱进行处理能得到微生物生长代谢过程的有关热力学参数.对这些动力学信息和热力学参数进行分析,可揭示一些用生物学方法难以观察到的现象.8
本工作应用微量热法研究了NaCl浓度对嗜盐古生菌的标准菌株——盐生盐杆菌(Hbt.halobium R1)生长的影响,发现在NaCl浓度近饱和的环境中盐生盐杆菌生长代谢异常.进一步用透射电镜研究了在不同NaCl浓度中生长的盐生盐杆菌的细胞形态,发现在近饱和的NaCl浓度中生长的盐生盐杆菌细胞发生了质壁分离.由此对NaCl浓度变化导致嗜盐古生菌表面结构改变的现象提出了新的解释.
2 仪器与材料
2.1 仪 器
TAM air八通道等温热导式微量热仪(瑞典Thermometric AB公司).仪器的热稳定性好,温度变化可稳定在±0.02°C,可用于检测5-60°C的化学和生物体系.热功率最小检测极限为2µW.
H-8100透射电子显微镜(日本日立公司).
2.2 材 料
菌株:盐生盐杆菌(Hbt.halobium R1)由武汉大学生命科学学院微生物遗传研究室提供.
培养基:本研究所用的培养基其配方均基于Rodriguez-Valera报道的嗜盐菌培养基,9但其中NaCl的浓度有所改变.在本研究所用7种培养基中分别设置了不同的NaCl浓度.每升培养基含25 g MgSO4·7H2O(分析纯),1.3 g CaCl2·6H2O(分析纯), 5.0 g KCl(分析纯),0.25 g NaHCO3(分析纯),0.63 g NaBr(分析纯),5.0 g酵母提取物(生化试剂,英国Oxoid公司产)和不等量的NaCl(分析纯)(每升培养基中分别溶入129,152,169,187,228,257和292 g NaCl,相应培养基中的NaCl浓度分别为2.2,2.6, 2.9,3.2,3.9,4.4和5.0 mol·L-1).配制好的培养基121°C高压蒸汽灭菌15 min,冷却备用.
3 实验方法
3.1 盐生盐杆菌生长产热曲线的测定
本研究利用安瓿测量法测定盐生盐杆菌(Hbt. halobium R1)在不同NaCl浓度中生长的生长产热曲线.将活化好的盐生盐杆菌等量接种于NaCl浓度不同的培养基中(刚接种的培养基中细胞数目为1×106mL-1),注入安瓿(每个安瓿中加入5 mL已接种的培养基),然后置于量热计的各个测量筒中,在温度设定为37°C的微量热仪中培养.与量热仪连接的计算机自动连续记录生长过程中输出的产热功率,从而绘制得到生长产热曲线.
3.2 对盐生盐杆菌制样以进行透射电镜观察
将培养至对数生长期的盐生盐杆菌培养液离心收集细胞,用盐水(盐浓度与培养基盐浓度相同)多次洗涤并重悬.将菌悬液滴在铜网上,用滤纸从铜网边缘吸去多余的菌悬液,上电镜观察.
4 结果与讨论
4.1 盐生盐杆菌在不同NaCl浓度中生长的生长产热曲线
盐生盐杆菌(Hbt.halobium R1)在不同NaCl浓度中生长的产热功率-时间曲线见图1.这些曲线包含细菌生长不同时期(延迟期、对数生长期、稳定期和衰亡期)的典型特征.比较这些曲线可以看出NaCl浓度对盐生盐杆菌生长代谢有显著的影响.
4.2 热动力学方程和参数
在对数生长期,细胞数量是呈指数式增长的,热输出也呈指数式增长,8如式(1)所示:


图1 盐生盐杆菌在不同NaCl浓度(cNaCl)中生长的产热功率(P)-时间(t)曲线Fig.1 Power(P)-time(t)curves of Hbt.halobium growth in different concentrations of NaCl(cNaCl)
其中Pt是对数生长期t时刻的热输出功率,P0是起始时刻的热输出功率,k是生长速率常数,t是实验时间.各生长产热曲线的对数生长期部分与式(1)有很好的相关性.因此可从生长产热曲线的对数生长期部分取一系列的Pt和t数据代入上式进行拟合,通过式(1)求得生长速率常数k值和生长热动力学方程.根据tG=ln2/k可以计算出代时tG.根据生长产热曲线还可以得到最大热输出功率Pm和出峰时间tm(即最大热输出功率所对应的时间).盐生盐杆菌(Hbt.halobium R1)在不同NaCl浓度中生长的热动力学方程和参数分别列于表1和表2中.所有实验结果都有较好的规律性和重复性.
4.3 生长速率常数、代时、最大热输出功率、出峰时
间与NaCl浓度之间的关系
图2显示了生长速率常数(k)、代时(tG)和相应的NaCl浓度(cNaCl)之间的关系.可以看出,当NaCl浓度低于3.9 mol·L-1(即2.2-3.9 mol·L-1)时,k随着NaCl浓度升高而升高,tG随着NaCl浓度升高而缩短.但当NaCl浓度超过3.9 mol·L-1(3.9-5.0 mol·L-1)时则相反,随着NaCl浓度升高,k降低,tG延长.
最大热输出功率(Pm)和出峰时间(tm)也是微生物生长代谢的重要参数.如图3所示,当NaCl浓度低于3.9 mol·L-1(即2.2-3.9 mol·L-1)时,Pm随着NaCl浓度升高而升高,tm随着NaCl浓度升高而减小.但当NaCl浓度超过3.9 mol·L-1(3.9-5.0 mol· L-1)时,随着NaCl浓度升高,Pm降低,tm增大.

表1 盐生盐杆菌在不同NaCl浓度中生长的生长速率常数和生长热动力学方程Table 1 Growth rate constants and growth thermokinetic equations of Hbt.halobium growth in different concentrations of NaCl

表2 盐生盐杆菌在不同NaCl浓度中生长的热动力学参数Table 2 Thermokinetic parameters of Hbt.halobium growth in different concentrations of NaCl
4.4 用透射电镜观察在不同NaCl浓度中生长的盐
生盐杆菌的细胞形态

图2 生长速率常数(k)、代时(tG)和NaCl浓度(cNaCl)之间的关系Fig.2 Plots of k vs cNaCland tGvs cNaCl

图3 最大热输出功率(Pm)及相应的出峰时间(tm)和NaCl浓度(cNaCl)之间的关系Fig.3 Plot of Pmvs cNaCland tmvs cNaCl
用透射电镜观察了在不同NaCl浓度中生长的盐生盐杆菌的细胞形态.电镜照片见图4.不同NaCl浓度中生长的盐生盐杆菌细胞形态有很大的差异.在3.9 mol·L-1NaCl中生长的盐生盐杆菌菌体呈规则的杆状(图4(d)).随着NaCl浓度从3.9 mol·L-1逐步降低到2.6 mol·L-1,杆状菌体先变得不规则(图4 (c)),最后变成球状(图4(b)).球状菌体周围有屑状物,推测是细胞壁解体形成的碎片(图4(b)).在含2.2 mol·L-1NaCl的培养物中没有发现完整的细胞,只看到一些远比细胞小的颗粒状物,推测是原生质体解体形成的膜颗粒(图4(a)).在5.0 mol·L-1NaCl中生长的盐生盐杆菌菌体呈规则杆状,但原生质体已收缩离壁,质膜和细胞壁之间出现明显空间(图4 (e)),表明这些盐生盐杆菌细胞发生了质壁分离.
4.5 讨 论
比较盐生盐杆菌在不同NaCl浓度(2.2 mol·L-1到近饱和NaCl浓度)中生长的生长产热曲线和热动力学参数,可以看出当环境NaCl浓度低于3.9 mol· L-1时,盐生盐杆菌的生长代谢随着NaCl浓度降低而逐步减弱.当NaCl浓度降至2.2 mol·L-1时盐生盐杆菌的生长代谢基本停止.这和以往报道1,2,10是一致的.但当环境NaCl浓度高于3.9 mol·L-1时,盐生盐杆菌的生长代谢随着NaCl浓度升高而减弱.这一现象未见报道.将上述微量热实验重复3次,得到了一致的结果.
为了解该现象的生物学原因,用透射电镜观察了不同NaCl浓度中生长的盐生盐杆菌的细胞形态.随着环境NaCl浓度从3.9 mol·L-1逐步降低,杆状菌体先变得不规则,再变成球状,最后解体成为一些远比细胞小的膜颗粒.这些观察结果和微量热实验得到的规律一致,也和“NaCl维持细胞壁”理论1,2吻合.另一方面发现在5.0 mol·L-1NaCl中生长的盐生盐杆菌细胞发生了质壁分离.该现象不能用“NaCl维持细胞壁”理论解释.质壁分离是微生物的典型现象之一,在G-和G+细菌中普遍存在.5微生物发生质壁分离后通常会代谢受抑和生长变缓.5微量热实验的结果与此相符.综合电镜观察结果和微量热实验结果,可以确定近饱和NaCl浓度中生长的盐生盐杆菌确实发生了质壁分离.
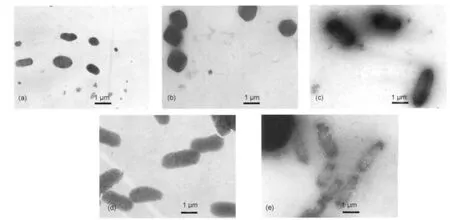
图4 透射电镜观察不同NaCl浓度中生长的盐生盐杆菌的细胞形态Fig.4 Transmission electron microscopy photographs of Hbt.halobium cells growing in different concentrations of NaClcNaCl/(mol·L-1):(a)2.2,(b)2.6,(c)2.9,(d)3.9,(e)5.0;a salt crystal is also present in Fig.4(e).
质壁分离现象的基础乃是质膜的半透性.盐生盐杆菌细胞可视为一个渗透系统.我们推测在NaCl浓度大于或等于3.9 mol·L-1时,细胞水势等于渗透势.当环境NaCl浓度为3.9 mol·L-1时,细胞水势为零,无明显水移动.当环境NaCl浓度大于3.9 mol· L-1时,细胞水势为正,胞内水外流,细胞失水.当环境NaCl浓度小于3.9 mol·L-1时,细胞渗透势为负,然而未解体的细胞壁的刚性阻止了细胞进水和原生质体膨胀,即产生了压力势.压力势与渗透势相平衡.细胞壁对原生质体产生了压力势的同时原生质体必然对细胞壁产生膨压.11我们认为,在NaCl浓度由3.9 mol·L-1逐步降低时,膨压和胞壁糖蛋白分子间斥力一起对细胞壁造成影响,最终引起细胞变形乃至解体.
光电比浊是测定微生物生长的最常用技术.12以往研究中嗜盐古生菌生长的测定一般是使用比浊法完成的.13,14但有一个问题:嗜盐古生菌普遍产生大量的类胡萝卜素色素.这些类胡萝卜素色素的吸收峰和嗜盐古生菌细胞的吸收峰相近,因此这些色素会干扰分光光度测定.1,13,14而且嗜盐古生菌细胞的色素含量受环境盐浓度、培养基组分和生长时期影响变化较大.1,14这导致以往的嗜盐古生菌生长测定结果有较大误差.13,14用微量热法测定嗜盐古生菌生长则可避免上述问题.它只以嗜盐古生菌生长的代谢产热为测定对象,不会被细胞色素干扰.8它可以连续测定嗜盐古生菌的整个生长过程,而且具有高灵敏度和高精确度的特点.8,15-17在本研究中,我们应用微量热技术测定盐生盐杆菌生长,得到了精确度高、重复性好的结果.用微量热法研究嗜盐古生菌和其它产色素微生物的生长具有独到的优势.
5 结论
细菌生长产热曲线完整的描述了细菌的生长代谢过程.在培养条件不变的情况下,每种细菌的产热曲线都有独有的特征.一旦环境改变,代谢过程即受影响,细菌生长产热曲线随之发生显著变化.因此,用微量热法研究细菌生长可能发现其他方法难以发现的细节.在本研究中,通过比较盐生盐杆菌在不同NaCl浓度中生长的生长产热曲线,分析其中包含的热动力学信息,我们发现盐生盐杆菌生长的最适NaCl浓度并不是传统认为的一个宽泛的范围(3.5 mol·L-1至约5.2 mol·L-1(NaCl饱和)),而是约3.9 mol·L-1.在环境NaCl浓度由3.9 mol·L-1逐步升高至饱和的过程中,盐生盐杆菌的生长代谢持续减弱.该现象很难用传统的微生物学技术(例如比浊法)发现.进一步的电镜观察发现在近饱和的NaCl浓度中生长的盐生盐杆菌发生了质壁分离,很好地解释了微量热研究提出的问题.我们的研究表明微量热法对研究微生物生长是一个特别有用的工具.和传统方法相比微量热法可以发现微生物生长代谢的更多细节,这些细节可以帮助我们发现和理解更多的生命现象.
(1)
Oren,A.The Order Halobacteriales.In The Prokaryotes:A Handbook on the Biology of Bacteria:Ecophysiology,Isolation, Identification,Applications,3rd ed.;Dworkin,M.,Falkow,S., Rosenberg,E.,Schleifer,K.H.,Stackebrandt,E.Eds.; Springer-Verlag:New York,1999.
(2)Grant,W.D.;Kamekura,M.;McGenity,T.J.;Ventosa,A. Halobacteria.In Bergeyʹs Manual of Systematic Bacteriology, 2nd ed.;Garrity,G.M.Ed.;Springer-Verlag:New York,2001.
(3) Stoeckenius,W.;Rowen,R.J.Cell Biol.1967,34,365.
(4) Grant,W.D.Phil.Trans.R.Soc.Lond.B 2004,359,1249.
(5) Willey,J.;Sherwood,L.;Woolverton,C.Prescott′s Microbiology,8th ed.;McGraw-Hill:New York,2011;chap.6.
(6) Zeng,C.;Zhu,J.C.;Liu,Y.;Yang,Y.;Zhu,J.Y.;Huang,Y.P.; Shen,P.J.Therm.Anal.Cal.2006,84,625.
(7)Wadsö,I.Thermochim.Acta 2002,394,305.
(8) Braissant,O.;Wirz,D.;Göpfert,B.;Daniels,A.U.FEMS Microbiol.Lett.2010,303,1.
(9) Rodriguez-Valera,F.;Ruiz-Berraquero,F.;Ramos-Cormenzana, A.J.Gen.Microbiol.1980,119,535.
(10) Gibbons,N.E.;Payne,J.I.Can.J.Microbiol.1961,7,483.
(11) Pritchard,J.Turgor Pressure.In Encyclopedia of Life Sciences; Nature Publishing Group:London,2001.
(12)Koch,A.L.Growth Measurement.In Manual of Methods for General Bacteriology;Gerhardt,P.Eds.;American Society for Microbiology:Washington D.C.,1981;chap.11.
(13) Shand,R.F.;Perez,A.M.Haloarchaeal Growth Physiology.In Enigmatic Organisms and Life in Extreme Environments; Seckback,J.Ed.;KluwerAcademic Publishers:Dordrecht, 1999;pp 413-424.
(14) Dyall-Smith,M.The Halohandbook:Protocols for Haloarchaeal Genetics,version 7.1;2009;pp 109-111. http://www.haloarchaea.com/resources/halohandbook
(15) Huang,Y.P.;Liu,Y.;Shen,P.;Qu,S.S.J.Therm.Anal.Cal. 2003,74,163.
(16) Liu,P.;Liu,Y.;Xie,Z.X.;Chen,Y.G.;Zhao,R.M.;Shen,P.; Qu,S.S.Chin.J.Chem.2003,21,693.
(17) Liu,Y.;Yu,H.G.;Huang,Y.P.;Shen,P.;Qu,S.S.Biol.Trace Elem.Res.2003,92,83.
February 16,2011;Revised:April 5,2011;Published on Web:April 29,2011.
Microcalorimetric Study of the Influence of Extracellular NaCl Concentration on the Growth Metabolism of Halobacterium halobium
ZENG Chi1,*ZHU Jian-Yu2,*
(1School of Biology and Pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 430023,P.R.China;2School of Minerals Processing and Bioengineering,Central South University,Changsha 410083,P.R.China)
Microcalorimetry was used to study the influence of extracellular NaCl concentration on the growth metabolism ofHalobacterium halobium (Hbt.halobium)using a TAM airisothermal microcalorimeter.The metabolic thermogenic curves of Hbt.halobium growth in different concentrations of NaCl were obtained using the ampoule method.The thermokinetic equations and parameters of Hbt. halobium growth were calculated and the relationship between each thermokinetic parameter and the concentration of NaCl was obtained.The results showed that the optimum NaCl concentration for Hbt. halobium growth was not a wide range from 3.5 mol L-1to about 5.2 mol·L-1(NaCl saturation),as is generally acknowledged,but just around 3.9 mol·L-1.For an extracellular NaCl concentration above 3.9 mol·L-1,the growth metabolism of Hbt.halobium decreased constantly with an increase in the NaCl concentration.Further investigation by transmission electron microscopy revealed that the Hbt.halobium cells growing in approaching NaCl saturation underwent plasmolysis,which interpreted the finding of microcalorimetry perfectly.All these results led to a new interpretation of the structural transformations of Hbt.halobium upon NaCl concentration altering.
Microcalorimetry;Haloarchaea;Extracellular NaCl concentration;Cell surface structure
O642
∗Corresponding authors.ZENG Chi,Email:zeng_chi@yahoo.com.cn;Tel:+86-27-85443805.ZHU Jian-Yu,Email:csuzhu@yahoo.com.cn;
Tel:+86-731-8836944.
The project was supported by the National Natural Science Foundation of China(31000050,30700008)and Research Program of Hubei Provincial Department of Education,China(B20111701).
国家自然科学基金(31000050,30700008)和湖北省教育厅科学技术研究项目(B20111701)资助

