黄芪甲苷对H2O2致PC12细胞氧化应激损伤的保护作用
王世博,邱景富,白群华,李佳佳,和晋渝,高艳军,于 超
(1.重庆医科大学生命科学研究院,重庆 400016;2.重庆医科大学公共卫生学院重庆 400016,3.重庆医科大学检验医学院,重庆 400016)
随着全球人口的老龄化,帕金森病(Parkinson's disease,PD)、阿尔采末病(Alzheimer's disease,AD)等神经退行性疾病的发病率也逐渐增加,给家庭与社会带来沉重的负担。目前,PD、AD等神经退行性疾病的发病机制仍不是十分清楚。近年来的大量研究表明,线粒体功能损伤[1]、细胞凋亡[2]、内质网应激[3-4]、氧化应激以及氧自由基[5]损伤广泛参与了其致病过程,其中氧化应激对于神经退行性疾病的发生发展起到非常重要的作用。因此,从天然产物中探索或发现抗氧化作用的化合物并阐明作用机制,对预防此类疾病的发生具有重要的现实意义。
传统中药黄芪具有抗氧化、清除自由基、抗炎等多种生物活性作用[6],黄芪甲苷(AstragalosideⅣ,ASⅣ)为黄芪皂苷类单体成分,被认为是黄芪的主要活性成分。有报道表明,黄芪甲苷可有效延缓机体细胞的衰老过程,促进原代培养神经元增殖,抑制炎症(如 LPS)对单核细胞的损伤[7-8]等作用,但黄芪甲苷是否能有效抑制氧化应激所致的神经元损伤,尚未见报道。本研究通过建立PC12细胞氧化应激体外模型,探讨黄芪甲苷对PC12细胞氧化应激损伤的保护作用与机制,为有效防治神经退行性疾病提供有益的实验数据。
1 材料与方法
1.1 材料 PC12细胞由中国科学院大连化学物理研究所提供;DMEM-F12培养基和胎牛血清购于美国Gibco公司。黄芪甲苷购于南京泽朗医药科技有限公司(黄芪甲苷的溶媒为DMSO,储存液浓度为10 mmol·L-1,应用液浓度为 10 nmol·L-1及 100 nmol·L-1。)。H2O2购于重庆川东化工有限公司。Hoechst 33258染色液购于碧云天生物技术研究所。MTT(噻唑蓝)试剂、Vit C、JC-1染料购于美国Sigma公司。蛋白裂解液以及β-actin抗体购于CST(Cell Signaling Technology)公司。ECL发光剂购于Millipore公司。Cyclin D1抗体、Cyclin A抗体、Phosphop38抗体、T-p38 MAPK抗体购于美国Santa Cruz公司。其它试剂均为国产分析纯。
1.2 细胞培养 PC12细胞按常规培养,DMEMF12培养基,10%Gibco胎牛血清,置于37℃、5%CO2细胞培养箱中培养,0.125% 胰酶消化传代,选取对数生长期细胞进行实验。
1.3 实验分组及药物处理 实验分组为:正常对照组、H2O2(300 μmol·L-1)模型组、黄芪甲苷(10 nmol·L-1)+H2O2(300 μmol·L-1)低浓度处理组、黄芪甲苷(100 nmol·L-1)+H2O2(300 μmol·L-1)高浓度处理组及阳性对照 Vit C(200 mg·L-1)+H2O2(300 μmol·L-1)。孵育24 h 后,除正常对照组外,其余各组吸弃原培养液,加入含相同浓度药物和相应浓度的H2O2培养液,继续孵育4 h后,检测各项实验指标。
1.4 MTT法检测PC12细胞活力 选取对数生长期PC12细胞,接种于96孔板内,每孔加培养液200 μl,接种量8 000个/孔,待细胞长至孔底80%时进行实验。实验分组及药物处理同“1.3”。细胞活力/%=处理组OD值 /空白对照组OD值×100%。
1.5 Hoechst 33258荧光核染色 将PC12细胞接种于12孔板内,实验分组及药物处理同“1.3”。12孔板内加入PBS洗3次,用4% 多聚甲醛室温下固定细胞30 min,PBS洗3次,每孔加入300 μl Hoechst 33258染色液,室温下避光染色5 min,PBS洗3次,在荧光显微镜下观察并照相。
1.6 流式细胞术检测细胞凋亡率、胞内ROS、细胞周期 实验分组及药物处理同“1.3”,胰酶消化收集各组细胞后,PBS洗3次,分别加入 AnnexinVFITC和PI染液,室温下避光孵育15 min,流式细胞仪检测细胞凋亡。
实验分组及药物处理同“1.3”,PBS洗3次,加入ROS荧光探针DCFH-DA置于37℃、5%CO2细胞培养箱中继续孵育1 h,收集各组细胞后,PBS洗3次,流式细胞仪检测细胞内ROS产生。
实验分组及药物处理同“1.3”,收集细胞后,PBS洗3次,加入70% 冰乙醇固定24 h以上,加入PI染液,37℃ 避光孵育20 min,流式细胞仪检测细胞周期。
1.7 Western blot分析 实验分组及药物处理同“1.3”,收集细胞后,加入 150 μl蛋白裂解液(含10%PMSF、10%Tyr抑制剂、10%Ser/Thr抑制剂),冰上反复吹打,置低温离心机于4℃、12 000×g离心15 min,取上清液加入5×的上样缓冲液,煮沸10 min,电泳并转PVDF膜。5% 脱脂奶粉封闭1 h后,分别使用 Cyclin D1、Cyclin A、Phosphop38、T-p38以及 β-actin单克隆抗体,4℃ 孵育过夜,PBST洗3次,二抗室温下孵育1 h,PBS洗3次,ECL化学发光法进行显影。
1.8 统计学处理 本文中的各项实验每组均重复3次以上,采用SPSS 12.0软件进行 统计学处理 ,数据用±s表示,两组间比较采用t检验分析,多组数据间比较采用方差分析法处理。
2 结果
2.1 黄芪甲苷对H2O2作用PC12细胞活力的影响
为了确立PC12细胞损伤模型中合适的H2O2浓度,首先分析不同浓度的H2O2、不同作用时间下PC12细胞活力的变化。结果显示:细胞活力与H2O2浓度及其作用的时间呈正相关,即与正常对照组相比,各实验组细胞活力随H2O2浓度增大而下降,随H2O2作用时间延长而下降。其中300 μmol·L-1H2O2组,当作用时间为4h时细胞活力下降约为65% ,选取300 μmol·L-1H2O2浓度制作应激损伤模型(Fig 1)。
经筛选确定采用 10 nmol·L-1与 100 nmol·L-1浓度的黄芪甲苷,与PC12细胞孵育24 h。结果显示:此浓度范围的黄芪甲苷对PC12细胞的活力均不会产生影响(Fig 2)。但不同浓度黄芪甲苷预保护24 h后经H2O2处理4 h,其对PC12细胞活力有明显作用。与H2O2模型组相比,100 nmol·L-1黄芪甲苷细胞活力明显提高(P<0.01),与阳性对照组Vit C效果相当,见Fig 3。表明黄芪甲苷对H2O2诱导的PC12细胞的氧化应激损伤具有保护作用。

Fig 1 Viability losses in PC12 cells induced by H2O2under different concentrations and time

Fig 2 Viability change of PC12 cells treated by ASⅣunder different concentration circumstances after 24 h.
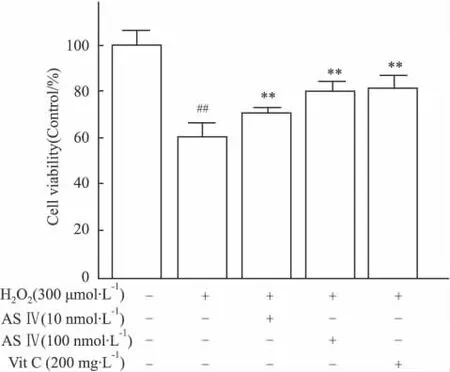
Fig 3 ASⅣinhibited H2O2-induced injury in PC12 cells
2.2 黄芪甲苷对H2O2作用PC12细胞内核酸的保护作用 H2O2对细胞核内的核酸有明显的损伤,为了验证黄芪甲苷对此类损伤是否具有保护作用,对上述实验分组,采用荧光染色法进行测定。空白对照组细胞核染色有均匀的低强度荧光,胞核较大(Fig 4A);H2O2模型组细胞核出现高强度集中的荧光,且胞核变小、浓集,呈现出凋亡细胞的特征(Fig 4B);加入黄芪甲苷预处理后,细胞核荧光强度随剂量增加而降低,胞核逐渐恢复正常形态(Fig 4C、D)。表明黄芪甲苷对H2O2诱导的PC12细胞核内核酸的损伤具有保护作用。
2.3 黄芪甲苷对H2O2作用PC12细胞凋亡率的影响 既然黄芪甲苷对胞内核酸损伤有保护作用,借此,应观察其对细胞凋亡的影响。由流式细胞仪检测结果可知,H2O2模型组PC12细胞凋亡率为26.41% ,而黄芪甲苷不同浓度处理的细胞凋亡率分别恢复到9.71%(10 nmol·L-1)和 9.04%(100 nmol·L-1),见Fig 5。提示黄芪甲苷的确具有抗氧化应激损伤所致细胞凋亡的能力。
2.4 黄芪甲苷对 H2O2作用 PC12细胞后胞内ROS产生及细胞周期的影响 为了探讨黄芪甲苷对氧化损伤的保护机制,采用流式细胞仪检测了其对细胞周期和胞内ROS的影响。结果与对照组比较,H2O2模型组ROS产量高达320% ,不同浓度(10 nmol·L-1和 100 nmol·L-1)黄芪甲苷组 ROS产量分别为292% 与170% ,与模型组相比药物组对ROS的降低明显(P<0.01)(Fig 6)。提示黄芪甲苷可能通过降低胞内ROS的产生起到保护细胞的作用。
从细胞周期分析可以发现:与对照组(G1期:50.24%;S期:43.93%)相比,H2O2模型组G1期细胞下降为41.97%(P<0.01),S期细胞上升为53.23%(P<0.01)。与H2O2模型组相比,不同浓度黄芪甲苷预处理细胞后,G1期细胞分别恢复到46.72%(10 nmol·L-1组)和 50.39%(100 nmol·L-1组),均高于模型组(P<0.01);而S期细胞分别恢复到52.12%与49.02%,100 nmol·L-1黄芪甲苷组S期低于H2O2模型组(P<0.01),见Fig 7。结果提示:H2O2模型组细胞周期被阻滞在S期,加入高浓度黄芪甲苷后可以缓解此现象。
、2.5 黄芪甲苷能恢复H2O2对细胞周期蛋白Cyclin D1、A表达的影响 由于细胞周期蛋白Cyclin D1、Cyclin A参与调控细胞周期,黄芪甲苷是否通过调控Cyclin D1及Cyclin A的表达抑制细胞凋亡的发生?为了验证这一假设,通过Western blot分析显示,与对照组相比,H2O2模型组CyclinD1表达降低,而不同浓度黄芪甲苷预保护组及阳性对照组与模型组相比,均可以恢复Cyclin D1的表达(P<0.01)(Fig 8A),而对Cyclin A的表达则无影响(Fig 8B)。表明,黄芪甲苷对细胞周期的调控机制之一可能是通过上调由H2O2所致Cyclin D1表达的下降而发挥调控作用。
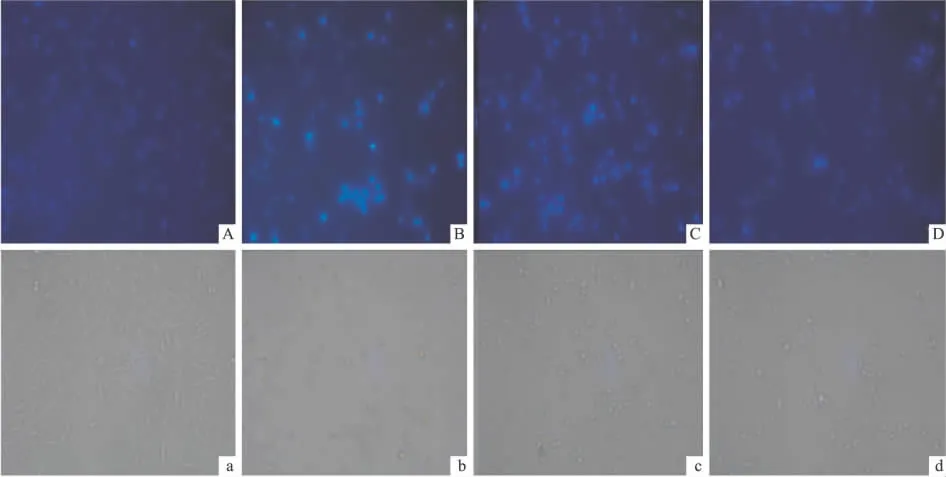
Fig 4 ASⅣinhibited H2O2-induced oxidative damage in PC12 cells by Hoechst 33258 stain
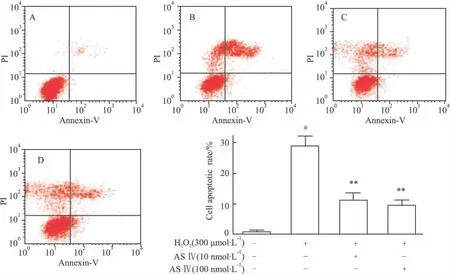
Fig 5 ASⅣprotected PC12 cells from injury induced by H2O2
2.6 黄芪甲苷抑制H2O2诱发的p38/MAPK信号通路的激活 为了进一步探讨黄芪甲苷是否通过抑制H2O2诱发的PC12细胞p38/MAPK信号通路的激活,从而对PC12细胞起到保护作用。通过Western blot检测发现,与对照组相比,H2O2模型组磷酸化p38表达升高(Fig 9);而不同浓度黄芪甲苷预保护组与模型组相比,均能够明显降低磷酸化p38的表达(P<0.01)。表明黄芪甲苷保护细胞氧化损伤的分子机制之一是:可以抑制H2O2诱发的PC12细胞p38/MAPK信号通路的激活。
3 讨论
神经元进行性丢失是神经退行性疾病的一个主要病理特征,其中氧化应激在神经元凋亡过程中起主要作用[9]。神经元含有较丰富的对自由基敏感的多不饱和脂肪酸,易遭受自由基攻击;且神经元内具有抗氧化活性的谷胱甘肽含量较低,使其清除自由基能力下降,以上因素进一步促进了神经元对氧化应激损伤的敏感性[10]。如何有效降低氧化应激对神经元的损伤已成为近年来治疗神经退行性疾病的一个研究热点。本实验通过MTT法和流式细胞术检测,发现黄芪甲苷能够提高H2O2损伤所致PC12细胞的细胞活力的降低,降低胞内由H2O2诱导的ROS的产量及细胞凋亡率。

Fig 6 The fluorescence value decreased after treating with ASⅣin PC12 cells induced by H2O2

Fig 7 Cell cycle assessment of PC12 cells by flow cytometry

Fig 8 Effects of AS Ⅳ on Cyclin D1(A)and Cyclin A(B)expressions of PC12 cells induced by H2O2.
近年来的研究表明,细胞凋亡与细胞增殖周期密切相关[11],阻断细胞增殖周期进程可以引起凋亡,并且凋亡也常伴随细胞周期阻滞。Cyclin D1及Cyclin A是反应细胞周期变化的蛋白,参与调控细胞周期G1期到S期的转变,可以加速细胞周期的进程[12-13]。本实验通过流式检测细胞周期发现,黄芪甲苷能够缓解H2O2对PC12细胞G0/G1期至S期的阻滞现象。为了进一步了解黄芪甲苷缓解细胞周期阻滞的机制,通过Western blot检测各实验组Cyclin D1及Cyclin A的蛋白表达水平发现,与模型组比较黄芪甲苷能够上调细胞周期蛋白Cyclin D1的表达,而对Cyclin A的表达无影响。实验结果提示:黄芪甲苷可能通过调控周期蛋白Cyclin D1的表达,从而影响细胞恢复正常增殖规律。

Fig 9 Effects of ASⅣon p38MAPK phosphorylation of PC12 cells induced by H2O2
p38/MAPK信号通路途径广泛参与了环境应激的应答、炎症的调控及细胞的凋亡。越来越多的研究显示[14-15],p38/MAPK 信号通路途径也参与了细胞增殖的正性与负性调节。黄芪甲苷可能通过调节p38/MAPK信号通路对细胞增殖发挥作用。本实验为了进一步验证此假设,通过 Western blot检测p38/MAPK蛋白的磷酸化表达水平,发现黄芪甲苷能够抑制p38/MAPK信号通路的激活。有研究报道[16-17],某些含有丝氨酸或苏氨酸磷酸化位点的磷酸激酶通常也含有O-连接的糖基化(O-GlcNAc)位点。因此,磷酸化与糖基化的相互竞争可以对相应的激酶产生双向调节作用,最终影响其在信号转导中的作用。本实验中黄芪甲苷是否通过调节OGT水平发挥作用还有待进一步的验证。
[1]Filosto M,Scarpelli M,Cotelli M S,et al.The role of mitochondria in neurodegenerative diseases[J].J Neurol,2011 May 22.http://www.ncbi.nlm.nih.gov/pubmed/21604203.
[2]Martin L J.Neuronal cell death in nervous system development,disease,and injury[J].Int J Mol Med,2001,7(5):455-78.
[3]Matus S,Glimcher L H,Hetz C.Protein folding stress in neurodegenerative diseases:a glimpse into the ER[J].Curr Opin Cell Biol,2011,23(2):239-52.
[4]Salminen A,Kauppinen A,Suuronen T,et al.ER stress in Alzheimer's disease:a novel neuronal trigger for inflammation and Alzheimer's pathology[J].J Neuroinflammation,2009,6(41).http://www.jneuroinflammation.com/content/6/1/41.
[5]Ienco E C,LoGerfo A,Carlesi C,et al.Oxidative stress treatment for clinical trials in neurodegenerative diseases[J].J Alzheimer's Dis,2011,24:111-26.
[6]吴发宝,陈希元.黄芪药理作用研究综述[J].中药材,2004,27(3):232-4.
[6]Wu F B,Chen X Y.Review of pharmacological properties of astragalus[J].J Chin Med Materials,2004,27(3):232-4.
[7]柴丽娟,钟佩茹,张艳军,等.黄芪甲苷对体外神经干细胞增殖作用影响的研究[J].中国药理学通报,2010,26(5):670-3.
[7]Chai L J,Zhong P R,Zhang Y J,et al.Proliferation effects of asteagaloside on neural atem cellsin vitro[J].Chin Pharmacol Bull,2010,26(5):670-3.
[8]冀晓俊,李 昂,段美丽,张淑文.黄芪甲苷对脂多糖刺激单核细胞的保护作用及其机制研究[J].中国中西医结合急救杂志,2010,17(5):271-3.
[8]Ji X J,Li A,Duan M L,Zhang S W.A study on protection and mechanism of astragalosideⅣon monocytes stimulated by lipopolysaccharide[J].Chin J TCM WM Crit Care,2010,17(5):271-3.
[9]潘 静,陈生弟.氧化应激与神经退行性疾病[J].国际神经病学神经外科学杂志,2008,35(2):143-5.
[9]Pan J,Chen S D.Oxidative stress and neurodegenerative disease[J].J Intern Neurol Neuros,2008,35(2):143-5.
[10]Tang X Q,Feng J Q,Chen J,et al.Protection of oxidative preconditioning against apoptosis induced by H2O2in PC12 cell:Mechanism via MMP,ROS,and Bcl-2[J].Brain Res,2005,1057(2):57-64.
[11]Rubin L L,Philpott K L,Brooks S F.Apoptosis:the cell cycle and cell death[J].Curr Biol,1993,3(6):391-4.
[12]Stacey D W.Cyclin D1 selves as a cell cycle regulatory switch iactively proliferating cells[J].Curr Opin Cell Biol,2003,15(2):158-63.
[13]Simile M M,Miglio M R,Muroni M R,et al.Down-regulation of cmyc and Cyclin D1 genes by antisense oligodeoxy nucleotides inhibits the expression of E2F1 andin vitrogrowth of HepG2 ang Morris 5123 liver cancer cells[J].Carcinogenesis,2004,25(3):333-441.
[14]Fernandes D J,Ravenhall C E,Harris T,et al.Contribution of the p38MAPK signalling pathway to proliferation in human cultured airway smooth muscle cells is mitogen-specific[J].Br J Pharmacol,2004,142:1182-90.
[15]Engel F B,Schebesta M,Duong M T,et al.p38 MAP kinase inhibition enables proliferation of adult mammalian cardiomyocytes[J].Genes Dev,2005,19(10):1175-87.
[16]Ju Y H,Yu A M,Xie Z H,Sun X H.Glucosamine inhibits activation of HUVEC induced by LL-37[J].Pro Anatomical Sci,2010,16(3):226-9.
[17]杨同宁,江跃全,于 超,等.壳寡糖通过p38MAPK糖基化修饰抑制TNF-α诱导的 EA.hy926细胞 IL-6、IL-8的表达[J].
中国药理学通报,2011,27(2):252-7.
[17]Yang T N,Jiang Y Q,Yu C,et al.Chitosan oligosaccharides suppress interleukin-6 and interleukin-8 production in vascular endothelialcellsEA.hy926 induced byTNF-α viaincreasing p38MAPK protein O-GlcNAc modification[J].Chin Pharmacol Bull,2011,27(2):252-7.

