CD147超表达对γ分泌酶影响的临床研究*
张锦巍,井丽娟,孙亚平,李 聪,董贵成
(内蒙古科技大学包头师范学院,内蒙古包头 014030)
阿尔茨海默病(Alzheimer′s disease,AD)是神经系统进行性退行性疾病,临床特征表现为高级认知功能、记忆功能障碍和行为异常等[1]。主要病理改变包括大脑皮层和海马区胞外老年斑沉积和胞内神经纤维缠结,老年斑块的主要成分是淀粉样蛋白Aβ40和Aβ42[2-4]。γ分泌酶切割底物C99生成强自聚性的Aβ,γ分泌酶是产生Aβ的最后一步也是限速步骤。因此,研究γ分泌酶的活性调控因子,对于寻找AD的治疗药物有一定指导和借鉴意义。
γ分泌酶由PS、NCT、APH及Pen2四大核心部分组成的具有复杂空间结构和一定活性中心的复合物[3-7],主要参与APP和Notch等重要跨膜蛋白的切割.可切割APP经β-分泌酶切割的产物C99而生成多种Aβ[8]。
CD147是一种高度糖基化的球蛋白,编码基因位于人19号染色体编码269个氨基酸[9]。 CD147在体内分布广泛, 同时表现为高糖型CD147[相对分子质量为(40~66)×103]和低糖型CD147[相对分子质量为33×103]。本文通过CD147 cDNA转染MEF(KO),以研究其对γ分泌酶活性的影响。
1 材料与方法
1.1材料 MEF(KO)由康斯坦茨大学提供、FBS、MEF、脂质体转染培养基、G148、CD147 cDNA、胰酶、混合型酶抑制剂、CHAPSO、预清洁ProteinG Beads、载有PS-1抗体的ProteinA Beads、 CD147一抗、CD147二抗、PVDF膜、ECL试剂、底物C99、Aβpeptide40与 Aβ42的酶联免疫吸附测定(ELISA)反应试剂盒、CO2培养箱、转膜仪、显微镜等。
1.2方法
1.2.1选择生长活力强的细胞 将MEF(KO)在 100 mm×20 mm的平板上培养成为几个梯度。选择36 h内覆盖率达70%~90%的进行下一步实验。
1.2.2CD147 cDNA转染 (1)吸取CD147 cDNA 25 μg加入到1 mL OPTI-MEM 低血清培养基混匀,记做A,室温静置10 min。(2)吸取脂质体60 μL加入到1 mL OPTI-MEM 低血清培养基混匀,记作B,室温下静置10 min。(3)将上述A、B溶液混合均匀,室温静置15 min。(4)吸出 MEF(KO)细胞培养平板的MEF,用未加抗菌药物的选择培养基洗涤3次。(5)将A、B混合溶液加入覆盖80%~90%的平板并再加8 mL选择培养基。(6)培养12 h以后换成不含抗生素含10%FBS的MEF。(7)培养36 h后将1个平板的细胞分成2个平板进行培养。(8)培养72 h后可进行第2次转染,方法同上。(9)96 h后收集经过CD147 cDNA转染的细胞。(10)转染后的细胞进行蛋白质免疫印迹法(Western blotting)检测。
1.2.3G418筛选CD147超表达转染细胞 配制梯度浓度分别为150、300、600、1 200 mg/mL,以确定G418的最佳筛选浓度。将CD147 cDNA转染后的细胞接种到含G418的培养基中,24 h后吸出上浮死掉的细胞,并再次更换培养,10~15 d后将细胞移至96孔板扩大培养。15 d后用胰蛋白酶溶解处理细胞,移至皿中培养,并加入含G418的培养液,10 d后收集细胞,用于Western blotting,以筛选CD147最高表达的细胞。
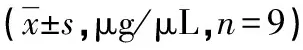
表1 CD147的表达量

表2 Aβ40和Aβ42的生成量总含量
1.2.4收集细胞并分离纯化蛋白 处理实验组(E)和对照组(C)细胞,并收集纯化含γ分泌酶的样本:(1)细胞破碎制备全蛋白C1和E1;(2)加入CHAPSO彻底溶解后,超速离心制备C2和E2;(3)用PS-1抗体纯化C2或E2制备IPC2和IPE2。实验步骤:将E组和C组的细胞分别收集到2 mL的离心管,用磷酸盐缓冲液(PBS)洗涤3次,13 000 r/min 4 ℃离心2 min去液。加入0.5 mL匀浆缓冲液后,用细胞破碎针头破碎40~50次,3 000 r/min离心5 min.取0.5 mL上清液,加入0.5 mL匀浆缓冲液,再破碎一次,保留上清液1 mL,分别取上清液0.2 mL,记为E1或C1,加入CHAPSO的Hepes buffer备用,将剩余上清液0.8 mL移入超速离心管,50 000 r/min离心60 min,以沉淀蛋白,加入含1%CHAPSO的Hepes buffer 0.2 mL。混合物于4℃ 空摇90 min,35 000 r/min离心30 min,取0.2 mL上清液,分别记为E2或C2。在所剩0.8 mL上清液中,加入30 μL ProteinG Beads,经4 ℃摇动90 min,然后13 000 r/min离心2 min,以弃除ProteinG Beads。上清液中加入2 μL PS1抗体与30 μL ProteinA Beads,置于垂直混合旋转器上于4 ℃放置24 h经13 000 r/min离心2 min得ProteinA Beads,用含CHAPSO的Hepes buffer清洗4次。吸附在ProteinA Beads上的蛋白即为γ分泌酶复合物,分别记为IPC2和IPE2。Western blotting 分析C1、E1、C2、E2、IPC2、IPE2中CD147的量。
1.2.5ELISA分析样品C1、E1、C2、E2、IPC2及IPE2中γ分泌酶复合物活性 取上述样本E1、C1、E2或C2 0.1 mL(蛋白浓度1.5 mg/mL),加入3 μL底物C99(终浓度0.5 μmoL),于37 ℃反应7 h。将100 μL含 CHAPSO的Hepes buffer,3 μL C99加入IPE2和IPC2中于37 ℃进行同样反应7 h。将上述反应液50 μL以及Aβ40与 Aβ42的标准品分别加酶标板中,加一抗50 μL于37 ℃孵育4 h。将上清液吸出,洗脱3次后,加入已配好的二抗稀释液150 μL 37 ℃反应60 min。再一次将上清液吸出,洗脱4次。然后加入稳定发色液150 μL 37 ℃放置60 min,加入等量的终止液。混匀后测产物。
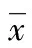
2 结 果
2.1Western blotting分析CD147表达量 实验组E1、E2及IPE2中CD147表达量较相应对照组样本C1、C2和IPC2分别上升(11±5.5)%,差异无统计学意义(P=0.08),上升(28.2±9.1)%,差异有统计学意义(P<0.01)及上升(50.0±9.8)%,差异有统计学意义(P<0.002),见表1。
2.2ELISA分析Aβ40和Aβ42的生成量 实验组所得E1、E2及IPE2与饱和浓度底物C99反应生成的Aβ40和Aβ42总量均明显低于同样方法从对照组细胞制备所得样本C1、C2及IPC2。参照样本C1、C2及IPC2,经CD147转染,样本E1、E2及IPE2 中所含γ分泌酶活性分别降低(61.8±3)%,差异无统计学意义(P=0.25),降低(82.9±5)%,差异有统计学意义(P<0.001),降低(190±7)%,差异有统计学意义(P<0.001)。比较对照组样本C1、C2及IPC2,在相同的条件下,样本IPE2催化生成的短肽Aβ40和Aβ42含量最低,见表2。
2.3经CD147超表达处理后MEF(KO)中CD147表达情况 见图1。

图1 CD147超表达后蛋白质Western blotting分析结果
图2 C1和E1中CD147蛋白质含量的Western blotting分析结果
2.4C1、C2和E1、E2中CD147蛋白质含量的Western blotting分析结果 CD147 cDNA超表达后实验组CD147表达量增加,见图2、3。
2.5IPC2和IPE2中CD147蛋白质含量的Western blotting分析结果 C2与E2经PS-1特异性抗体免疫沉淀所得IPC2和IPE2,γ分泌酶复合物得到进一步纯化,见图4。
2.6ELISA检测样本中所含γ分泌酶活性 随着CD147的表达的进一步增加,Aβ的表达量减少,可知γ分泌酶活性随CD147表达量增高而负增长,见图5。

图3 C2和E2中CD147蛋白质含量的Western blotting分析结果
图4 IPC2和IPE2中CD147蛋白质含量的Western blotting分析结果

图5 ELISA检测样本(C1、E1、C2、E2、IPC2和IPE2)中所含γ分泌酶活性
3 讨 论
由于γ分泌酶切割C99是生成Aβ的最后一步也是限速步骤[10],所以近期对γ分泌酶抑制剂的研究一直是个热点,同时也是个难点。突出表现为抑制剂选择性差。首先,淀粉斑块是以Aβ42为核心,周围聚集Aβ40。Aβ42极难溶解,但占Aβ的比例很小,而Aβ40是可溶的且还有其他未知的作用[11-12]。而选择性差的抑制剂对于抑制Aβ40的生成作用强于Aβ42。其次,γ分泌酶在作用APP的同时也作用其他神经递质,一旦生成或分解受阻,就会引起神经系统中毒,其不良反应远远大于预期结果。 现阶段,γ-分泌酶抑制剂主要包括抑制γ分泌酶酶解APP和抑制PS蛋白酶,实际上只是当作工具药来研究酶本身的结构和功能[13]。选择性、稳定性、血脑屏障的穿越和细胞摄取等,都是研究抑制剂所必须考虑的。
既然Aβ42占Aβ总量的比例很小,只要使γ分泌酶的活性降低一定的值,就能相对减少Aβ42的生成量,达到理想的效果。如果抑制剂本身就是γ分泌酶复合体的组成成分且能调控γ分泌酶的活性,以上的一切问题就迎刃而解了。
研究证明蛋白CD147能够调节导致淀粉体斑块的产生[14-15]。利用靶向的RNA沉默细胞中的CD147,而γ分泌酶的组成亚基以及淀粉样前体蛋白都不受这种沉默的影响。当CD147被沉默时,Aβ的产量显著增加了。
本实验通过第一步Western blotting检测CD147蛋白的表达量,证明超表达细胞模型构建成功。第二步的数据显示超表达细胞模型可稳定、高效的表达目的蛋白。第三步CHAPSO溶解膜蛋白复合物、超速离心使CD147得到了纯化,证明CD147和跨膜蛋白结合紧密。特异性PS1抗体沉淀,使样品进一步纯化,说明CD147可能是γ分泌酶的调控亚基。为进一步研究其对γ分泌酶活性的影响奠定了基础。
ELISA分析表明,随着CD147的表达量增高,Aβ40和Aβ42的产量下降,证明CD147是γ分泌酶的负调控因子。
[1]Kaether C,Haass C,Steiner H.Assembly,trafficking and function of gamma-secretase[J].Neurodegener Dis,2006,3(4/5):275-283.
[2]Kodam A,Vetrivel KS,Thinakaran G,et al.Cellular distribution of γ-secretase subunit nicastrin in the developing and adult rat brains.[J]Neurobiol Aging,2008,29(5):724-738.
[3]Xu GW,Wang JP,Huang XM.Assembly of γ-secretase for production of β-amyloid.[J]Chinese Bulletin of Life Sciences,2007,19(2):214-219.
[4]Lazarov VK,Fraering PC,Ye W,et al.Electron microscopic structure of purified,active gamma-secretase reveals an aqueous intramembrane chamber and two pores[J].Proc Natl Acad Sci U S A,2006,103(18):6889-6894.
[5]Wolfe MS.The gamma-secretase complex:membrane-embedded proteolytic ensemble[J].Biochemistry,2006,45(26):7931-7939.
[6]Siemers ER,Dean RA,Friedrich S,et al.Safety,tolerability,and effects on plasma and cerebrospinal fluid amyloid-β after inhibition of γ-secretase.[J]Clin Neuropharmacol,2007,30(6):317-325.
[7]Wolfe MS.Inhibition and modulation of γ-secretase for Alzheimer′s disease.[J]Neurotherapeutics,2008,5(3):29-32.
[8]梁平,潘阳杏.早老素1基因在转染CHO细胞中的表达及其与γ-分泌酶的关系[J].中华病理学杂志,2005,34(5):297.
[9]黄灵芝,王字玲.CD147的研究进展[J].生物技术通讯杂志,2007,18(3):472-473.
[10]陈新平,陈彪.阿尔茨海默病病因学及发病机制研究进展[J].中国现代神经疾病杂志,2005,5(3):152-155.
[11]Hutter-Paier B,Huttunen HJ,Pugielli L,et al.The ACAT inhibitor CP-113,818 markedly reduces amyloid pathology in a mouse model of Alzheimer′s disease[J].Neuron,2004,44(2):227-238.
[12]Zimmermann M,Gardoni F,DiLuca M.Molecular rationale for the pharmacological treatment ofAlzheimer′s disease[J].Drugs Aging,2005,22 Suppl:27-37.
[13]HoyerA,BardenheuerHJ,MartinE,etal.Amyloidprecursorprotein(APP)anditsderivativeschangeaftercellularenergydepletion[J].NeuralTransmission,2005,112(2):239-253.
[14]陈翔,颜克香.CDl47siRNA表达载体的构建与鉴定[J].中华皮肤科杂志,2006,38(6):368-369.
[15]Kirk P,Wilson MC,Heddle C,et al.CD147 is tightly associated with lactate trans-porters MCT1 and MCT4 and facilitates their cell surfaceexpression[J].EMBO,2000,19(15):3896-3904.

