硫化氢和同型半胱氨酸在动脉粥样硬化病变中的研究现状
刘会娟,周春阳
(川北医学院药学院,川北医学院药物研究所,四川 南充 637007)
硫化氢和同型半胱氨酸在动脉粥样硬化病变中的研究现状
刘会娟,周春阳△
(川北医学院药学院,川北医学院药物研究所,四川 南充 637007)
动脉粥样硬化(atherosclerosis,AS)性病变是目前世界上心血管疾病的发生率与死亡率高的首位原因,严重危害人们的生命健康安全。动脉粥样硬化主要累及大中动脉,是一种慢性复杂的累进型病理过称。高同型半胱氨酸血症(Hyperhomocysteinemia,HHcy)是动脉粥样硬化形成的独立危险因子,它可以通过转硫基作用等转化成硫化氢,但是其致病机制尚未完全阐明。近年来,硫化氢(hydrogen sulfide,H2S)因其在心血管健康和内稳态调节平衡方面的诸多积极性作用而受到重要关注。新近研究发现H2S在动脉粥样硬化病变过程中发挥重要作用。AS的发生发展与同型半胱氨酸(homocysteine,Hcy)和H2S存在一定的内在联系,本文拟对此方面的研究和认识作一综述。
同型半胱氨酸;硫化氢;动脉粥样硬化;胱硫醚-β-合成酶;胱硫醚-γ-裂解酶
动脉粥样硬化(atherosclerosis,AS)性病变是目前世界上心血管疾病的发生率与死亡率高的首位原因,严重危害人们的生命健康安全。动脉粥样硬化的特点是受累动脉的病变从内膜开始,先后有多种病变合并存在,包括局部有脂质和复合糖类积聚、纤维组织增生和钙质沉着形成斑块,并有动脉中层的逐渐退变,继发性病变尚有斑块内出血、斑块破裂及局部血栓形成(称为粥样硬化-血栓形成,atherosclerosis-thrombosis)。到目前为止,AS的发病机制尚未最后阐明。学说很多,如脂质浸润学说、平滑肌突变学说、炎症学说、内皮损伤学说、单核-巨噬细胞作用学说等。
大量流行病学调查显示高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)与外周血管、脑血管和冠状动脉疾病存在密切相关性。H2S是同型半胱氨酸(homocysteine,Hcy)的代谢产物之一,由甲硫氨酸循环代谢而来。研究发现硫化氢(hydrogen sulfide,H2S)在动脉粥样硬化病变过程中发挥重要作用。本文拟对在AS的发生发展中与Hcy和H2S的内在联系的研究和认识作一综述。
1 硫化氢的体内合成与同型半胱氨酸代谢
在体内,H2S的来源主要通过酶促途径。三种酶催化H2S的产生:胱硫醚-β-合成酶(cystathionineβ-synthase,CBS)、胱硫醚-γ-裂解酶(cystathionine-γlyase,CSE或CGL)和三巯基丙酮酸转硫酶(3-mercaptopyruvate sulphurtransferase,MPS)。在哺乳动物中,H2S主要是由体内含硫氨基酸如L-半胱氨酸、甲硫氨酸和胱氨酸在两种5'-磷酸吡多醛依赖性酶即CBS和CSE(CGL)催化下产生的。CBS主要表达于脑、外周神经系统、肾、肝,而CSE除在肝脏以外,主要表达于心、血管内皮及平滑肌细胞,是心血管系统中H2S的主要来源。红细胞是内源性H2S的另一个来源,红细胞内源性H2S的产生主要依赖巯基丙酮酸转硫酶(sulphurtransferase,MPST)的作用[1]。H2S的生理浓度因不同的器官而不同,从1 nmol/g组织到100 nmol/g组织。血中H2S浓度约为10~300 μmol/L。在pH 7.4的生理性水溶液中,1/3的H2S以气体分子存在,2/3被解离为H+和HS-。
除酶促途径外,体内H2S也可来源于非酶促途径,如:硫元素、含于大蒜中的无机及有机多价硫等[2]。内源性H2S的也可来源于肠道菌丛。
Hcy的产生与转化涉及到一个重要的物质代谢循环,即蛋氨酸循(methionine cycle)。蛋氨酸是人体必需的含硫氨基酸,须由食物供给。蛋氨酸在体内由蛋氨酸腺苷转移酶催化与ATP作用生成S-腺苷蛋氨酸(S-adenosylmethionine,SAM),SAM在甲基转移酶作用下,将甲基转移至另一物质,使其甲基化,自身转变成S-腺苷同型半胱氨酸(S-adenosylhomocysteine,SAH),后者进一步脱去腺苷,生成Hcy。Hcy生成后通过转硫基途径或再甲基化途径代谢[3],同型半胱氨酸是蛋氨酸和L-半胱氨酸代谢过程中的一个中间产物。在正常情况下,CBS可使同型半胱氨酸与丝氨酸缩合为胱硫醚[4],代谢掉多余的Hcy。体内H2S的产生主要由CBS和CSE催化的酶促途径[5-6],其底物主要是蛋氨酸循环中的Hcy以及L-半胱氨酸(图1)。
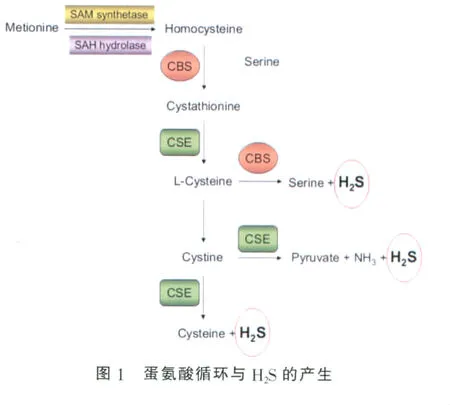
CBS和CSE催化产生H2S的多个反应是相同的,但在不同的组织器官或底物浓度,CBS和CSE对H2S的贡献率存在差异[7]。总体而言,70%主要来源于半胱氨酸的αβ消除,约30%来源于同型半胱氨酸αγ消除,在HHcy情况下,H2S主要来源于Hcy,并与之成比例[5]。Chen等[8]研究发现,CBS催化生成H2S的主要机制不是通过半胱氨酸水解产生,而是通过半胱氨酸和Hcy置换反应实现的,这个途径产生H2S的量至少是通过半管氨酸水解产生的H2S的50倍。
H2S和Hcy都是含硫氨基酸代谢产物,Hcy作为H2S的底物促进后者产生。
2 硫化氢和同型半胱氨酸对AS的作用
血浆Hcy水平升高可促进动脉粥样硬化和血栓形成,是动脉粥样硬化性病变的独立危险因素。周春阳[9]提出Hcy致AS的可能涉及的因素有:内皮功能损害、氧化应激反应、非对称二甲基精氨酸、内质网应激、DNA低甲基化对血管平滑肌的作用、蛋白同型半胱氨酸化。Wang等[10]研究发现,硫化氢可以缩小动脉粥样硬化斑块,延缓AS斑块的形成,体内H2S水平的下降是AS形成的重要原因之一。H2S对AS的作用机制包括:H2S对血管内皮的保护作用、抑制低密度脂蛋白修饰和脂质摄取、抑制血管钙化、抑制平滑肌细胞增殖等。
2.1 硫化氢对血管内皮的保护
内皮细胞在维持血管壁功能的完整性上起重要作用。一旦内皮受损,则失去它的生理作用,并促进AS的早期和后期机制。内皮功能障碍包括黏附分子如细胞间黏附分子-1(intercellular adhesionmolecule-1,ICAM-1)和血管细胞黏附分子-1(vascular cell adhesionmolecule-1,VCAM-1)分泌增加、白细胞黏附、内皮细胞对脂质和血浆其它成分的渗透性提高、单核巨噬细胞向内膜迁移等。H2S的内皮保护功能很有可能是通过抗细胞凋亡、抑制内皮细胞炎症分子的表达、抑制内皮细胞增生等发生作用的。彭湘萍等[11]报道H2S对内皮细胞损伤有保护作用,且保护作用强弱与剂量有关,其机制可能与降低氧自由基抗氧化作用有关。内皮细胞凋亡严重破坏血管内皮的完整性,促进AS的发生发展。根据Wang等[10]的报道,H2S可以抑制ICAM-1的表达与分泌,从而抑制动脉粥样斑块形成。贺锐等[12]研究报道H2S很可能是上调粥样斑块内的白细胞介素-10(IL-10)的表达,以发挥抑制动脉粥样硬化硬化斑块的形成的作用。Yang等[13]报道,H2S能抑制细胞增生,其功能是通过调节ERK和P21使CSE超表达来发挥的。
2.2 抑制低密度脂蛋白修饰和脂质摄取
低密度脂蛋白(low density lipoprotein,LDL)是血浆中的一类脂蛋白,一旦修饰后即转为促AS形成的重要物质。Jeney等[14]报道H2S还可抑制氯化血红素介导LDL发生的氧化修饰,并抑制OX-LDL诱导的内皮细胞氧化应激蛋白血红素加氧酶-1的表达,保护内皮细胞免受OX-LDL的细胞毒性。而大量研究报道过氧化脂质是OX-LDL致AS形成的重要成分,由此推测H2S可能通过抑制LDL修饰和清除过氧化脂质而维持内环境的稳态、保护细胞。被修饰的LDL蓄积于内膜,进而被巨噬细胞摄取形成泡沫细胞是AS病变的早期事件之一。
2.3 抑制血管平滑肌细胞增殖
平滑肌细胞增殖在血管损伤疾病中是一个重要事件,尤其是动脉粥样硬化。Baskar等[15]报道称硫化氢抑制大鼠血管平滑肌细胞增殖。血管内皮生长因子(vascular endothelial growth factor,VEGF)因具有非选择性地促DNA合成和细胞分裂增殖、刺激AS成纤维细胞及血管平滑肌细胞增生作用,并促进动脉内膜增厚和粥样斑块的发展,导致斑块不稳定和破裂出血、形成血栓而越受重视。陈世健等[16]报道补充外源性H2S可抑制VEGF的表达,减轻血管损伤程度,提示H2S具有抗大鼠动脉粥样硬化的作用,其机制可能与其抑制AS大鼠血管VEGF的表达有关。
2.4 H2S/CSE途径
Wu等[17]指出在钙化大鼠心血管组织中,CSE/H2S通路显著下调,血浆、心肌和主动脉组织H2S含量减少,CSE活性降低、mRNA表达减少,而给予NaHS治疗后,可显著抑制钙化大鼠血压升高,减少血管钙超载和45Ca2+沉积,降低ALP活性等。这些结果提示,CSE/H2S可能参与动脉粥样硬化发病的调节,且其机制远未阐明。Li等[18]报道,通过上调主动脉H2S/CSE途径,洋葱提取物能明显减少大鼠动脉粥样硬化。
2.5 抑制氧化应激和内质网应激
Tyagi等[19]报道H2S保护由HHcy介导的氧化应激反应对内皮的损伤。Chang等[20]研究发现H2S恢复CSE酶活性,加速清除由Hcy诱导的在离体线粒体情况下产生H2O2和超氧负离子。HHcy损害心肌的CSE/H2S系统,H2S保护心肌不受由Hcy诱导的氧化应激和内质网应激。Tang等[21]发现H2S拮抗Hcy诱导的氧化应激和神经毒性。Yan等[22]报道应用低水平NaHS(30~50μmol/L)可保护平滑肌细胞免受Hcy诱导的细胞毒性和活性氧类(H2O2、ONOO-、O2-)产生,改善细胞的存活能力。上述实验提示内源性H2S可以抑制由Hcy介导的氧化应激和细胞毒性,细胞凋亡。总结见表1。

表1 高同型半胱氨酸与硫化氢的对抗作用比较
由此看来H2S和Hcy有明显的对抗作用。这给我们一个新的提示含硫氨基酸的内源性平衡可能在治疗HHcy血症所致的疾病中是一个新的方向。
3 关键酶与硫化氢和同型半胱氨酸
虽然HHcy促进AS的形成,AS也时常伴有HHcy血症;而H2S抑制AS的形成,AS时常伴有H2S的降低。但是有趣的是,Hcy能够产生H2S。H2S是L-Hcy和半胱氨酸的代谢产物[23],70%的H2S产生由CBS和CSE催化。Chiku等[24]报道,当高浓度Hcy时,起主要作用的是CSE,当Hcy浓度达200 mmol时,近90%H2S的生成由CSE起作用。CSE主要存在于心血管中,而CBS主要存在于神经系统中。在正常情况下,只有一半的Hcy能够转化成H2S。因此Tyagi等[25]提出一个可能的方案:如果通过基因治疗在血管中能够表达CBS,使Hcy转化成H2S,或许可以减少HHcy引起的血管损害作用。
最近研究发现CSE转录受到核受体FXR(Farnesoid X Receptor)的调控,并可能因此而调节H2S的代谢。CBS或CSE损害或缺损都可能导致高Hcy血症或尿症,并增加包括动脉粥样硬化在内的心血管疾病的发病风险[26]。
Bearden等[27]研究证实,血液中存在转硫酶CBS和CSE活性,内皮细胞本身和肝脏可向环境分泌转硫酶,当血管内皮细胞受Hcy损害时,通过转硫途径产生的H2S对培养内皮细胞饥饿和缺氧-再给氧损伤,以及氧化-还原应激(redox stress)具有保护作用,并认为该转硫途径产生的H2S可保护高Hcy所致的损伤。因此,机体通过转化Hcy为H2S而发挥保护作用可以认为是机体对损伤的一种自身调节机制。
在对血透病人(慢性肾功能不良病人)的研究[28]中发现:Hcy和半胱氨酸的升高并伴有H2S降低,CSE的表达也明显下调,并认为尿毒症病人编码产生H2S酶基因的转录性下调与其病理综合征如高血压、动脉粥样硬化的形成等有关。
4 讨论
根据酶促反应动力学,在其他因素不变的情况下,在底物浓度较低时,反应速度随底物浓度的增加而急骤上升,两者成正比关系,反应呈一级反应。随着底物浓度的进一步增高,反应速度不再呈比例加速。反应速度增加的幅度逐渐下降。如果继续加大底物浓度,反应速度将不再增加,表现出零级反应。此时的酶活性中心已被底物饱和。作为H2S的前体物质,当体内Hcy浓度增高时,H2S的量应该增加,但研究报道显示体内HHcy血症常伴有低H2S。迄今为止,其原因未见相关报道,笔者认为是否与酶活性饱和有关,有待进一步研究证实。H2S的不同浓度对细胞的功能也不明确,依照Baskar等[29]的总结来看,不同的H2S浓度对不同组织的正常细胞有不同的功能,可促进增殖也可抑制增殖。高浓度H2S是否对细胞有毒性作用,从而反过来抑制H2S产生相关酶活性,这些都有待进一步的研究。H2S水平的变化是否参与HHcy所致AS等病变机制尚不明确,不同浓度Hcy对细胞内H2S产生的浓度,对相关酶CBS,CSE的活性的影响的研究报道尚少。相信随着对Hcy、H2S和AS关系及其作用机制更深入的了解,人们将为AS的预防和治疗提供新的理论依据和临床治疗靶点。
[1]赵晶,房立平,许戈阳,等.红细胞内源性硫化氢的测定[J].北京大学学报(医学版),2007,39(5):449-452
[2]Benavides GA,Squadrito GL,Mills RW,et al.Hydrogen sulfide mediates the vasoactivity of garlic[J].Proc Natl Acad Sci USA,2007,104(46):17977-17982
[3]Stead LM,Au KP,Jacobs RL,et al.Methylation damaand and homocysteine metabolism:effects of dietary provision of creatine and guanidinoacetate[J].Am J Physiol Endocrinol Metab,2001,281(5):1095-1100
[4]Finkelstein JD,Martin JJ.Methionine metabolism in mammals:distribution of homocysteine between competing pathways[J].Biol Chem,1984,259(15):9508-9513
[5]Singh S,Padovani D,Leslie RA,et al.Relative contributions of cystathionine beta-synthase and gamma-cystathionase to H2S biogenesis via alternative trans-sulfuration reactions[J].Biol Chem,2009,284(33):22457-22466
[6]Chiku T,Padovani D,Zhu W,et al.H2S biogenesis by human cystathionine gamma-lyase leads to the novel sulfur metabolites lanthionine and homolanthionine and is responsive to the grade of hyperhomocysteinemia[J].Biol Chem,2009,284(17):11601-11612
[7]Leffler CW,Parfenova H,Basuroy S,et al.Hydrogen sulfide and cerebral microvascular tone in newborn pigs[J].Am J Physiol Heart Circ Physiol,2011,300(2):H440-447
[8]Chen X,Jhee KH,Kruger WD.Production of the neuromodulator H2S by cystathionine beta-synthase via the condensation of cysteine and homocysteine[J].Biol Chem,2004,279(50):52082-52086
[9]周春阳.同型半胱氨酸与动脉粥样硬化病变研究历史与现状概述[J].川北医学院学报,2009,24(1):1-8
[10]Wang Y,Zhao X,Jin H,et al.Role of hydrogen sulfide in the development of atherosclerotic lesions in apolipoprotein E knockout mice[J].Arterioscler Thromb Vasc Biol,2009,29(2):173-179
[11]彭湘萍,彭振宇.H2S对ox-HDL致内皮细胞损伤的保护作用[J].吉首大学学报(自然科学版),2011,32(2):108-110,117
[12]贺锐,马康华,左中,等.硫化氢对球囊损伤后兔颈动脉斑块和抗炎因子IL-10表达的影响[J].解放军医学杂志,2010,35(2):169-172
[13]Yang G,Cao K,Wu L,et al.Cystathionine gamma-lyase overexpression inhibits cell proliferation via a H2S-dependent modulation of ERK1/2 phosphorylation and p21Cip/WAK-1[J].Biol Chem,2004,279(47):49199-49205
[14]Jeney V,Komódi E,Nagy E,et al.Supression of hemin-mediated oxidation of low-density lipoprotein and subsequent endothelial reactions by hydrogen sulfide(H(2)S)[J].Free Radic Biol Med,2009,46(5):616-623
[15]Baskar R,Sparatore A,Del Soldato P,et al.Effect of S-diclofenac,a novel hydrogen sulfide releasing derivative inhibit rat vascular smooth muscle cell proliferation[J].Eur J Pharmacol,2008,594(1-3):1-8
[16]陈世健,严晓红,祝晓莹,等.硫化氢抗大鼠动脉粥样硬化作用研究[J].中国应用生理学杂志,2010,26(1):1-7
[17]Wu SY,Pan CS,Geng B,et al.Hydrogen sulfide ameliorates vascular calcification induced by vitamin D3 plus nicotine in rats[J].Acta Pharmacol Sin,2006,27(3):299-306
[18]Li W,Tang C,Jin H,et al.Regulatory effects of sulfur dioxide on the development of atherosclerotic lesions and vascular hydrogen sulfide in atherosclerotic rats[J].Atherosclerosis,2011,215(2):323-330
[19]Tyagi N,Mishra PK,Tyagi SC.Homocysteine,hydrogen sulfide(H2S)and NMDA-receptor in heart failure[J].Indian J Biochem Biophys,2009,46(6):441-446
[20]Chang L,Geng B,Yu F,et al.Hydrogen sulfide inhibits myocardial injury induced by homocysteine in rats[J].Amino Acids,2008,34(4):573-585
[21]Tang XQ,Chen RQ,Ren YK,et al.ACS6,a Hydrogen sulfide-donating derivative of sildenafil,inhibits homocysteine-induced apoptosis by preservation of mitochondrial function[J].Med Gas Res,2011,1(1):20
[22]Yan TT,Li Q,Zhang XH,et al.Homocysteine impaired endothelial function through compromised vascular endothelial growth factor/Akt/endothelial nitric oxide synthase signalling[J].Clin Exp Pharmacol Physiol,2010,37(11):1071-1077
[23]Beltowski J.Hydrogen sulfide as a biologically active mediator in the cardiovascular system[J].Postepy Hig Med Dosw,2004,58:285-291
[24]Chiku T,Padovani D,Zhu W,et al.H2S biogenesis by human cystathionine gamma-lyase leads to the novel sulfur metabolites lanthionine and homolanthionine and is responsive to the grade of hyperhomocysteinemia[J].Biol Chem,2009,284(17):11601-11612
[25]Tyagi N,Mishra PK,Tyagi SC.Homocysteine,hydrogen sulfide(H2S)and NMDA-receptor in heart failure[J].Indian J Biochem Biophys,2009,46(6):441-446
[26]Renga B.Hydrogen Sulfide Generation in Mammals:The Molecular Biology of cystathionine-β-synthase(CBS)and cystathionine-γlyase(CSE)[J].Inflamm Allergy Drug Targets,2011,10(20):85-91
[27]Bearden SE,Beard RS Jr,Pfau JC.Extracellular transsulfuration generates hydrogen sulfide from homocysteine.and protects endothelium from redox stress[J].Am J Physiol Heart Circ Physiol,2010,299(5):1568-1576
[28]Perna AF,Luciano MG,Ingrosso D,et al.Hydrogen sulphide-generating pathways in haemodialysis patients:a study on relevant metabolites and transcriptional regulation of genes encoding for key enzymes[J].Nephrol.Dial.Transplant,2009,24(12):3756-3763
[29]Baskar R,Bian J.Hydrogen sulfide gas has cell growth regulatory role[J].Eur J Pharmacol,2011,656(1-3):5-9
Hydrogen sulfide and homocysteine atherosclerotic lesions in the current status
LIU Hui-juan,ZHOU Chun-yang△
(School of Pharmacy,Institute of Materia Medica,North Sichuan Medical College,Nanchong 637007,Sichuan,China)
Atherosclerotic lesions are the primary cardiovascular disease causing the highest rates of mortality resulting in serious harm to people's health and safety of life.Atherosclerosis is a chronic,complex,and progressive pathological process in large and medium sized arteries.Hyperhomocysteinemia has been recognized as an independent risk factor for atherosclerosis,which is converted to hydrogen sulfide(H2S)through the transsulfuration pathway.Controversy still remains though about its pathogenesis.H2S has attracted considerable attention in recent years for many of its positive effects on vascular health and homeostasis.New research found H2S in the atherosclerotic lesions play an important role in the process as happened with Hcy and H2S,which have certain developmental internal relations.This paper reviews the research and understanding of these hydrogen sulfide processes.
Homocysteinemia;Hydrogen sulfide;Atherosclerosis;Cystathionine-β-synthase;Cystathionine-γ-lyase
1005-3697(2012)06-0547-05
R543
A
10.3969/j.issn.1005-3697.2012.06.007
四川省科技厅(05SG1862);四川省教育厅(11ZA193)
2012-10-06
刘会娟(1986-),女,陕西宝鸡人,硕士研究生,主要从事心血管基础与临床药理学方面的研究。
△通讯作者:周春阳,E-mail:chunyangzhou@hotmail.com网络出版时间:2012-11-1217∶12
http://www.cnki.net/kcms/detail/51.1254.R.20121112.1712.017.html

