小分子硼酸肽的自组装
陈昌盛,李仕颖,王 俊,张先正,卓仁禧
(武汉大学化学与分子科学学院生物医用高分子材料教育部重点实验室,湖北武汉430072)
小分子硼酸肽的自组装
陈昌盛,李仕颖,王 俊,张先正,卓仁禧
(武汉大学化学与分子科学学院生物医用高分子材料教育部重点实验室,湖北武汉430072)
利用FMOC化学固相多肽合成法合成了3种含精氨酸的小分子硼酸肽(标记为BPs(1-3))。在生理pH下,含阳离子的硼酸肽可自组装形成有序超分子纳米组装体。二羟基酚染料茜素红与硼酸肽可特异性结合形成五元环硼酸酯,伴随荧光和颜色的显著变化,可进一步调控硼酸肽的自组装行为。通过扫描电镜研究茜素红调控前后硼酸肽的自组装形态,并用红外光谱和圆二色谱研究其自组装机理。结果表明,3种含精氨酸硼酸肽在生理pH下可自组装形成不同的超分子纳米组装体。通过茜素红的调控,茜素红/硼酸肽化合物,可自组装形成更有序,更精致的超分子聚集体。
硼酸肽;自组装;超分子聚集体;纳米材料
1 前言
自组装或自组织是自然界中普遍存在的一种现象,是构建绚丽多彩的生物世界的一种普遍方法。从DNA的双螺旋结构和细胞膜的磷脂双分子层到功能齐备的细胞以及完整的生命个体,无不蕴含有自组装或自组织现象。海洋鱼类的洄游,天空飞鸟的迁徙同样体现着自组织的美丽风景和生命特征。自组装也是构建功能材料的一种新方法,基于脂质体、核酸以及蛋白质的纳米组装体,研究人员总结出了一套“自下而上”的方法来构建自组装纳米材料。从分子设计出发,构建自组装分子砌块,通过分子砌块的多种非共价键的协同作用自组装或自组织形成高度有序的微、纳米聚集体。目前,磷脂类分子自组装成胶束或囊泡,DNA分子自组装形成图案化的微、纳米有序聚集体,以及多肽分子自组装形成纳米纤维、纳米管、纳米球等超分子组装体已成为仿生制备的热点研究领域,部分仿生自组装材料已被用于药物和基因传递或组织工程领域[1-3]。
多肽的同源性结构以及多种功能性序列决定了它是一类良好的生物材料。近年来,多肽分子砌块用于构建功能纳米材料,得到了广泛的研究和发展[3-5]。同时,多肽的折叠和自组装也是诱导某些神经退行性疾病,如阿尔兹海默综合症和亨廷顿舞蹈症等的重要因素[6]。因此,研究多肽的自发自组装对于构建功能性纳米材料,理解生命现象,攻克疑难疾病等具有十分重要的意义。目前,多肽的自组装已取得了长足的发展,主要是基于α-螺旋,β-折叠,β-发夹,类脂质体多肽以及含芳香基团多肽在特殊环境或刺激下的自组装行为的研究。这些多肽材料能够组装成诸如纳米纤维,纳米管,纳米带,纳米球以及宏观的水凝胶支架材料等,并具有一定的刺激响应性能[7-11]。然而在生理pH下,多肽的自组装行为研究甚少,相比之下,生理pH下的多肽自组装纳米材料在生物医学领域更具应用前景。
本文设计了3种含阳离子的小分子硼酸肽,在生理pH下,这些小分子硼酸肽能够自组装形成超分子聚集体。利用苯硼酸与邻二羟基化合物特异性,结合形成五元环的硼酸酯结构[12-13],茜素红(一种邻二酚染料)可进一步调控小分子硼酸肽的自组装行为。茜素红能够与苯硼酸迅速结合,并伴随颜色和荧光性能的显著变化[14]。硼酸酯的形成,在一定程度上改变了硼酸肽的分子性质和构象,并提供新的自组装驱动力,将诱导新的组装机理和新的超分子纳米组装体的产生。
2 实验
2.1 硼酸肽(BPs(1-3))的合成
3种含精氨酸的硼酸肽(BPs(1-3))通过标准FMOC化学固相多肽合成法合成,固相载体采用酸敏感的二氯三苯甲基氯树脂(DVB为1%,SD为1.08 mmol/g)[15]。具体合成策略简述如下:取1.0 g树脂于固相合成柱中(Sigma-Aldrich Filtration),分别用二氯甲烷(DCM)和N,N-二甲基甲酰胺(DMF)洗涤两次,排出溶剂,用DMF溶胀1 h,排出溶剂。向反应器中加入氨基以及侧基的胍基分别被9-芴甲氧羰基(FMOC)和2,2,4,6,7-五甲基-2H-苯并呋喃-5-磺酰基(Pbf)保护的精氨酸(FMOC-Arg(Pbf)-OH)和二异丙基乙胺(DIEA)的DMF溶液,搅拌反应1.5 h,排出反应液,并用DMF洗涤。然后加入20%哌啶/DMF(体积比)溶液反应20 min,脱除氨基端的FMOC保护基,并用DMF洗涤。加入氨基被9-芴甲氧羰基(FMOC)保护的缬氨酸(FMOC-Val-OH),O-(1H-苯并三唑-1-基)-N,N,N,N'-四甲基脲六氟磷酸盐(HBTU),1-羟基苯并三唑(HOBt)和二异丙基乙胺(DIEA)的DMF溶液,搅拌反应1.5 h,排出溶剂,用DMF洗涤。重复以上脱保护、缩合步骤延长肽链。最后,用DMF,甲醇和DCM分别洗涤树脂,真空干燥24 h,然后加入切落剂(体积比为82.5%三氟乙酸,2.5%乙二硫醇,6%苯酚,4.5%苯甲硫醚、4.5%水)反应1.5 h,收集滤液及洗涤液,旋蒸浓缩后滴加到冷乙醚中得到白色沉淀,抽滤洗涤得到白色固体粉末,粗产品经低温冷冻干燥待用。
2.2 硼酸肽(BPs(1-3))的分子量鉴定
将硼酸肽溶于DMF/甲醇溶液中,配成0.5 mg/mL的溶液,用毛细管电泳电喷雾质谱(CE-ESI-MS,LCQ Advantage,Finigan,USA)检测其分子量,鉴证其结构的正确性。
2.3 硼酸肽自组装溶液的制备
将硼酸肽溶于pH为7.4的磷酸盐缓冲溶液中,配成1 mmol/L的自组装溶液,静置待用;另外向上述溶液中加入等摩尔量的茜素红(ARS)粉末,轻微摇荡后,静置。数小时后,上述自组装溶液即可进行后续的实验和表征。
2.4 紫外可见光谱和荧光发射光谱表征
将上述自组装溶液稀释到0.5 mmol/L,用紫外可见分光光度计(UV-vis,PERKIN-ELMER,USA)检测其在380-650 nm波段内的紫外可见吸收;用LS55荧光分光光度计(PERKIN-ELMER,USA)检测其在500~700 nm的荧光发射光谱,检测的发射波长为495 nm。
2.5 硼酸肽自组装形貌观察
将1 mmol/L硼酸肽自组装溶液滴在干净的硅玻璃片上,自然晾干后,用SEM观察其微观自组装形貌,扫描电压为30 kV。
2.6 圆二色谱和傅里叶变换红外光谱表征
将0.5 mmol/L的自组装溶液置于5 mm的石英样品池中,用圆二色谱仪检测其紫外吸收,考察自组装形态中硼酸肽分子的空间排列,检测范围为190~350 nm。将1 mmol/L的自组装溶液用液氮极速冷冻,低温冷冻干燥后,与KBr研磨压成片,用傅里叶变换红外光谱(FTIR)检测多肽自组装过程中形成的二级结构。
3 结果与讨论
3.1 硼酸肽的合成与性质
3种含精氨酸硼酸肽采用标准FMOC化学固相多肽合成法合成,其结构如图1a所示。
质谱结果显示3种多肽均呈现单一的离子峰,数据如表1所示,检测值分别为BP1,606.4(M+H++14);BP2,889.4(M+H++14);BP3,622.4(M+2H++14)/2,说明3种硼酸肽分子结构是正确的,且基本上无杂质。质谱中出现的分子量多14的现象,主要是由于硼酸基团在特殊条件下易与羟基化合物反应,致使低沸点的甲醇在电喷雾过程中与之结合并失去一分子水造成的。在生理pH(PBS 7.4缓冲溶液)下,邻二羟基酚染料茜素红可与苯硼酸特异性结合形成五元环硼酸酯化合物,并且茜素红的颜色和荧光会发生显著变化。结合这一特性,硼酸肽的自组装可进一步通过茜素红来调控。如图1(b)所示,在生理pH条件下,硼酸肽与茜素红通过配位作用形成茜素红/硼酸肽化合物,茜 素红溶液由最初的酒红色转变成黄色。

图1 (a)硼酸肽BPs(1-3)化学结构,(b)硼酸肽与茜素红的反应示意图,(i)1 mmol/L ARS溶液,(ii)与硼酸肽反应后溶液Fig.1 (a)Chemical structures of three borono-peptides(BPs(1-3))and(b)schematic illustration of reaction of BPs with ARS,(i)1 mmol/L ARS solution,(ii)solution after reaction of BPs with ARS
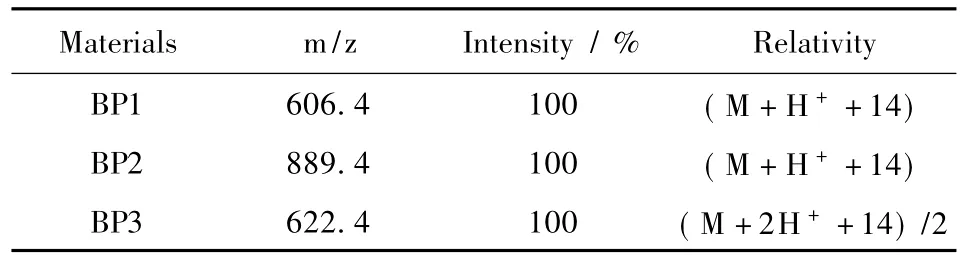
表1 3种硼酸肽(BPs(1-3))的电喷雾质谱Table 1 ESI-MS analysis of three borono-peptides(BPs(1-3))
紫外可见光谱和荧光发射光谱(图2)亦显示,3种硼酸肽均与茜素红有较强的结合能力,紫外吸收发生明显的蓝移,从原来的518 nm分别迁移到462 nm(BP1),467 nm(BP2)和469 nm(BP3)(图2a)。3种硼酸肽配位后蓝移显示的细微差别可能是由于茜素红/硼酸肽化合物不同的自组装聚集体引起的部分红移造成的。这一现象同样也体现在荧光发射光谱中,3种硼酸肽的荧光发射强度有明显的差别且呈现略微的红移(图2b)。这在一定程度上也说明了3种茜素红/硼酸肽化合物形成了不同的超分子聚集体。

图2 茜素红与硼酸肽反应前后的紫外吸收光谱(a)和荧光发射光谱(b)Fig.2 UV-vis(a)and fluorescent(b)spectra of before and after reaction of BPs(1-3)with ARS
3.2 硼酸肽的自组装形貌
3种含精氨酸硼酸肽在pH=7.4的磷酸盐缓冲溶液中组装成不同的超分子聚集体。通过SEM观察发现(图3):BP1在硅玻璃片上铺成了一层致密的膜结构(图3a);BP2自组装形成了直径约为40 nm的簇状纳米棒(图3b);而BP3自组装形成了长约1.4 μm,直径约为90 nm的规则纳米棒,且这些纳米棒呈一定的空间生长趋势(图3c)。通过加入茜素红进一步调控其自组装,我们发现:3种茜素红/硼酸肽化合物的自组装形态均发生了较大的变化。BP1致密的膜结构转变成了粒径约30~40 nm的纳米粒子堆积而成的膜结构(图3d);BP2的簇状纳米棒生长成了枝化的纤维结构,可以明显的看出纤维产生了分支以及粗细之分(图3e);而BP3定向生长的纳米棒,则发展成枝化状定向排列的细小纳米棒,此纳米棒是由20~30 nm的纳米粒子连接而成的约200 nm长的有序结构(图3f)。以上结果说明,含阳离子的硼酸肽在生理pH下具有一定的自组装能力,视其结构的协调性,可形成不同的超分子纳米聚集体;而茜素红的调控可以改变硼酸肽的结构性质和协调性,诱导形成新的超分子聚集体。

图3 3种硼酸肽BPs(1-3)自组装超分子纳米结构(a-c)及经茜素红调控后的BPs(1-3)自组装超分子纳米结构(d-f)的SEM像Fig.3 SEM images of self-assembled BPs(1-3)(a-c)and self-assembled BPs(1-3)recognized with ARS(d-f)
3.3 自组装机理探讨
多肽的自组装是通过多种非共价键的协同作用进行分子的有序堆积或组装,形成特定结构的超分子聚集体。其中,多肽所采取的二级结构构象对于自组装的发生和结果,有着至关重要的影响。因此,通过圆二色谱和傅里叶变换红外光谱检测多肽的二级结构,可以进一步探讨硼酸肽的自组装机理。圆二色谱的测试结果如图4a~c所示,BP1在204 nm及219 nm附近有负的特征吸收谱带,说明BP1所采取的构象是α-螺旋和无规卷曲的二级结构;加入茜素红后,204 nm处负的特征吸收峰迁移到208 nm,表现为典型的α-螺旋的特征吸收峰,说明ARS/BP1主要是以α-螺旋构象存在的。这一结果可能是茜素红上的磺酸基离子与精氨酸侧基上氨基离子的静电作用,有利于α-螺旋的分子内氢键的形成。BP2在195 nm处的正吸收峰及221 nm处的负吸收峰,是典型的β-折叠构象,而205 nm处的负吸收峰表明有部分无规卷曲的结构存在。由于精氨酸之间的静电斥力及疏水氨基酸的空间效应,BP2趋向于形成β-折叠结构;加入茜素红后,其吸收峰迁移至200 nm和219 nm的负吸收谱带,即表明BP2由β-折叠转变成无规卷曲结构,这一转变可能是由茜素红上的磺酸基离子与精氨酸侧基上氨基离子的静电作用引起的。BP3在200 nm处呈现负的吸收峰,是无规卷曲的构象,这是由多个精氨酸侧基上阳离子的静电斥力以及多个疏水氨基酸的空间效应引起的。形成ARS/BP3后,其吸收峰迁移到205 nm和214 nm处的负吸收谱带,说明键合茜素红后其构象向α-螺旋和β-折叠转变,其结果可能是磺酸基离子与精氨酸侧基上氨基离子的静电作用引起的。
从图4d~f的傅里叶红外光谱可以看出,硼酸及茜素红键合后的衍生物在自组装过程中形成的二级结构。BP1在1 645 cm-1的特征吸收是无规卷曲的构象,而1 654~1 670 cm-1的坡峰则是α-螺旋和无规卷曲的共同结果。键合茜素红后,其红外吸收显示为一肩峰(1 645~1 660 cm-1),也表明ARS/BP1主要是以α-螺旋构象存在的。BP2在1 637 cm-1的特征吸收是典型的β-折叠结构,形成ARS/BP2后,出现了两个特征吸收(1 635 cm-1和1 680 cm-1),表明形成纤维的硼酸肽分子可能是以反平行 β-折叠进行组装的。BP3在1 647 cm-1的红外吸收显示为无规卷曲结构,键合茜素红后其红外吸收略有偏移,向β-折叠转移。

图4 3种硼酸肽(BPs(1-3))及经茜素红调控后的自组装超分子纳米结构的圆二色谱(a-c)和傅里叶远红外光谱(d-f)Fig.4 CD(a-c)and FTIR(d-f)analyses of self-assembed BPs(1-3)and self-assembed BPs(1-3)recognized with ARS
综上分析,3种含精氨酸的硼酸肽由于阳离子残基的相互作用以及疏水氨基酸的空间效应等,可通过不同的二级结构组装形成一定的超分子纳米聚集体。而且,由于硼酸基团具有一定的自聚能力,因而在一定程度上可以形成BP1的膜结构,BP2的簇状结构以及BP3的定向生长结构。通过茜素红进一步调控其自组装,一方面引入了共轭π电子体系,改变了分子的亲疏水性,并提供π电子堆叠作用;另一方面,磺酸基负离子与多肽片段中的氨基离子的静电作用对多肽的二级结构也产生一定的影响,进而影响其自组装行为。在上述多重因素的影响下,茜素红/硼酸肽化合物可自组装形成更加有序或更精致的超分子纳米材料。
4 结论
利用固相多肽合成法合成了3种含精氨酸的小分子硼酸肽,它们在生理pH下,均可自组装形成不同的超分子纳米组装体。通过引入茜素红,改善了硼酸肽的荧光性能,同时进一步调控了其自组装行为。3种硼酸肽及其茜素红衍生物,是通过不同的二级结构进行自组装的,硼酸肽的分子结构及调控因子的分子构造对其自组装行为有重要的影响。鉴于多肽材料良好的生物相容性、多种功能性序列和优越的自组装性能,可调控的硼酸肽自组装纳米材料,在生物医学领域,如酶抑制剂,中子捕获剂,药物控释系统和多糖感应器等,有着广泛的应用前景。
References
[1]Israelachvili J N,Mitchell D J,Ninham B W.The Theory of Self-Assembly of Hydrocarbon Amphiphiles into Micelles and Bilayers[J].Journal of the Chemical Society,1976,72:1 525 -1 568.
[2]Dietz H,Douglas S M,Shih W M.Folding DNA into Twisted and Curved Nanoscale Shapes[J].Science,2009,325(5 941):725 -730.
[3]Zelzer M,Ulijn R V.The Next-Generation Peptide Nanomaterials:Molecular Networks,Interfaces and Supramolecular Functionality[J].Chemical Society Review,2010,39(9):3 351-3 357.
[4]Boyle A L,Woolfson D N.De Novo Designed Peptides for Biological Applications[J].Chemical Society Review,2011,40(8):4 295 -4 306.
[5]Gazit E.The Self-Assembled Peptide Nanostructures:the Design of Molecular Building Blocks and Their Technological Utilization[J].Chemical Society Review,2007,36(8):1 263-1 269.
[6]Adamcik J,Jung J M,Flakowski J,etal.Understanding Amyloid Aggregation by the Statistical Analysis of Atomic Force Microscopy Images[J].Nature Nanotechnology,2010,5(6):423 -428.
[7]Banwell E F,Abelardo E S,Adams D J,etal.Rational Design and Application of Responsive a-Helical Peptide Hydrogels[J].Nature Materials,2009,8(7):596 -600.
[8]Xu X D,Chen C S,Zhang X Z,etal.Coassembly of Oppositely Charged Short Peptides into Well-Defined Supramolecular Hydrogels[J].Journal of Physical Chemistry B,2010,114(7):2 365-2 372.
[9]KretsingerJ K,Haines L A,Ozbas B,etal.Cytocompatibility of the Self-Assembled Beta-Hairpin Peptide Hydrogel Surfaces[J].Biomateri-als,2005,26(25):5 177 -5 186.
[10]Chen J X,Wang H Y,Zhang X Z,etal.Construction of Surfactant-Like Tetra-Tail Amphiphilic Peptide with RGD Ligand for Encapsulation of Porphyrin for the Photodynamic Therapy[J].Biomaterials,2011,32(6):1 678-1 684.
[11]Adler-AbramovichL,Aronov D,Gazit E,etal.Self-assembled Arrays of Peptide Nanotubes by Vapour Deposition[J].Nature Nanotechnology,2009,4(12):849-854.
[12]Jams T D,Samankumara K R A,Shinkai S.Saccharide Sensing with Molecular Receptors Based on Boronic Acid[J].Angewandte Chemie-International Edition,1996,35(17):1 910-1 922.
[13]Xu X D,ChuY F,Chen C S,etal.Facile Construction of Nanofibers as a Functional Template for Surface Boron Coordination Reaction[J].Small,2011,7(15):2 201 -2 209.
[14]Springsteen G,Wang B H.Alizarin Red S as a General Optical Reporter for Studying the Bindingof Boronic Acids with Carbohydrates[J].Chemical Communication,2001,(17):1 608-1 609.
[15]Chen C S,Ji T J,Zhang X Z,etal.Nanofibers Self-Assembled from Structural Complementary Borono-Decapeptides[J].Macromolecular Rapid Communication,2010,31(21):1 903-1 908.
Self-Assembly of Oligo-Borono-Peptides
CHEN Changsheng,LI Shiying,WANG Jun,ZHANG Xianzheng,ZHUO Renxi
(Key Laboratory of Biomedical Polymers of Education Ministry,College of Chemistry and Molecular Sciences,Wuhan University,Wuhan 430072,China)
Three arginine-containing oligo-borono-peptides(BPs(1-3))were synthesized by employing a standard FMOC chemistry SPPS.BPs(1-3)could spontaneously self-assemble into supramolecular architectures at a physiological environment.With recognition between BPs and alizarin red S(ARS),the five-membered ring borate esters(ARS/BPs)could be formed with dramatic changes in fluorescent feature and visible color.These self-assembled supramolecular architectures were observed by scanning electron microscope(SEM)and their self-assembly mechanisms were explored by Fourier Transform Infrared Spectroscopy(FT-IR)and Circular Dichroism(CD).It was found that BPs were capable of selfassembling into well-ordered supramolecular architectures,and after recognition of ARS,ARS/BPs could further self-assemble into more ordered and sophisticated supramolecular architectures.
borono-peptide;self-assembly;supramolecular architecture;nanomaterial
R318.08
A
1674-3962(2012)06-0049-06
2012-04-01
科技部973计划项目 (2011CB606202),基金委面上项目(20974083),中央高校基本科研业务费专项资金资助项目(201120302020004)
陈昌盛,男,1984年生,博士研究生
张先正,男,1971年生,教授,博士生导师

