51例新生儿脐带血单纯疱疹病毒的检测
任鹏,姚娟,金艳,李法锦,汪晓婷,葛俊,江龙凤,赵蕾,吉阳,王明丽
1. 安徽医科大学微生物学教研室,合肥 230032; 2. 合肥市妇幼保健院,合肥 230001
单纯疱疹病毒(herpes simplex virus,HSV)属α疱疹病毒,直径110~120 nm,基因组为双链DNA,约150 kb。根据血清型,分为HSV-1和HSV-2,两者均可引起新生儿感染。孕早期感染HSV者因胚芽受破坏而流产;妊娠中、晚期感染者虽少发畸胎,但可引起胎儿和新生儿发病。孕期2种感染形式均可影响胎儿,特别是孕早期和分娩时首次感染可通过胎盘传播给胎儿。妊娠前20周首次感染可导致自然流产、死产和胎儿先天性畸形,特别是小头畸形、脑积水;妊娠中、晚期首次感染主要导致胎儿宫内发育迟缓[1]。因此,了解新生儿HSV感染情况,对指导新生儿HSV感染所致疾病的预防和治疗具有重要意义。本研究采集了合肥地区51例新生儿脐带血,通过套式聚合酶链反应(polymerase chain reaction,PCR)检测特异性HSV-1 gD基因和HSV-2 gG基因。PCR阳性扩增产物经测序后,通过美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)在线工具BLAST进行序列比对,确认HSV-1、HSV-2阳性标本,分析51例新生儿脐带血HSV感染情况。
1 材料和方法
1.1 研究对象
2010年11月~2011年6月,于某地妇幼保健院采集健康产妇顺产新生儿抗凝脐带血51份。
1.2 病毒株
HSV-1(F株)、HSV-2(Sav株)标准株[2]均为本室保存,用作阳性对照。
1.3 仪器和试剂
全血DNA抽提试剂盒购自北京索莱宝公司;DNA IQTMSystem-Small Sample Casework Protocol试剂盒购自Promega公司;试剂购自TaKaRa公司;梯度PCR仪为Biometra 公司产品。应用Gel Documentation System (Biosens SC 720)凝胶成像系统观察记录结果。引物合成和DNA测序均由上海Invitrogen公司完成。
1.4 实验方法
1.4.1标本采集新生儿脐带血无菌采自脐带近婴儿段,用医用无菌肝素抗凝管收集,每管3 ml。采集后,冰盒送实验室用于检测。
1.4.2DNA提取应用北京索莱宝公司全血DNA抽提试剂盒提取新生儿脐带血DNA,-20 ℃保存。抽提方法为DNA柱吸附洗脱法,操作按试剂盒详细说明进行。
1.4.3套式PCR检测新生儿脐带血HSVDNA特异性HSV-1 gD基因和HSV-2 gG基因套式PCR引物参考Lewensohn-Fuchs等[3]设计及使用(表1)。PCR反应体系为:10×Buffer 5 μl,2.5 mmol/L dNTP 4 μl,上下游引物80 pmol,Taq酶0.5 μl,DNA模板2 μl,用无菌去离子水补足50 μl。每次实验均设阴性对照(不加模板)。反应体系的配制、分装在超净工作台内进行。HSV套式PCR反应条件均为94 ℃预变性5 min、94 ℃变性30 s、57 ℃退火30 s、72 ℃延伸30 s、72 ℃终延伸10 min,外侧引物PCR 30个循环,内侧引物PCR 35个循环。PCR反应完成后,取5 μl产物用于2%琼脂糖凝胶电泳,并通过凝胶成像系统观察记录。阳性扩增产物测序后,通过NCBI在线工具BLAST进行序列比对。
1.5 统计学分析
使用SPSS 17.0进行统计学分析,计数资料采用χ2检验,P<0.05为有统计学意义。

表1 HSV套式PCR引物序列Tab.1 HSV nested-PCR primers
2 结果
2.1 新生儿脐带血HSV-1和HSV-2的检测
采集健康产妇顺产新生儿抗凝脐带血51份,应用HSV-1 gD基因特异性套式PCR引物检测标本,其中扩增阳性标本12份(图1A)。经测序并比对,发现扩增产物大小与引物设计大小一致,且均为HSV-1特异性产物。因此,51份脐带血标本中,HSV-1阳性率为23.53%,表明HSV-1感染率为23.53%(表2)。 应用HSV-2 gG基因特异性套式PCR引物检测51份脐带血标本,其中扩增阳性标本13份(图1B)。经测序并比对,发现扩增产物大小与引物设计大小一致,且均为HSV-2特异性产物。因此,51份脐带血标本中,HSV-2阳性率为25.49%,表明HSV-2感染率为25.49%。51份标本中,HSV-1和HSV-2共阳性标本4份,共感染率为7.84%。
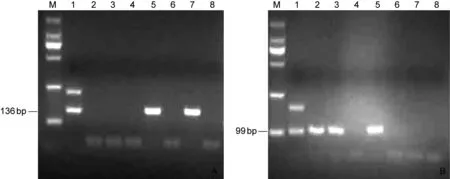
M: marker DL2000; Lane 1: positive control; Lanes 2-7 specimens; Lane 8: negative control.

表2 新生儿脐带血HSV-1和HSV-2的检测Tab.2 Detection of HSV-1 and HSV-2 in neonatal cord blood
2.2 新生儿脐带血HSV-1和HSV-2感染率比较
51例新生儿脐带血HSV-2感染率略高于HSV-1,无统计学差异(表3)。

表3 51例新生儿脐带血中HSV-1和HSV-2检出率的比较Tab.3 Comparison of detection rate of HSV-1 and HSV-2 in neonatal cord blood
3 讨论
HSV先天性感染是导致新生儿出生缺陷的重要因素之一。有学者总结了30例先天性HSV感染患儿的临床特征,其中85%为低出生体重儿,36%为小于胎龄儿,67%有小头畸形、惊厥、弥散性脑损害、颅内钙化灶,57%有脉络膜视网膜炎、眼过小[3]。
新生儿HSV感染后早期临床表现多不典型,易误诊而延误治疗,因此实验室检测具有重要的诊断参考价值[4]。实验室诊断主要技术为病毒分离、培养及鉴定、PCR检测病原体DNA,以及特异性抗体检测。病毒分离、培养是实验室诊断的“金标准”,但耗时长,作为临床快速检测方法有一定缺陷。HSV特异性抗体检测可诊断新生儿HSV感染,但血清HSV IgG及IgM 抗体检测存在以下问题。(1)母亲经胎盘传递的IgG抗体影响结果判断。(2)特异性HSV IgM抗体在发病后2周才产生,达不到早期诊断的目的[5,6]。目前,PCR广泛应用于病原学检测,已成功用于脑脊液和血液中HSV DNA的检测[7],使早期确诊、及时治疗成为可能。PCR扩增标本中的HSV DNA并测序,可确定标本中是否有HSV,是一种比较准确、有效的方法[8]。但在操作过程中易污染,结果需慎重对待。
HSV-1 US6编码gD糖蛋白。gD糖蛋白能与HveA、nectin 1和修饰后的硫酸肝素这3种细胞受体结合,从而决定病毒的细胞嗜性。HSV-2 US4编码gG糖蛋白。gG糖蛋白为属特异性糖蛋白,其抗体可用于HSV分型。HSV-1 gD基因和HSV-2 gG基因均为病毒晚期基因,在病毒DNA复制起始后,表达水平显著升高[9],检测到晚期基因表达即可判断病毒感染为活动性感染。因此,本研究分别选择HSV-1gD基因和HSV-2gG基因作为套式PCR检测的病毒基因。
新生儿HSV感染的获得途径主要有3种:宫内感染、产时感染和产后感染[10]。在胎儿生长、发育过程中,物质通过胎盘进行交换,为胎儿生长、发育提供支持。胎盘内有母体和胎儿2套血液循环系统。母体动脉血经子宫螺旋动脉流入绒毛间隙,在此与绒毛内血管的胎儿血进行交换后,经子宫静脉流回母体。胎儿静脉血经脐动脉及其分支流入绒毛毛细血管,与绒毛间隙内的母体血进行物质交换后,经脐静脉回流至胎儿。母体和胎儿的血液在各自封闭管道内循环,进行物质交换,但互不相混。因此一般认为,脐带血检测能直接、准确反映新生儿血液中是否存在HSV;如检测到HSV,可认为新生儿HSV感染可能为垂直传播[11,12]。
O’Riordan和Whitley等报道,美国新生儿HSV感染的发病率高,占新生婴儿的1/5 000~1/3 500,每年大约有1 500名新生儿感染HSV。其他国家发病率略低,英国为1/6 500,瑞典为1/15 000,日本为1/17 000[13,14]。Brown等通过HSV分离方法检测202例新生儿,报道新生儿HSV感染率为5%(10/202)[15]。Kropp和Whitley等报道新生儿HSV宫内感染率为5%~9%[16,17]。Shyamala等报道在先天性白内障新生儿中HSV感染率为18%[18]。
本次研究发现 51份脐带血中HSV-1阳性12份,感染率23.53%;HSV-2阳性13份,感染率25.49%;HSV-1和HSV-2共阳性4份,共感染率7.84%。
本研究中,新生儿HSV感染率高于国外报道,可能原因如下。(1)标本例数过少和地域差异,需在以后工作中扩大筛查量。(2)套式PCR反应较敏感,且标本采集时如不谨慎操作可导致标本污染,有可能出现假阳性。因此,在以后工作中,除应增加标本量外,还应对新生儿及产妇进行HSV特异性抗体检测,以分析获得新生儿HSV感染率的准确数据。鉴于我国尚无针对新生儿HSV先天感染率的准确数据报道,本研究有利于提高临床工作者对新生儿HSV感染疾病预防和治疗的重视度,开展调查及加强早期诊断和治疗。
[1] Whitley RJ, Kimberlin DW, Roizman B. Herpes simplex virus [J]. Clin Infect Dis,1998, 26 (3): 541-555.
[2] 陈伟,刘晓静,王明丽. 病毒性脑炎患儿脑脊液病毒核酸检测及临床分析[J]. 中华疾病控制杂志,2009, 13(3):279-283.
[3] Lewensohn-Fuchs I, Osterwall P, Forsgren M, Malm G. Detection of herpes simplex virus DNA in dried blood spots making a retrospective diagnosis possible [J]. J Clin Virol, 2003, 26 (1):39-48.
[4] Owen WE, Martins TB, Litwin CM, Roberts WL. Performance characteristics of six IMMULITE 2000 TORCH assays [J]. Am J Clin Pathol, 2006, 126 (6): 900-905.
[5] Stanberry LR, Cunningham AL, Mindel A, Scott LL, Spruance SL, Aoki FY, Lacey CJ. Prospects for control of herpes simplex virus disease through immunization [J]. Clin Infect Dis, 2000, 30(3): 549-566.
[6] Rouse DJ, Stringer JS. An appraisal of screening for maternal type-specific herpes simplex virus antibodies to prevent neonatal herpes [J]. Am J Obestet Gynecol, 2000, 183(2): 400-406.
[7] Thompson C, Whitley R. Neonatal herpes simplex virus infections: where are we now [J]? Adv Exp Med Biol, 2011, 697: 221-230.
[8] Stellrecht KA. Nucleic acid amplification technology for the diagnosis of genital herpes infection [J]. Expert Rev Mol Diagn, 2004, 4(4): 485-493.
[9] Knipe DM, Howley PM, Griffin DE, Lamb RA, Martin MA, Roizman B, Straus SE. Fields Virology [M]. 5th ed. Philadelphia: Lippincott Williams & Wilkins, 2007, 2521-2527.
[10] White JC, Magee SR. Neonatal herpes infection: case report and discussion [J]. J Am Board Fam Med, 2011, 24(6): 758-762.
[11] 张睿,刘新质.孕妇巨细胞病毒感染及其宫内传播的探讨[J].中华实用妇科与产科杂志,1999, 15(3):166-169.
[12] 付锦华,管立学,徐大风.孕妇血清中人类巨细胞病毒DNA含量与胎儿宫内感染的关系[J].中国优生与遗传杂志,2004,12(4):74-75.
[13] O’Riordan DP, Golden WC, Aucott SW. Herpes simplex virus infections in preterm infants [J]. Pediatrics, 2006, 118(6): e1612-e1620.
[14] Whitley RJ, Lakeman F. Herpes simplex virus infections of the central nervous system: therapeutic and diagnostic considerations [J]. Clin Infect Dis, 1995, 20(2): 414-420.
[15] Brown ZA, Wald A, Morrow RA, Selke S, Zeh J, Corey L. Effect of serologic status and cesarean delivery on transmission rates of herpes simplex virus from mother to infant [J]. J Am Med Assoc, 2003, 289(2): 203-209.
[16] Kropp RY, Wong T, Cormier L, Ringrose A, Burton S, Embree JE, Steben M. Neonatal herpes simplex virus infections in Canada: results of a 3-year national prospective study [J]. Pediatrics, 2006, 117 (6): 1955-1962.
[17] Whitley R, Arvin A, Prober C, Corey L, Burchett S, Plotkin S, Starr S, Jacobs R, Powell D, Nahmias A, Sumaya C, Edwards K, Alford C, Caddell G, Soong SJ, the National Institute of Allergy and Infectious Diseases Collaborative Antiviral Study Group. Predictors of morbidity and mortality in neonates with herpes simplex virus infections [J]. N Engl J Med, 1991, 324(7): 450-454.
[18] Shyamala G, Sowmya P, Madhavan HN, Malathi J. Relative efficiency of polymerase chain reaction and enzyme-linked immunosorbant assay in determination of viral etiology in congenital cataract in infants [J]. J Postgrad Med, 2008, 54(1): 17-20.

