去卵巢对Wistar大鼠MSCs的形态学、生长曲线及骨/脂向分化能力的影响
王 艳,李遇伯,李 晶,周 鹏,毕月玲,陈学艳
(1.天津中医药大学中药学院 天津市中药化学与分析重点实验室,天津 300193;2.天津中医药大学第一附属医院,天津 300193)
骨髓间充质干细胞(mesenchymal stem cells,MSCs)是在骨髓中发现的一种起源于中胚层,具有自我复制和多向分化潜能的非造血干细胞[1]。其在不同的诱导条件下,能分化成成骨细胞[2]、软骨细胞[3]、脂肪细胞[4]等中胚层组织。越来越多的研究发现各种原因(如衰老、骨质疏松)引起的骨量减少往往是和骨髓中的脂肪组织增多伴行的,因此人们开始关注MSCs参与的成骨减少和成脂肪增多所引起的骨质疏松[5]。本实验采用双侧卵巢切除法复制骨质疏松症(osteoporosis,OP)大鼠模型,比较了正常和OP大鼠MSCs的形态学、生长曲线、骨向和脂向分化能力的差异,从MSCs角度阐释OP后机体内的病理学变化,为以MSCs为平台,研究OP提供实验依据。
1 实验材料
1.1 实验动物 6月龄雌性Wistar大鼠(中国人民解放军军事医学科学院实验动物中心提供)。
1.2 主要试剂 α-MEM培养基(Gibeo),胎牛血清(Hyclone),胰蛋白酶、乙二胺四乙酸二钠(EDTA)、噻唑兰(MTT)(上海生工),地塞米松、β-甘油磷酸钠、VitC、吲哚美辛、牛胰岛素、异丁基黄嘌呤(Sigma),巴比妥钠、油红O染料(北京索莱宝),Ficoll(GE Healthcare)。
1.3 诱导液配制
1.3.1 成脂诱导液 α-MEM+10 mL/dL胎牛血清(含100 U/mL青、链霉素)+10 μmol/L胰岛素+1 μmol/L地塞米松+0.5 mmol/L异丁基黄嘌呤(IBMX)+100 μmol/L吲哚美辛。
1.3.2 成骨诱导液 α-MEM+10 mL/dL胎牛血清(含100 U/mL青、链霉素)+0.1 μmol/L地塞米松+10 mmol/L β-甘油磷酸钠+50 μmol/L维生素C。
1.3 主要仪器 CO2培养箱(Thermo),TS100型倒置相差显微镜(NiKon),超净工作台(苏州佳宝净化),TECAN infinite M200型酶标仪(TECAN)。
2 方法
2.1 动物模型与分组 12只6月龄Wistar雌性大鼠随机分成模型组和假手术组,每组6只,模型组双侧卵巢切除法复制大鼠OP模型,假手术组大鼠找到卵巢后不切除。术后连续肌注青霉素3 d,5万U/只。普通饲料饲养,自由饮水,增龄3个月。
2.2 MSCs的分离与培养 大鼠麻醉后颈椎脱臼处死,无菌条件下剥离胫、股骨,用完全培养液反复冲洗骨髓腔,所得单细胞悬液接种于塑料培养瓶中培养。原代MSCs培养7~10 d后传代,之后培养3~5 d按1∶2比例传代。
2.3 MSCs细胞表面标志物的鉴定 取P3代MSCs,经0.25%胰酶+0.02%EDTA消化后,制成单细胞悬液。以3×104Cells/mL接种于6孔板中。2 d后取出,PBS洗涤3次,4%多聚甲醛固定30 min,PBS洗涤3次,山羊血清37 ℃孵育30 min,加入一抗4 ℃孵育过夜,选用非相关IgG抗体作为阴性对照。PBS洗涤3次后,加入二抗37 ℃孵育60 min,PBS洗3次,SABC反应液37 ℃孵育60 min,PBS洗3次,DAB显色后立即于显微镜下观察。蒸馏水洗,苏木素复染,脱水,透明,封片。
2.4 正常与OP大鼠MSCs生物学特性的比较
2.4.1 形态学 采用倒置相差显微镜,观察并比较正常与OP大鼠MSCs的形态学差异。
2.4.2 MTT法检测生长曲线 分别取正常与OP大鼠P3代MSCs,以2.0×103cells/mL接种到96孔板中,每孔终体积200 μL,从接种后的第1天起进行MTT测定,每天测1板。均设6个复孔。各组同时培养达4 h后,测定各孔吸光度值。测量波长为570 nm。
2.5 有及无诱导条件下正常与OP大鼠MSCs多向分化能力的比较
2.5.1 分组 正常组(正常大鼠MSCs未加诱导条件),OP组(OP大鼠MSCs未加诱导条件),正常诱导组[正常大鼠MSCs+成骨(成脂)诱导液],OP诱导组[OP大鼠MSCs+成骨(成脂)诱导液]。
2.5.2 骨向分化ALP染色比较 正常及OP大鼠P3代MSCs分别以1×105Cells/mL接种于预先置有无菌盖玻片的6孔板中,按2.5.1分组,分别培养。14 d后取出相应玻片进行ALP染色,光镜下观察,比较。
2.5.3 脂向分化油红O染色比较 正常及OP大鼠P3代MSCs分别以1×105Cells/mL接种于预先置有无菌盖玻片的6孔板中,按2.5.1分组,分别培养。18 d后取出相应玻片进行油红O染色,光镜下观察,比较。
3 结果
3.1 免疫组化染色检测MSCs表面抗原 免疫组化染色鉴定结果显示MSCs细胞呈CD29、CD44阳性,胞浆染色呈棕黄色(图1、2);CD34、CD45阴性(图3、4)。

图1 CD29

图2 CD44
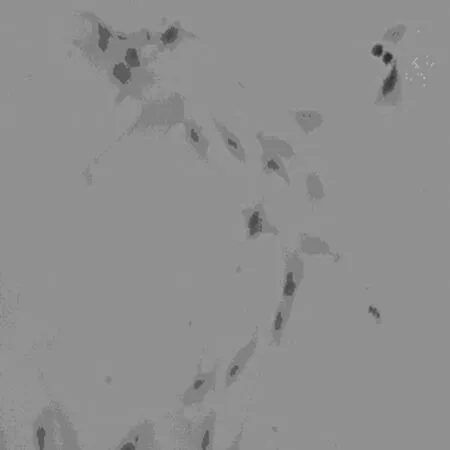
图3 CD34

图4 CD45
3.2 正常与OP大鼠MSCs形态学观察 采用倒置相差显微镜观察2组细胞的生长状态,经传代,正常大鼠MSCs还呈比较典型的集落方式生长,细胞为长梭形(图5a)。而OP大鼠MSCs的增殖速度减慢,细胞形态宽大、扁平,可见少量脂肪细胞(图5b)。
3.3 正常与OP大鼠MSCs生长曲线 从图6可以看出,接种后所测得的生长曲线均呈S形。细胞接种后1~4 d OD值变化不大,到第4天OD值开始明显增加,OD值于第7天达到顶点,随后有减小的趋势。对比正常组与OP组大鼠MSCs生长曲线,二者增殖趋势基本相同,且符合细胞生长规律。但是在增殖能力上OP大鼠MSCs较正常组降低,经配对样本t检验,t=3.316,df=8,P=0.011<0.05,二者差异具有统计学意义。
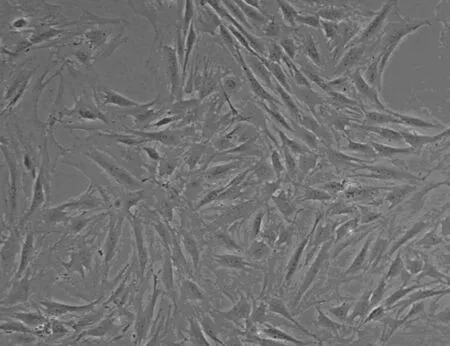
图5a 正常大鼠P3代第5dMSCs(100×)
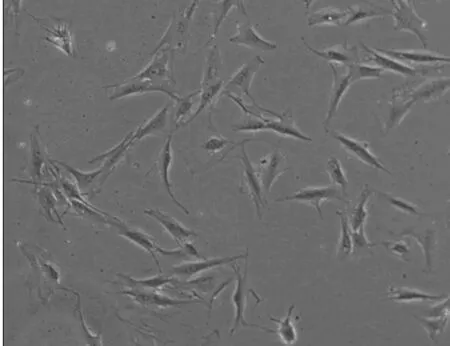
图5b OP大鼠P3代第5dMSCs(100×)
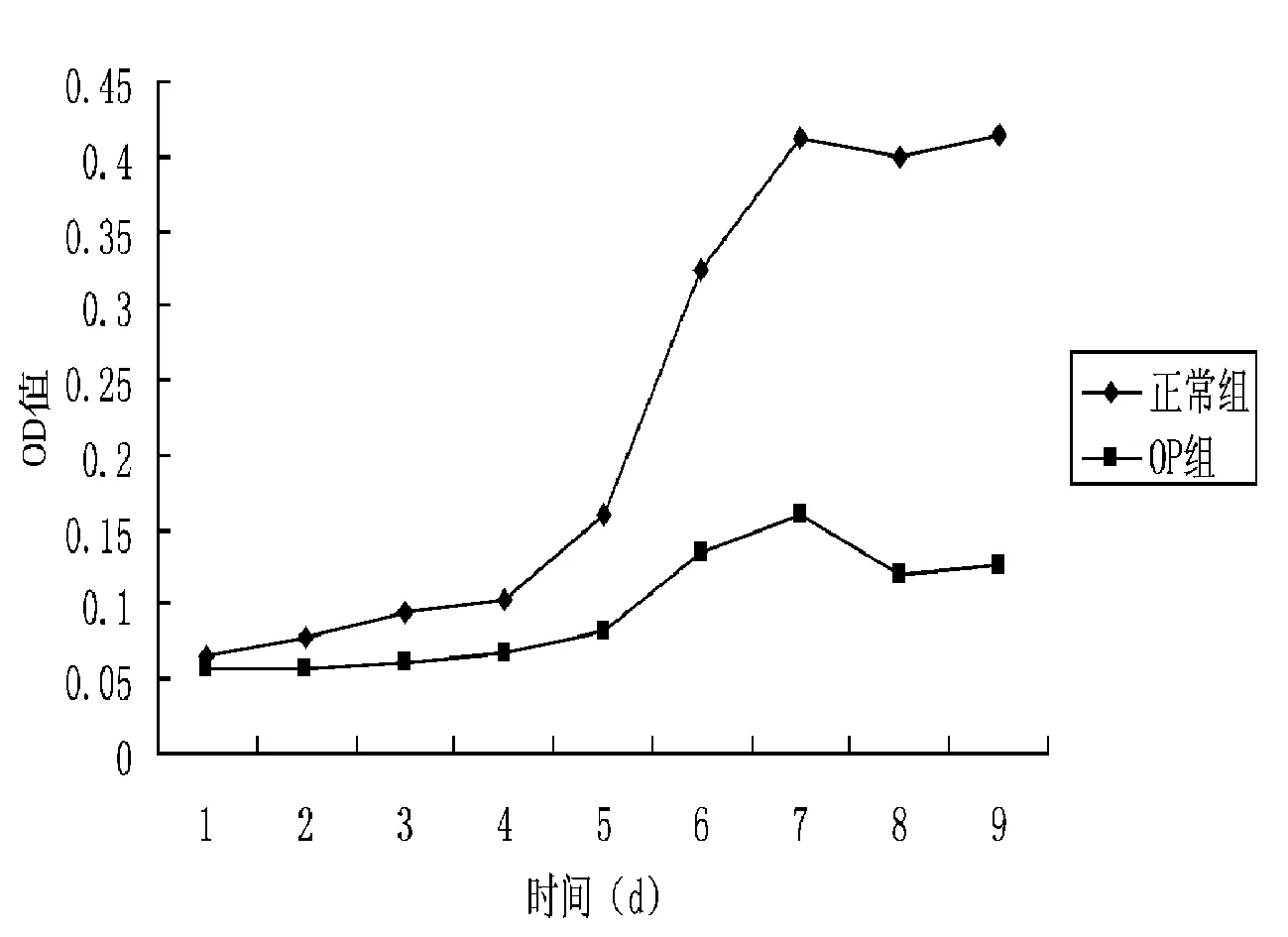
图6 正常与OP大鼠P3代MSCs生长曲线
3.4 骨向分化ALP染色比较 骨向诱导15d后运用钙钴法进行ALP染色,胞浆内呈现深棕色或深黑色颗粒状或大片状黑色沉淀,说明MSCs成功分化为OB。且正常诱导组ALP染色阳性细胞明显多于OP诱导组。结果如图7a、7b所示。
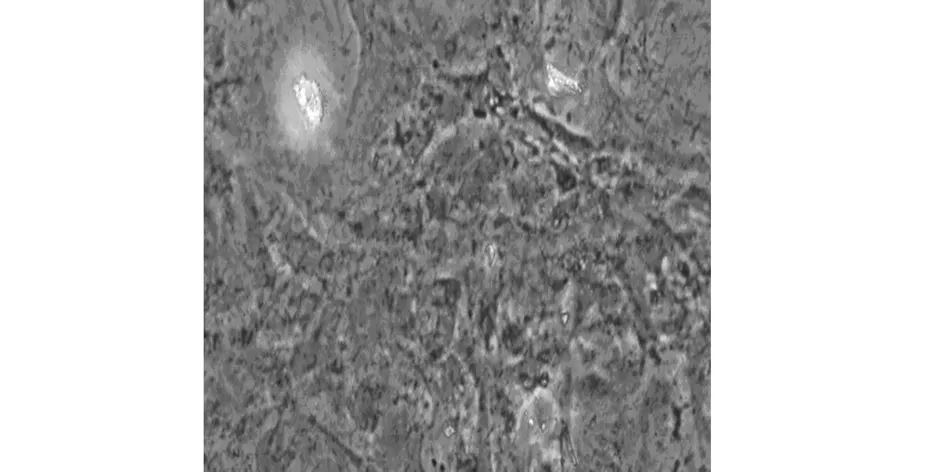
图7a 正常诱导组MSCs ALP染色(100×)
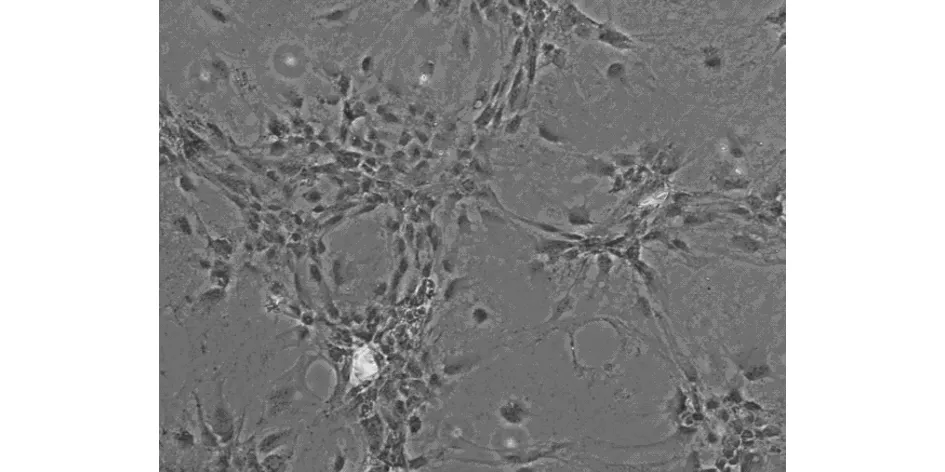
图7b OP诱导组MSCs ALP染色(100×)
3.5 脂向分化油红O染色比较 脂肪诱导第4天,细胞胞浆内开始出现细黄色小脂滴,逐渐融合,倒置显微镜下可见的高折光性的小圆形脂滴,晶莹透亮,主要集中于细胞核周围。随着诱导时间的延长,出现脂滴的细胞逐渐增多。继续诱导,胞内的小脂滴逐渐融合成大的脂滴,细胞体积逐渐增大,由原来的长梭形变为椭圆形或多角形,细胞核被被大颗粒状的脂滴挤于一侧。随着诱导时间的延长,脂肪细胞的比例逐渐增高。油红O染色显示脂滴呈红色,OP诱导组阳性数量明显多于正常诱导组,结果如图8a、8b所示。
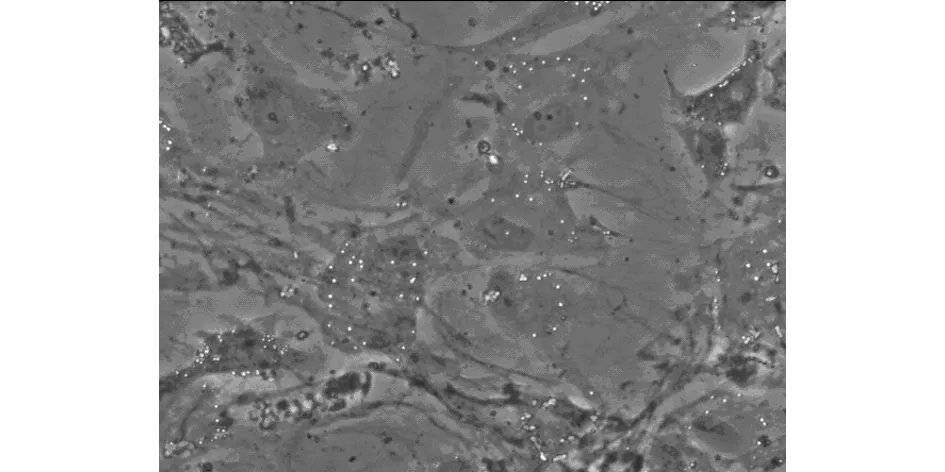
图8a 正常诱导组MSCs油红O染色(200×)
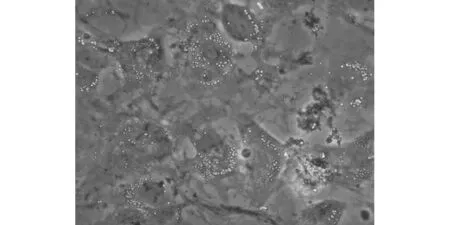
图8b OP诱导组MSCs油红O染色(200×)
4 讨论
MSCs可以表达多种标记,但是缺乏特异性表面标记,目前尚无具有高度特异性的MSCs表面标记物,其鉴定的方法都是通过在培养过程中出现分化表型,然后逆推得知是否为MSCs。因此本实验选取MSCs表达阳性的指标CD29和CD44,以及表达阴性的指标CD34和CD45作为鉴定参考指标。本实验结果与报道一致,证明分离培养扩增的为大鼠MSCs[6]。
MSCs成骨分化的主要表现是细胞能够合成、分泌表达成骨特异性的蛋白和细胞外基质成分,包括早期出现的ALP,Ⅰ型胶原等。ALP是成骨的标志物之一,对它的测定可以反映细胞向成骨方向分化的程度。在基质开始钙化时成骨细胞的ALP活性最高,在钙化接近结束时,活性则最低,其活力在一定程度上反映成骨细胞的分化程度和功能状态。因此,ALP的活性可以代表成骨细胞的早期分化水平。其作用是水解有机磷酸盐释放出无机磷而作用于羟基磷灰石的形成,是骨形成所必需的酶,它代表着骨形成的状况,表明细胞分化的开始。
本研究结果表明,去卵巢对于大鼠MSCs形态及增殖能力均有一定的影响。正常大鼠MSCs呈典型的集落生长,细胞呈长梭形,传代后增殖能力较强;而去卵巢后MSCs体积较大,细胞偏圆形,增殖能力大大下降。OP大鼠在分离完股骨和胫骨后,用PBS冲洗骨髓腔时,冲出的液体可见大量的油脂浮于表面,可推测骨髓中脂肪含量较高。在相同条件诱导下,OP大鼠MSCs更倾向于向脂肪细胞分化,而正常细胞则更多向成骨细胞分化。 综上所述,可初步推测去卵巢,增龄会导致骨髓腔内脂肪组织增多,骨组织减少,从而造成骨质疏松。
[1]Kishimoto KN,Watanabe Y,Nakamura H,et al.Ectopic bone formation by electroporatic transfer of bone morphogenetic protein-4 gene[J].Bone,2002,31(2):340-347.
[2]Yang XB,Webb D,Blaker J,et al.Evaluation of human bone marrow stromal cell growth on biodegradable polymer/bioglass composites[J].Biochem Biophys Res Commun,2006,342(4):1098.
[3]苗春雷,周广东,刘天一.软骨细胞与骨髓基质细胞共培养体外构建软骨组织的初步研究[J].上海第二医科大学学报,2004(4):246-249.
[4]赵兴,柏学进,封纪武,等.小鼠MSCs体外定向诱导分化神经及脂肪细胞的研究[J].中国农业科学,2008,41(1):229.
[5]Moerman EJ,Teng K,Lipschitz DA,et al.Aging activates adipogenic and suppresses osteogenic programs in mesenchymal marrow stroma/stem cells:the role of PPAR-gamma2 transcription factor and TGF-beta/BMP signaling pathways[J].Aging Cell,2004,3(6):379-389.
[6]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.

