不同方法制备的PLGA-胶原复合支架对大鼠成肌细胞增殖活性的影响
邹 蕊, 宋锦璘, 牛 林 (西安交通大学附属口腔医院正畸科, 西安 70004;重庆医科大学附属口腔医院正畸科;西安交通大学附属口腔医院修复科)
细胞外基质及其三维空间结构不仅能够提供细胞获取营养、交换气体、排泄废物和生长代谢的微环境,同时,作为细胞内及细胞间生物化学反应和信号转导通路的发起者,它也是细胞赖以生长分化的物质基础,并控制着细胞的特异性分化和功能。越来越多的研究结果显示,生长于三维基质支架中的细胞,具有更接近于在体细胞的形态和功能。而近年来发展迅猛的组织工程技术,可在体外充分模拟细胞外基质微环境,为进一步研究三维培养条件下细胞的生物学行为提供了新的技术手段。
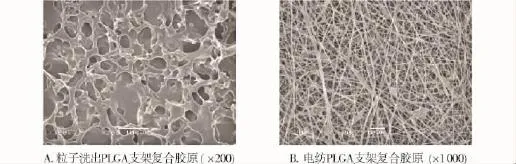
图1 PLGA-胶原支架的扫描电镜观察Fig 1 The morphology of PLGA-collagen scaffolds under scanning electron microscope
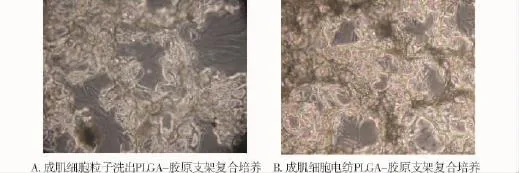
图2 成肌细胞支架复合培养的倒置显微镜观察(×200)Fig 2 The morphology of rat myoblasts cultured with the two PLGA-collagen scaffolds under inverted microscope(×200)
聚乳酸 -羟基乙酸(poly lactide-co-glycolide,PLGA)是一种在医学及生物学领域被广泛应用的生物高分子材料,具有十分优越的生物相容性和生物降解性[1,2],是组织工程技术中最为重要的支架材料之一。PLGA材料不仅具有良好的生物性能,而且制备成多孔支架材料后其物理化学性具很强的可调控性。根据支架材料的不同孔隙率及孔径大小,能够嵌入或携带各种细胞,从而模拟多种细胞存活的三维空间结构,满足培养多种细胞的需要,如成纤维细胞、平滑肌细胞、成肌细胞、成骨细胞等[3-7]。但单纯的PLGA支架表面呈现较高的生物惰性和疏水性,将Ⅰ型胶原复合于PLGA支架表面,制备成PLGA-胶原复合生物支架能有效提高其细胞相容性[8]。本实验通过骨骼肌细胞与PLGA-胶原生物三维支架的复合培养,评价不同方法制备的PLGA-胶原支架对细胞增殖的影响。
1 材料和方法
1.1 试剂和仪器 F12培养基、小牛血清购自美国Gibco公司,Ⅰ型胶原酶、胰蛋白酶、四甲基偶氮唑盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazoliumbro mide,MTT]购自美国 Sigma公司,分析纯二甲基亚砜(dimethyl sulfone,DMSO)购自成都科龙化学试剂公司。
1.2 PLGA-胶原支架的制备 利用两种不同的方法制备PLGA-胶原支架。方法一:以氯仿为溶剂,配制一定浓度的PLGA溶液,在电压为15 kV、喷丝头与接收屏的间距为6 cm、一定流速的条件下进行静电纺丝,收集、干燥后获得具有多孔三维立体结构的PLGA纤维支架膜,厚度约为200-300 μm。方法二:将PLGA充分溶解后,分别采用孔径为60-80 μm的致孔剂制成PLGA膜。干燥后,使用溶剂反复冲洗,使粒子洗出,形成多孔结构。将0.5 gⅠ型胶原蛋白溶解于100 ml冰醋酸中,制成0.5%的胶原溶液。将PLGA支架浸泡于胶原溶液中4 h,取出干燥。PBS液反复冲洗3-4次,去除残余冰醋酸,以免影响细胞生长。干燥消毒后与细胞进行复合培养。
1.3 大鼠成肌细胞在PLGA-胶原支架上的接种
本实验采用Blau法,选择出生1-2 d的SD大鼠乳鼠进行颌面部骨骼肌细胞的原代培养,获得大鼠成肌细胞[9]。实验共分为三组:静电纺丝组、粒子洗出组和空白对照组。将已制备的PLGA-胶原支架材料经低温等离子干燥消毒后剪成约1 cm2左右小块,分别置于24孔板的孔内。将第3代大鼠成肌细胞以1×105/ml密度接种于PLGA-胶原支架上,每孔1 ml,以空白孔设为对照组,亦分别加入1 ml细胞悬液。分别于培养1,2,3,5,7 d进行 MTT检测。
1.4 统计学分析 测量获得的各组试验数据采用SPSS11.0统计软件计算均值及标准差,以空白组为对照,采用单因素方差分析进行统计分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 两种支架分别与成肌细胞复合培养的形态学观察 扫描电镜观察可见,溶液浇铸-粒子洗出法制备的PLGA支架表面呈现大小不等的圆形或椭圆形孔隙,直径约20-100 μm不等,不能完全实现孔孔相通,孔隙间间隔粗细不均(图1A,见第637页)。静电纺丝法制备的PLGA支架表面由直径较均一的亚微米或纳米级PLGA纤维构成网状结构,孔隙形状不规则,空隙之间相互贯通,可以实现营养之间的交换(图1B,见第637页)。
在成肌细胞与支架材料复合培养72 h后,可以看到细胞在两种支架周围充分铺展、增殖,生长良好。透过溶液浇铸-粒子洗出法制备的PLGA支架孔洞可以看见材料周围成肌细胞充分铺展、分裂,生长良好(图2A,见638页)。电纺法制备的支架由于纤维的交错,较粒子洗出法制备的支架明显致密,孔洞较小且较规则,在材料周围可以看见生长、增殖良好的成肌细胞(图2B,见638页),可见PLGA-胶原支架材料具有良好的细胞生物相容性。
2.2 MTT检测结果 MTT结果可见,离子洗出组、静电纺丝组和对照组的成肌细胞随着培养时间的延长而呈现明显的增殖(图3)。培养的第1天,各组的MTT值没有统计学差异(P>0.05)。在第2,3天,三组的细胞均明显增殖,MTT检测吸光度远远高于第1天,但三组间仍无显著性差异。在第5天时,静电纺丝组的细胞仍然呈现出良好的增殖活性,MTT值明显增高,但是离子洗出组及对照组的细胞增殖活性明显降低,电纺组与另两组间出现显著性差异(P<0.05),而第7天时,电纺组的细胞数量亦出现回落,但仍明显高于空白组和粒子洗出组。
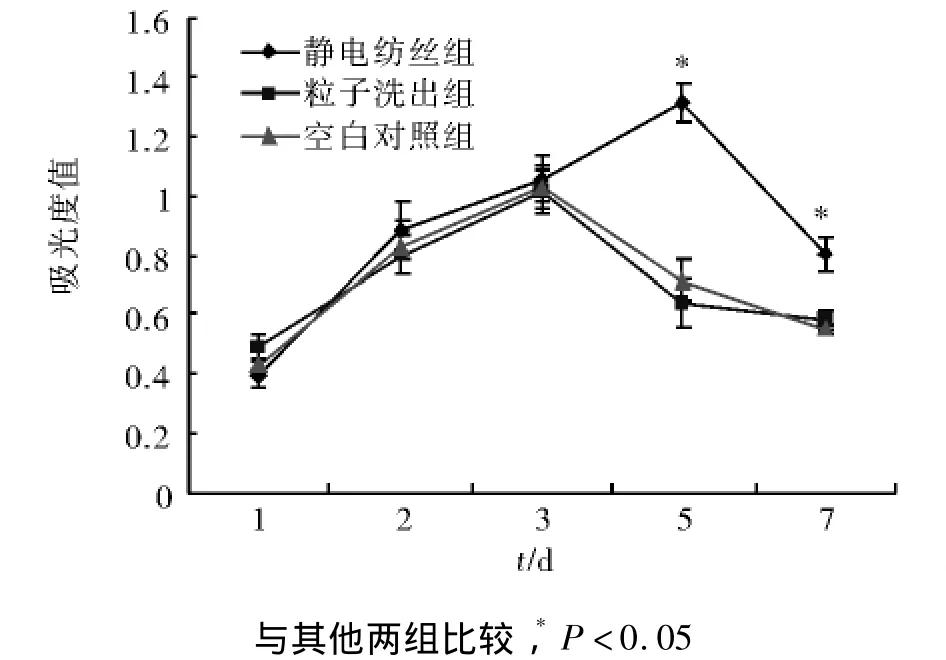
图3 PLGA-胶原支架复合培养后大鼠成肌细胞的增殖情况Fig 3 The proliferation of rat myoblasts after cultured with the two PLGA-collagen scaffolds
3 讨论
3.1 不同制作工艺对三维支架性能的影响 粒子洗出法主要是使用一定粒径分布的水溶性离子如NaCl盐粒、明胶微球等作为致孔剂,运用支架材料与致孔剂的不同溶解性,制得一定孔径分布和孔隙率的三维多孔支架材料。这种方法主要是通过调节致孔剂的大小和多少来控制支架的孔隙大小和孔隙率,以及支架的厚度[2]。利用粒子洗出法所制备的支架材料孔隙较大而且孔孔相通性稍差。静电纺丝法主要是利用高压发生器将一定浓度的液体形成一股带电的喷射流,并在电场中运动、拉伸,最终沉积在接收屏上,成为直径很小的纤维状物质。这些纤维的直径通常达到纳米或亚微米的尺度范围[10,11]。静电纺丝所制备的支架材料具有特殊的三维多孔结构,达到孔孔相通,对液体有极好的滤过性,能够很大程度满足细胞营养和代谢的需求,在几何尺寸上与生物体内的支持组织的微观结构存在一致性,所以电纺工艺提供了一种模仿天然细胞外基质的手段。
3.2 不同方法制备PLGA-胶原复合支架对大鼠成肌细胞增殖的影响 本研究采用了MTT法检测大鼠成肌细胞与不同方法制备的PLGA-胶原支架复合培养不同时间点细胞的增殖情况。四甲基偶氮唑盐微量酶反应比色法(MTT法)是细胞生物学及组织工程学中检测细胞增殖活性的常用手段之一,其基本原理是活细胞的线粒体脱氢酶可将MTT转变为甲瓒(formazan),后者为不溶于水的紫色颗粒,其生成量与细胞数目和细胞活性呈正相关,所生成的甲瓒溶解于二甲基亚砜(DMSO)后,检测光密度值变化,即可间接反映出细胞的增殖活性。本次实验结果可见,与空白对照组相比,与PLGA-胶原支架复合培养的大鼠成肌细胞在培养前3 d数量并没有显著减少;培养5-7 d后,相比于空白对照组和粒子洗出组,电纺组PLGA-胶原复合支架上培养的细胞数量显著增高。这主要是因为电纺支架材料具有孔孔相通的微观结构,培养液与细胞之间可以进行充分的养分交换。由此可知,应用上述两种方法制备的PLGA-胶原复合支架材料均具有良好的生物相容性,对大鼠成肌细胞的增殖均未产生不良影响。而电纺法制备的PLGA-胶原支架材料表现出比粒子洗出法制备的材料更加优越的生物及理化性能,可在一定程度上促进大鼠成肌细胞的增殖、分化。
[1] Sherwood JK,Riley SL,Palazzolo R.A three-dimensional osteochondral composite scaffold for articular cartilage repair[J].Biomaterials,2002,23(24):4739 -4751.
[2] 陈治清.口腔生物材料学[M].北京:化学工业出版社,2004:6.
[3] Aviss KJ,Gough JE,Downes S.Aligned electrospun polymer fibres for skeletal muscle regeneration[J].Eur Cells Mater,2010,19:193-204.
[4] 徐志强,刘彬,王艳萍,等.几种组织工程支架材料生物力学性能的研究[J].中国组织工程研究与临床康复,2007,11(35):7117-7120.
[5] Meng ZX,Wang YS,Ma C.Electrospinning of PLGA/gelatin randomly-oriented and aligned nanofibers as potential scaffold in tissue engineering[J].Mater Sci Eng C,2010,30(8):1204 -1210.
[6] Li Mengyan,Mondrinos MarkJ,Chen Xuesi.Co-electrospun poly(lactide-co-glycolide),gelatin,and elastin blends for tissue engineering scaffolds[J].J Biomed Mater Res,2006,79(4):963 -973.
[7] Chen G,Sato T,Ushida T,et al.The use of a novel PLGA fiber/collagen composite web as a scaffold for engineering of articular cartilage tissue with adjustable thickness[J].J Biomed Mater Res,2003,67A(4):1170 -1180.
[8] Ngiam M,Liao S,Patil AJ,et al.The fabrication of nanohydroxyapatite on PLGA and PLGA/collagen nanofibrous composite scaffolds and their effects in osteoblastic behavior for bone tissue engineering[J].Bone,2009,45(1):4 -16.
[9] Blau HM,Webster C.Isolation and characterization of human muscle cells[J].Proc Natl Acad Sci USA,1981,78(9):5623 -5627.
[10] Deitzel JM,Kleinmeyer J,Hirvonen JK,et al.Controlled deposition of electrospun poly(ethylene oxide)fibers[J].Polymer,2001,42(19):8163 -8170.
[11] 李双燕,王曙东,张幼珠,等.静电纺PLGA管状支架的构建及其生物力学性能[J].合成纤维,2009,38(11):22 -25.

