高住高练对肥胖大鼠肝脏SREBP-1c表达的影响
王金昊 路瑛丽 冯连世 王雪冰 张漓 徐建方
1国家体育总局体育科学研究所(北京 100061)
2上海体育科学研究所
3广西大学体育学院
脂肪沉积关乎人体健康。机体脂肪的沉积量是脂肪合成代谢和分解代谢动态平衡的结果,其中,脂肪酸合成关键酶在脂肪酸合成中起决定性作用。乙酰辅酶 A羧化酶 (acetyl CoA-carboxylase,ACC)和脂肪酸合成酶(fatty acid synthetase,FAS)是脂肪酸合成代谢的两个主要限速酶[1,2],而固醇调节元件结合蛋白-1c(sterol regulatory element-binding protein 1c,SREBP-1c) 是 ACC、FAS的重要调节因子,主要通过诱导ACC、FAS表达促进肝脏脂质合成增加[3,4]。
肝脏是脂肪酸合成的主要场所,SREBP-1c主要在肝脏中表达。有研究表明,运动时间是影响SREBP-1c变化的一个重要因素,短期运动对SREBP-1c无明显影响[5],长期运动则引起SREBP-1c 明显变化[6,7]。 1 周左右短期低氧安静(暴露)环境可使SREBP-1c表达增加[8],尚未见长期低氧安静环境对其影响的研究。目前,关于低氧训练(高住高练)对SREBP-1c mRNA和蛋白表达的影响鲜有报道。本实验通过观察0~4周高住高练后肥胖大鼠肝脏SREBP-1c mRNA和蛋白表达的变化,探讨高住高练对肥胖大鼠肝脏SREBP-1c表达的影响,有助于更好认识高住高练调节肝脏脂肪酸合成的机理,对于指导高住高练降脂(减重)有指导意义。
1 材料与方法
1.1 实验动物与分组
出生21天离乳SD雄性大鼠280只,动物批号:081108,由北京维通利华实验动物技术有限公司提供,生产许可证:SCXK(京)2006-0001,体重(42.7±4.7)g。购入后在国家体育总局体育科学研究所屏障级动物实验室分笼饲养,使用许可证:SYXK(京)2006-0017,每笼5只,室温21~23℃,湿度40%~60%,自然光照。动物实验室、饲养用具定期消毒灭菌。
实验动物购入后建立肥胖大鼠模型[9],从所有造模成功的大鼠中按体重挑选160只大鼠,在常氧环境下经过2周适应性训练后,再根据体重、训练情况进行分组,淘汰体重过重、过轻及伤病大鼠,最后保留130只大鼠进行正式实验。随机分为13组,每组10只,各组分别为:对照组(正式实验开始前取材,可视为低住低练、低氧安静、高住高练0周组),低住低练 1、2、3、4 周组,低氧安静 1、2、3、4 周组,高住高练 1、2、3、4 周组。
1.2 动物饲料配方
大鼠普通饲料购自北京科澳协力饲料有限公司,产品许可证号:京饲(配)字第238号,SCXK(京)2005-0007,执行标准 GB14924·3-2001。高脂饲料采用孙志等[10]报道的营养性肥胖动物模型所用饲料,本研究略加改进,配方为:普通饲料61.5%、猪油12%、蔗糖5%、奶粉 5%、花生 5%、鸡蛋 10%、麻油1%、食盐0.5%。
1.3 实验方案
采用水平动物跑台进行有氧耐力运动,常氧下运动强度为26 m/min,根据血乳酸确定低氧下对应的运动强度为 21 m/min,持续运动 1 h/d,6 d/w,1~4 w。 实验中使用的低氧发生设备为国家体育总局体育科学研究所低氧实验室的CTDY-200型高温高湿低氧训练系统。低氧环境的氧浓度为13.6%(约相当于3500 m 海拔高度)。 低氧安静 1、2、3、4周组大鼠每天在低氧下生活,自由活动,不安排训练,分别持续1、2、3、4 周; 低住低练 1、2、3、4 周组大鼠每天在常氧下生活 23 h,训练 1 h,分别持续 1、2、3、4 周(非训练日生活 24 h);高住高练 1、2、3、4周组大鼠每天在低氧下生活 23 h,训练 1 h,分别持续 1、2、3、4 周(非训练日生活24 h)。
1.4 取材
安静组相应周次后、所有运动组最后一次训练后恢复24 h、所有低氧大鼠离开低氧房即刻取材。按0.3 ml/100g体重剂量腹腔注射10%水合三氯乙醛溶液麻醉大鼠。迅速分离出大鼠肝脏,在预冷的生理盐水中漂洗去血,滤纸吸干水分,分装后投放液氮中速冻,保存于-80℃冰箱待测。
1.5 指标检测
所有指标测试均在国家体育总局体育科学研究所分子生物学实验室完成。
肝脏总RNA提取和检测:采用SV Total RNA试剂盒(Z3100,Promega公司,美国)抽提大鼠肝脏样本总RNA,紫外分光光度计和电泳检测所提RNA的纯度、浓度及完整性,并按以下公式计算RNA含量:RNA 含量(μg/μl)= 稀释倍数×OD260值×40/1000。
反转录(20 μl总反应体系,本实验RNA用量取1 μg):采用逆转录试剂盒(A3500,Promega 公司,美国)合成cDNA备用。
引物设计与合成:采用primer5引物设计软件设计适合于SYBR Green Kit方法的引物,具体见表1,由上海生工生物工程有限公司合成。
实时荧光定量PCR检测:PCR反应采用SYBR Green 试剂(ABI公司,美国),在 ABI 7300 Real Time PCR 仪上设定反应条件:50℃ 2 min;95℃ 10 min;95℃ 15 s,60℃ 1 min;共40个循环。每个样本重复3次,测得CT值并分析溶解曲线。以β-actin作为内参,依据CT比较法进行相对定量分析:△Ct=Ct(目的基因)-Ct(内参基因),相对表达量=2-△Ct。

表1 实时荧光定量PCR引物序列
Western Bloting检测:称取在液氮中研磨后的肝脏组织100 mg,放入EP管内,加1 ml裂解液,混匀后冰上孵育45~60 min,4℃ 14000 r/min速度离心10 min,取上清,-80℃冰箱保存。用BCA蛋白定量试剂盒(美国Pierce公司)检测蛋白浓度。SDS-PAGE电泳后将蛋白转至PVDF膜。5%脱脂奶粉常温封闭2 h。5%牛血清白蛋白(BSA)按 1∶200 和 1∶1000 分别稀释一抗 (Mouse monoclonal antiSREBP1,ab3259,ABcam;Rabbit polyclonal antiβ -actin,sc-130657,Santa Cruz),4℃冰箱摇床孵育过夜。次日 1×TBST洗膜3次,每次10~15 min,再按1:4000和1:6000分别稀释二抗 (HRP Conjugated Goat anti-Rabbit IgG,ZB-2301,北京中衫金桥;HRP Conjugated Goat anti-Mouse IgG,ZB-2305,北京中衫金桥),室温孵育 1 h,之后1×TBST洗膜3次,每次10~15 min。使用ECL发光试剂盒(Millipore)发光显影,胶片曝光。用凝胶扫描系统扫描胶片图像,用Quantity One软件测定目的条带灰度值,同一样本重复3次,取3次测试结果平均值与β-actin平均灰度值的比值作为蛋白表达的相对值。
1.6 统计学分析
采用SPSS13.0统计软件分析实验数据,计算均值和标准差,相同训练模式不同周次之间、相同周次不同训练模式之间的比较采用单因素方差分析,P<0.05、P<0.01为具有统计学意义。
2 结果
2.1 肝脏SREBP-1c基因表达
表2显示:相同训练模式不同周次之间比较:低住低练组肝脏SREBP-1c mRNA表达与对照组比较差异无统计学意义(P>0.05);低氧安静组SREBP-1c mRNA表达前三周变化不大,第4周降低,与0、1、2、3 周组比较,差异有统计学意义(P<0.05,P<0.01,P<0.05,P<0.01);高住高练组 SREBP-1c mRNA表达第1、2、4周变化不大,第3周表达降低,与对照组比较差异有统计学意义(P<0.05)。
相同周次不同训练模式之间比较:第1、2、4周,高住高练组肝脏SREBP-1c mRNA表达量与低住低练组和低氧安静组比较差异无统计学意义 (P>0.05),第3周高住高练组SREBP-1c mRNA表达低于低氧安静组(P<0.05)。

表2 大鼠肝脏SREBP-1c mRNA表达变化
2.2 肝脏SREBP-1c蛋白表达
从表3和图1可以看出:相同训练模式不同周次之间比较:低住低练组大鼠肝脏SREBP-1c蛋白表达1~4周下降幅度分别为27%、34%、34%、25%,但无统计学意义(P>0.05);低氧安静组SREBP-1c蛋白表达前三周无明显变化,第4周表达降低,与第1、3周组比较差异有统计学意义 (P<0.05,P<0.01);高住高练组SREBP-1c蛋白表达在第1、2、4周变化不明显,第3周表达降低,与第1、2周组比较差异有统计学意义(P<0.05)。
相同周次不同训练模式之间的比较:第1、4周,高住高练组肝脏SREBP-1c蛋白表达与低住低练和低氧安静组比较差异无统计学意义(P>0.05),第2周,高住高练组SREBP-1c蛋白表达高于低住低练组(P<0.01),第 3周,高住高练组 SREBP-1c蛋白表达低于低氧安静组(P<0.05)。
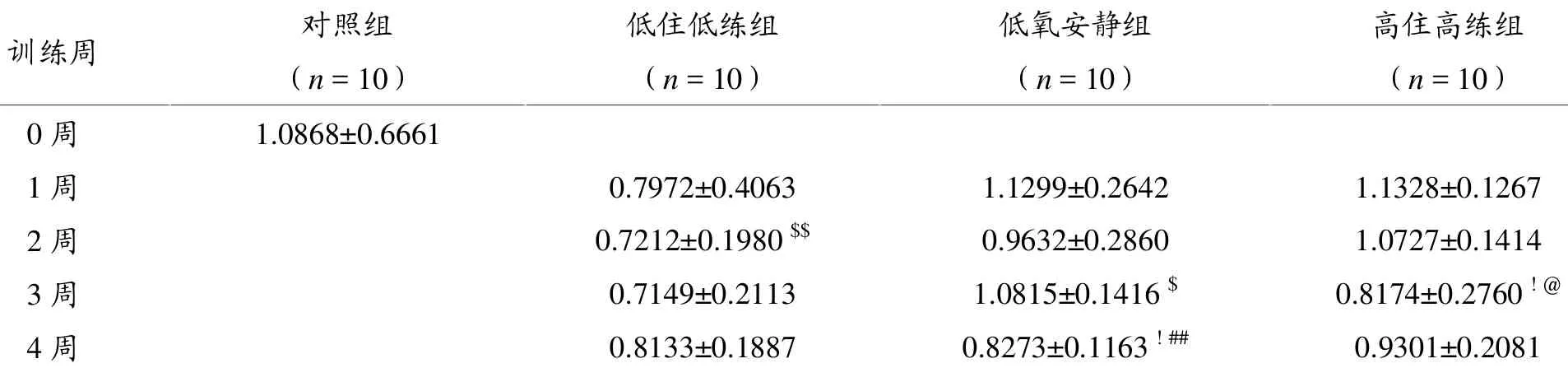
表3 大鼠肝脏SREBP-1c蛋白表达变化

图1 大鼠肝脏SREBP-1c蛋白表达变化
3 讨论
SREBP是一类位于内质网上的膜连接蛋白,SREBP-1c是SREBP家族中的一个重要成员,它构成了动物体内90%的SREBP-1,主要在肝脏和脂肪细胞中表达,与其靶基因启动子的固醇调节元件(Sterol regulatory elements,SREs) 或 E 盒 (5′-CAXXTG-3′)(XX为任何碱基)结合,激活与胆固醇和脂肪酸合成相关基因的转录[11],参与调节脂肪酸代谢[3,12-14]和糖代谢[15]。 艾正琳[16]研究报道,SREBP-1c基因和蛋白表达增高均可增加FAS基因转录,引起脂肪酸合成增加,当脂质合成超过机体自我调节能力时,肝细胞内TG沉积增多,致肝脏脂质代谢障碍。研究还发现,SREBP-1c mRNA表达增加与高脂饮食时间相关,非酒精性脂肪性肝病(NAFLD)大鼠肝脏SREBP-1c mRNA表达从第2周开始增加,第12周达到高峰,受其调控的FAS转录合成也增多[17]。Kakuma 等[18]也研究表明,fa/faZDF 肥胖大鼠(瘦素受体突变)肝脏和胰岛SREBP-1c基因表达显著提高,ACC和FAS基因表达转录增多,肝脏TG显著升高5.4倍。另外,还有学者也证实了SREBP-1c能促进肝脏脂肪酸合成增加[19-21]。可见,SREBP-1c在调节脂肪酸合成代谢中起着关键作用,其通过作用于靶基因表达调控动物体内的脂肪合成,过度表达将导致脂质堆积、代谢紊乱,引发肥胖、脂肪肝等疾病。
3.1 低住低练对肥胖大鼠肝脏SREBP-1c mRNA和蛋白表达的影响
有研究表明长期运动训练引起SREBP-1c mRNA增加。如Ikeda等[22]让小鼠进行2周游泳训练,发现其骨骼肌SREBP-1c mRNA显著增加了1.4~2倍,并证明SREBP-1c是长期运动后肌肉生脂基因变化的调控因子。也有相反的实验结果。范挺[6]的实验对象是脂肪肝肥胖患者,体内脂质代谢处于非健康状态,16周有氧运动后,运动组和运动加饮食控制组血清SREBP-1c水平显著下降,SREBP-1c与腰臀比、血浆TG显著相关,并提出有氧运动能降低血SREBP-1c水平而抑制脂质合成。
本实验中,低住低练组4周SREBP-1c mRNA和蛋白表达较对照组均无明显变化,可能是4周低住低练对肥胖大鼠肝脏SREBP-1c尚未达到足够刺激。另外,本实验检测的是肝脏组织,可能不同组织SREBP-1c表达对低住低练的适应不同。
3.2 低氧暴露对肥胖大鼠肝脏SREBP-1c mRNA和蛋白表达的影响
研究认为,低氧暴露可引起SREBP-1c表达增加。Piguet等[23]研究表明,小鼠经过 7 天低氧(10%氧浓度)暴露,肝脏SREBP-1c mRNA、ACC1 mRNA、ACC2 mRNA表达均明显升高,同时血甘油三酯升高,上述基因表达升高加剧了脂肪变性。Li等[24]报道, 间歇低氧 5 天后,Hif1α+/+野生小鼠和 Hif1α+/-小鼠血TG、FFA、肝脏SREBP-1 mRNA表达显著增高,Hif1α+/+野生小鼠低氧后 SREBP-1c 蛋白表达显著升高。Li等在另一篇文献[25]中指出,间歇低氧暴露5天后,C57BL/6J瘦鼠肝脏SREBP-1 mRNA表达升高,同时肝脏 TG、血 TG、血清 FFA、肝脏 FAS、ACC基因表达升高。Furuta等[26]采用活体和体外实验,观察到低氧暴露引起SREBP-1基因和蛋白表达增加,FAS基因和蛋白表达增加,认为低氧引起FAS表达增加是由于SREBP-1调节所致。
本实验结果显示,低氧安静组肝脏SREBP-1c mRNA和蛋白表达在前三周均无明显变化,第4周,低氧安静组肝脏SREBP-1c mRNA和蛋白表达显著降低,推测低氧条件下肝脏SREBP-1c mRNA和蛋白表达与低氧刺激时间长短有关。这与上述短期低氧暴露的研究结果不一致,可能是低氧模型和低氧持续时间不一导致,也可能与HIF-1有关,低氧条件下HIF-1调节肝脏SREBP-1c转录后的蛋白表达[27,28]。
3.3 高住高练对肥胖大鼠肝脏SREBP-1c mRNA和蛋白表达的影响
低氧训练提高训练者身体机能,也能有效地改善身体成分,且低氧训练引起体重降低主要以体脂减少为主,可能与机体合成代谢受到抑制有关。与高住低练和低住高练比较,高住高练减控体重效果最好[29]。值得注意的是,本研究中,高住高练组肝脏SREBP-1c mRNA和蛋白表达均在第3周显著降低,而第1、2、4周无明显变化,表明第3周可能是高住高练影响肥胖大鼠SREBP-1c mRNA和蛋白表达变化的关键周。另外,第3周高住高练组SREBP-1c mRNA和蛋白表达均低于低氧安静组,由此可知,3周高住高练抑制肥胖大鼠肝脏SREBP-1c mRNA的作用力强于低氧安静。结合实验结果,推测3周高住高练抑制肥胖大鼠肝脏SREBP-1c mRNA和蛋白表达效果较好。
4 小结
低氧安静条件下,肥胖大鼠肝脏SREBP-1c mRNA和蛋白表达变化与低氧刺激时间长短有关,3周高住高练有效抑制肥胖大鼠肝脏SREBP-1c基因和蛋白表达,这为阐明低氧训练影响脂肪酸合成代谢的机制提供了理论依据。
[1]Eberle D,Hegarty B,Bossard P,et al.SREBP transcription factors:master regulator of lipid homeostasis.Biochimie,2004,86(11):839-848.
[2]Jump DB,Botolin D,Wang Y,et al.Fatty acid regulation of hepatic gene transcription.J Nutr,2005,135 (11):2503-2506.
[3]Horton JD,Goldstein JL,Brown MS.SREBPs:activators of the complete program of cholesterol and fatty acid synthesis in the liver.J Clin Ivest,2002,109(9):1125-1131.
[4]Fantuzzi G.Adipose tissue,adipokines,and inflammation.J Allergy Clin Immunol,2005,115(5):911-920.
[5]Tunstall RJ,Mehan KA,Wadley GD,et al.Exercise training increases lipid metabolism gene expression in human skeletal muscle.Am J Physiol Endocrinol Metab,2002,283(1):E66-72.
[6]范挺.有氧运动与饮食控制对非酒精性脂肪肝患者血清TNF-a、SREBP-1c影响的研究.苏州:苏州大学硕士学位论文,2009.38.
[7]Nadeau KJ,Ehlers LB,Aguirre LE,et al.Exercise training and calorie restriction increase SREBP-1 expression and intramuscular triglyceride in skeletal muscle.Am J Physiol Endocrinol Metab,2006,291(1):E90-98.
[8]Li J,Nanayakkara A,Jun J,et al.Effect of deficiency in SREBP cleavage-activating protein on lipid metabolism during intermittent hypoxia.Physiol Genomics,2007,31(2):273-280.
[9]路瑛丽,张漓,冯连世,等.高脂饮食大鼠高住高练模型的建立.中国运动医学杂志, 2012,31(5):438-442.
[10]孙志,张中成,刘志诚.营养性肥胖动物模型的实验研究.中国药理学通报,2002,18(4):466-467.
[11]Edwards PA,Tabor D,Kast HR,et al.Regulation of gene expression by SREBP and SCAP.Biochim Biophys Acta,2000,1529(1-3):103-113.
[12]Horton JD.Sterol regulatory element-binding proteins:transcriptional activators of lipid synthesis.Biochem Soc Trans,2002,30(6):1091-1095.
[13]Shimano H.Sterol regulatory element-binding protein-1 as a dominant transcription factor for gene regulation of lipogenic enzymes in the liver.Trends Cardiovasc Med,2000,10(7):275-278.
[14]Shimano H.Sterol regulatory element-binding proteins(SREBPs):transcriptional regulators of lipid synthetic genes.Prog Lipid Res,2001,40(6):439-452.
[15]Kim SY,Kim HI,Kim TH,et al.SREBP-1c mediates the insulin-dependent hepatic glucokinase expression.J Biol Chem,2004,279(29):30823-30829.
[16]艾正琳.LXRα、SREBP-1c介导脂肪酸代谢紊乱在大鼠NAFLD形成中的作用及机制.重庆:第三军医大学硕士学位论文,2006.36-37.
[17]艾正琳,陈东风.SREBP-1c在大鼠非酒精性脂肪性肝病中的表达及意义.第三军医大学学报,2006,28(10):1063-1065.
[18]Kakuma T,Lee Y,Higa M,et al.Leptin,troglitazone,and the expression of sterol regulatory element binding proteins in liver and pancreatic islets.PNAS,2000,97(15):8536-8541.
[19]杨朝霞,孙航,沈薇.非酒精性脂肪性肝病患者肝脏固醇元件结合蛋白-1c的表达及其意义.中华肝脏病杂志,2008,16(11):823-826.
[20]孙楠,崔景秋,高志红,等.高脂饮食诱导的胰岛素抵抗大鼠肝脏固醇调节元件结合蛋白-lc mRNA的表达.中华糖尿病杂志,2010,2(3):216-218.
[21]石嫦娥,陈摇熙,张摇程,等.SREBP-1c激活在细菌脂多糖引起小鼠肝脏脂质沉积中的作用.安徽医科大学学报,2011,46(12):1227-1230.
[22]Ikeda S,Miyazaki H,Nakatani T,et al.Up-regulation of SREBP-1c and lipogenic genes in skeletal muscles after exercise training.Biochem Biophys Res Commun,2002,296(2):395-400.
[23]Piguet AC,Stroka D,Zimmermann A,et al.Hypoxia aggravates non-alcoholic steatohepatitis in mice lacking hepatocellular PTEN.Clin Sci (Lond),2009,118 (6):401-410.
[24]Li J,Bosch-Marce M,Nanayakkara A,et al.Altered metabolic responses to intermittent hypoxia in mice with partial deficiency of hypoxia-inducible factor-1α.Physiol Genomics,2006,25(3):450-457.
[25]Li J,Thorne LN,Punjabi NM,et al.Intermittent hypoxia induces hyperlipidemia in lean mice.Circ Res,2005,97(7):698-706.
[26]Furuta E,Pai SK,Zhan R,et al.Fatty acid synthase gene is up-regulated by hypoxia via activation of Akt and sterol regulatory elementbinding protein-1.CancerRes,2008,68(4):1003-1011.
[27]Choi SM,Cho HJ,Cho H,et al.Stra13/DEC1 and DEC2 inhibit sterol regulatory element binding protein-1c in a hypoxia-inducible factor-dependent mechanism.NucleicAcids Res,2008,36(20):6372-6385.
[28]Drager LF,Jun J,Polotsky VY.Obstructive sleep apnea and dyslipidemia:implications for atherosclerosis.Curr Opin Endocrinol Diabetes Obes,2010,17(2):161-165.
[29]路瑛丽,谢敏豪,冯连世.高原/低氧与减控体重研究.中国运动医学杂志,2012,3(2):169-172.

