微生物转化法制备人参皂苷Compound K的研究进展
李 学,臧 埔,张连学*,郜玉钢*,李 萍,郝建勋,王亚星
(吉林农业大学中药材学院,吉林 长春 130118)
微生物转化法制备人参皂苷Compound K的研究进展
李 学,臧 埔,张连学*,郜玉钢*,李 萍,郝建勋,王亚星
(吉林农业大学中药材学院,吉林 长春 130118)
稀有人参皂苷Compound K(CK)是二醇型非天然人参皂苷,是其他二醇型人参皂苷在人体肠道内的降解产物。因其在抗肿瘤等方面有特效,需大量制备以满足医疗和科研需要,因此,有效获得稀有人参皂苷CK已开展了大量研究。本文就人参皂苷CK的微生物转化及制备进行系统的综述,旨在为其进一步开发利用提供参考。
人参;人参皂苷CK;微生物转化
人参皂苷具有很高的药用价值,是人参中主要的活性成分,目前,已经分离鉴定出人参皂苷50余种[1]。根据人参皂苷的结构类型、糖基的数量和位置,中外学者已分离鉴定出3种皂苷类成分的苷元:达玛烷型(dammarane),水解后生成皂苷元人参二醇或人参三醇;齐墩果烷型(oleanane);奥克梯隆型(octotillol)。人参稀有皂苷Compound K(CK)属二醇型人参皂苷,其不存在于人参中,而是其他二醇型人参皂苷在人肠道内的降解产物,是发挥作用的活性物质。研究发现CK在体内外都有良好的抑制癌细胞生长和转移的作用,是一种潜在抗癌药物,并且在抗衰老、改善记忆、抗炎等各方面都有一定的疗效。因此,如何获得大量的CK是现代药学研究的重点。近年来,利用微生物转化制备人参皂苷CK取得了一定成果,同时也推进了对转化机制研究,但还远不能满足人们的需求,对于微生物转化制备CK的产业化研究仍需引起人们的进一步努力。本文针对微生物转化法制备CK内容进行综述,为CK产业化开发提供理论依据和参考。
1 人参皂苷CK的结构和转化机理
CK属达玛烷型的四环三萜类皂苷(图1),二醇型人参皂苷母核主要在C3和C20位上成苷,糖基多为葡萄糖、木糖和阿拉伯糖;三醇型皂苷母核糖苷键主要在C6和C20位,糖基多为葡萄糖、鼠李糖和木糖。人参皂苷因结构中糖基侧链的不同,显示出不同的性质和活性。CK在结构上与天然二醇型人参皂苷不同之处是C3和C20位上的糖基,故可对天然二醇型人参皂苷C3和C20位上的糖基进行结构修饰以得到人参皂苷CK。
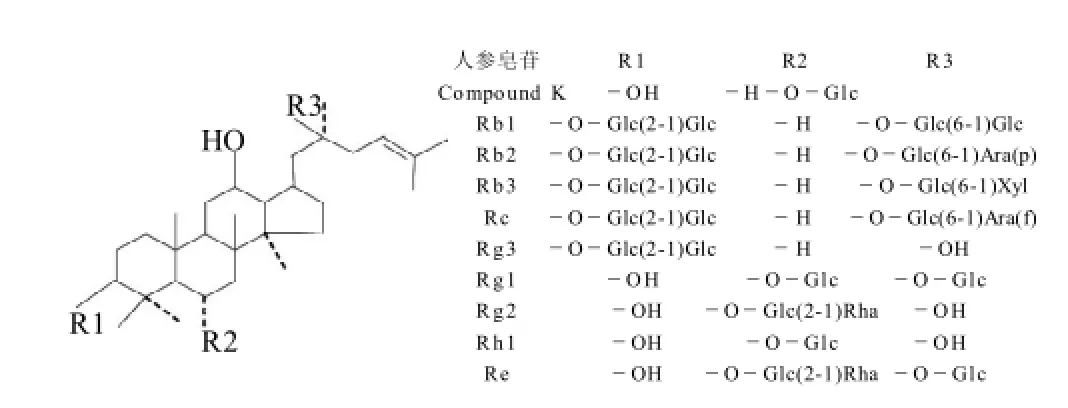
图1 人参皂苷化学结构Fig.1 Chemical structures of ginsenosides
为获得更多极高药用价值的人参稀有皂苷,从20世纪80年代国内外研究人员就开始对人参皂苷进行结构改造,目标锁定在对糖基的结构修饰。目前人参皂苷糖基改造的主要方法有化学法[2]、酶解法和微生物转化法。化学法指用化学催化剂水解皂苷糖基,用于最早的皂苷结构研究,尤以酸水解法使用最多。酸水解过程操作简单,但专一性差,并且转化率低[3]。酶解法条件温和不破坏皂苷结构,反应周期短,专属性强,得率高,污染小,但是酶容易失活,反应条件也不易控制。相比之下,微生物转化法成本较低,副产物少,因此得到广泛应用。
微生物转化是通过把一种化合物变成相关的更有经济价值的产物,来完成常规化学方法难以实现的反应的转化。实际上是通过微生物整体细胞或酶将复杂的底物进行结构修饰,利用微生物代谢过程中产生的某个或某一系列的酶对底物(或外源化合物)进行催化反应[4]。微生物转化人参皂苷反应机制是微生物产生的酶水解掉人参皂苷中的糖基,从而引起结构的改变而获得具有一定结构的产物。微生物转化法的方式是:底物→菌体细胞→反应产物。据文献报道[5-6],影响人参皂苷生物转化的主要因素包括:1)菌种(菌株):菌种是影响人参皂苷生物转化的最重要因素。不同的菌种及同一菌种的不同菌株作用于同一底物的转化产物都可能不同。2)底物:不同底物其转化速率及产生的转化产物不同,底物的浓度亦对转化过程产生很大影响。3)温度:一般在25~28℃条件下培养。4)pH值:转化反应的pH值范围较广,pH3~7内均可反应。
2 人参皂苷CK的制备
2.1 人参皂苷CK转化的由来
对于人参皂苷的研究,至今已有百余年的历史。从1963年Sanada等[7]对山人参根中提取到的总皂苷进行分离、提纯及鉴定后,研究人员才开始把人参皂苷作为人参的有效成分来研究。
1972年Yasioka等[8]利用土壤细菌降解Rbl、Rb2和Rc混合物时首次发现了人参皂苷CK并鉴定了其结构为20(S)原人参二醇-20-O-β-D-吡喃葡萄糖苷。尽管该化合物早已被发现并鉴定了结构,却一直未获得足够的重视。
直到1991年,日本学者Karikura等[9]在对大鼠肠道内人参皂苷Rbl、Rb2代谢物进行检测时,再次发现和鉴定了人参皂苷CK,并证明了人参皂苷CK不是胃酸水解产物,而是肠道微生物转化产物。1996年,Hasegawa等[10-11]系统推测了天然人参皂苷Rbl、Rb2和Rc经肠道微生物转化成人参皂苷CK的代谢过程,为之后的研究奠定基础。此后,Akao等[12]证实一些天然人参皂苷在肠道中吸收很少,只是“天然活性前体”,而人参皂苷CK才是真正被吸收和发挥活性作用的实体。从此激发了人们对人参皂苷CK的研究,目前人参皂苷CK药物研发和工业生产成为所有研究人参皂苷成分中的焦点。
2.2 人参皂苷CK的现代研究
目前CK的转化法主要是酶转化法和微生物转化法。由于人参皂苷四环三萜母核结构上C3和C20位糖苷键的特异性,决定了非天然人参皂苷CK的制备多采用生物转化法,此方法比较温和,化学方法不适用[13]。
酶转化法一般采用粗橙皮苷酶、柚苷酶、果胶酶、纤维素酶及乳糖酶等工业酶制剂转化二醇型人参皂苷混合物来制备CK。它的优点专一性强、工序短、易分离纯化,但它也存在酶用量大、成本高的缺点。研究发现也可提取食用微生物Bifidobacterium sp.Int57和Bif.sp.SJ32等中粗酶,通过转化人参皂苷Rbl、Rb2和Rc来制备CK[14-15]。
微生物转化法主要是利用肠道厌氧菌和土壤微生物发酵。1)肠道厌氧菌起先只是人排泄物中的总菌群[16];后来筛选单一肠道菌进行转化,如Prevotella oris[17]等。2)原始土壤微生物降解人参皂苷的能力较低,必须优化发酵条件和诱变菌种等来提高转化能力[18]。目前国内外在此方面已有一些研究报道,对CK的产业化研究提供了一些依据。下面就近年来人参皂苷CK制备所需的酶或微生物、材料、转化方法及研究意义等进行列表。由表1可知,酶转化法较微生物转化法研究较少,微生物转化法是制备CK比较有潜力的方法。微生物转化的发酵菌种大多数是真菌,开始选用肠道正常菌群,但因肠道菌都是厌氧菌,培养的成本较高,同时产率不大高,所以人们开始寻找一些成本较低的发酵方法来转化人参皂苷,如大型药食兼用真菌和食物中的酵母菌等做发酵菌株。研究对象包括人参、三七、西洋参等原药材及其中含有的总皂苷或单体皂苷,单体皂苷以人参皂苷Rb1、Rb2、Rc和Rd为主,它们的主要转化途径为:Rb1或Rb2→Rd→F2→CK,Rc→C-Mc→CK或Rc→Rd→F2→CK,Rd→F2→CK。研究人员大多数是以稀有人参皂苷CK含量提高为研究目标,部分会产生新的人参皂苷,然而人参皂苷CK的工业化生产才是重中之重。发酵工业的生产水平主要取决于3个因素:生产菌种、发酵工艺和设备,优良菌种或菌株的筛选是微生物发酵法转化活性成分成败的关键。周伟等[30]选用拟青霉菌sp.229为菌种对人参皂苷CK的制备进行了中试研究,通过对培养基和罐上条件的优化成功建立了10L发酵罐三级发酵工艺,后来放大到50L发酵,CK转化率可达83%。此次中试研究解决了CK制备的瓶颈问题,为CK工业化生产和新药研发奠定了坚实的基础。

表1 近年来皂苷CK 制备的研究Table 1 Methods developed for ginsenoside CK production in recent years
微生物转化法制备CK仍然存在很多问题:首先,筛选出成本低,安全性强,专一性高的高效菌种或菌株仍然是大量制备人参皂苷CK的首要条件;其次,研究转化途径发现CK的产生速度最慢是整个转化反应的限速步骤,因此如何加速CK的转化,缩短发酵时间是完善制备方法的关键。再次,优化培养方案,提升到发酵水平,并且注重CK的分离纯化。还有可以寻找可以研究其他一些含有人参皂苷并且价格比较便宜的植物,以扩大当前生药资源的利用。
3 结 语
人参皂苷CK是天然二醇型皂苷在体内发挥活性的物质,是一个多靶点,高活性化合物。其不但在抗肿瘤、抗炎、抗过敏和保肝等方面体现了良好的活性,而且在神经系统及免疫系统方面也具有很好的调节作用,尤其低毒性高活性的特点使其成为很有应用前景的候选药物。微生物细胞的增殖比植物细胞更快,基因转化表达,基因重组,原生质体融合比动植物细胞更容易成功,所以整个过程可以实现自动化,连续化,并且转化效率更高。目前采用微生物转化法生产人参皂苷CK是最好的方法。
为实现微生物转化人参皂苷CK的生产应用,筛选出专一性转化的高产菌种,寻找合适的工业生产条件,对大规模生产稀有人参皂苷CK具有重大意义,也为以后的临床应用提供保障。此外对于人参皂苷CK的纯化也是一个关键步骤,这些都需要研究人员再做大量的研究。
[1]CUI Xiuming, JIANG Zhiyong, ZENG Jiang, et al. Two new dammarane triterpene glycosides from the rhizomes of Panaχ notoginseng[J]. J Asian Nat Prod Res, 2008, 10(9/10): 845-849.
[2]刘娜, 朴虎日, 赵余庆. 稀有抗肿瘤人参皂苷衍生物的制备与分离[J]. 中药材, 2009, 32(5): 707-709.
[3]徐传莲, 付建国. 人参皂苷生物转化研究进展[J]. 生命的化学, 2004, 24: 132-135.
[4]王身艳, 陈建伟, 张蔚学, 等. 双向发酵对白芍HPLC指纹图谱及芍药苷含量的影响[J]. 现代中药研究与实践, 2009, 23(2): 6-9.
[5]SU Jinhuan, XU Jianhe, LU Wenya, et al. Enzymatic transformation of ginsenoside Rg3 to Rh2 using newly isolated Fusarium proliferatum ECU2042[J]. Journal of Molecular Catalysis B: Enzymatic, 2006, 38 (2): 113-118.
[6]CHENG Leqin, NA J R, BANG M H, et al. Conversion of major ginsenoside Rb1 to 20(S)-ginsenoside Rg3 by Microbacterium sp. GS514[J]. Phytochemistry, 2008, 69(1): 218-224.
[7]SANADA S, KONDO N, SHOJI J, et al. Studies on the saponins of ginseng structures of ginsenoside I, structures of ginsenoside Ro, Rb, Rc,Rd[J]. Chem Pharn Bull, 1974, 22(2): 421-428.
[8]YOSIOKA I, SUGAWARA T, IMAI K, et a1. Soil bacterial hydrolysis leading to genuine aglycone. V. On ginsenosides Rbl, Rb2 and Rc of the ginseng root saponins[J]. Chem Pharm Bull, 1972, 20(11): 2418-2421.
[9]KARIKURA M, MIYASE T, TANIZAWA H, et a1. Studies on absorption, distribution, excretion and metabolism of ginseng saponinis VⅡ comparison of the decomposition models of ginsenoside Rbl and Rb2 in the digestive tract of rats[J]. Chem Pharm Bull, 1991, 39(9): 2357-2361.
[10]HASEGAWA H, SUNG J H, MATSUMIYA S, et a1. Main ginseng saponins metabolites formed by intestinal bacteria[J]. Planta Med, 1996, 62(5): 453-457.
[11]HASEGAWA H, SUNG J H, BENNO Y. Role of human intestinal Prevotella oris in hydrolyzing genseng saponins[J]. Planta Med, 1997, 63(5): 436-440.
[12]AKAO T, KIDA H, KANAOKA M, et a1. Intestinal bacterial hydrolysis is required for the appearance of compound K in rat plasma after oral administration of ginsenoside Rbl from Panaχ ginseng[J]. J Pharm Pharmacol, 1998, 50(10): 1155-1160.
[13]周伟, 周佩. 稀有人参皂苷compound K研究进展[J]. 药学学报, 2007, 42(9): 917-923.
[14]ZHOU Wei, FENG Meiqing, LI Jiyang, et al. Studies on the preparation, crystal structure and bioactivity of ginsenoside compound K[J]. J Asian Nat Prod Res, 2006, 8(6): 519-527.
[15]WAKABAYASHI C, MURAKAMI K, HASEGAWA H, et a1. An intestinal baeterial metabolite of ginseng protopanaxadiol saponins has the ability to induce apoptosis in tumor cells[J]. Biochem Biophys Res Commun, 1998, 246(3): 725-730.
[16]HASEGAWA H, SUNG J H, MATSUMIYA S, et al. Main ginseng saponin metabolites formed by intestinal bacteria[J]. Planta Med, 1996, 62(5): 453-457.
[17]HASEGAWA H, SUNG J H, BENNO Y. Role of human intestinal Prevotella oris in hydrolyzing ginseng saponins[J]. Planta Med, 1997, 63(5): 436-440.
[18]韩颖, 赵余庆, 姜彬慧, 等. 抗肿瘤成分CK微生物转化高效菌株的筛选[J]. 中药研究与信息, 2005, 7(2): 17-19.
[19]BAE E A, CHOO M K, PARK E K, et al. Metabolism of ginsenoside Rc by human intestinal bacteria and its related antiallergic activity[J]. Biol Pharm Bull, 2002, 25(6): 743-747.
[20]付建国. 人参皂苷微生物转化的研究[D]. 长春: 吉林农业大学, 2004.
[21]CHI H, KIM D H, JI G E. Transformation of ginsenosides Rb2 and Rc from Panaχ ginseng by food microorganisms[J]. Biol Pharm Bull, 2005, 28(11): 2102-2105.
[22]崔宇, 姜彬慧, 韩颖, 等. 微生物对人参果总皂苷中人参皂苷化合物K的转化作用[J]. 中草药, 2007, 38(2): 189-193.
[23]韩颖, 胡筱敏, 姜彬慧, 等. Fusarium sacchari对三七茎叶中有效成分生物转化条件的优化[J]. 应用生态学报, 2007, 18(12): 2801-2806.
[24]韩颖, 姜彬慧, 胡筱敏, 等. Fusarium sacchari转化三七茎叶皂苷的稀有抗肿瘤成分[J]. 中草药, 2007, 38(6): 830-832.
[25]HAN YING, SUN Baoshan, HU Xiaomin, et al. Tansformation of bioactive compounds by Fusarium sacchari fungus isolated from the soilcultivated ginseng[J]. J Agric Food Chem, 2007, 55(23): 9373-9379.
[26]昆明诺唯金参生物工程有限责任公司. 一种链霉菌发酵三七皂苷制备稀有人参皂苷Compound K的工艺: 中国, 101139562[P]. 2008-03-12.
[27]李幸慰. 人参皂甙Rb3的生物转化以及拟青霉菌sp.229中代谢产物的分离纯化鉴定[D]. 上海: 复旦大学, 2008.
[28]ZHOU Wei, YAN Qin, LI Jiyang, et al. Biotransformation of Panaχ notoginseng saponins into ginsenoside compound K production by Paecilomyces bainier sp.229[J]. J Appl Microbiol, 2008, 104(3): 699-706.
[29]CHEN Guangtong, YANG Min, SONG Yan, et al. Microbial transformation of ginsenoside Rb1 by Acremonium strictum[J]. Appl Microbiol Biotechnol, 2008, 77(6): 1345-1350.
[30]周伟. 稀有人参皂苷compound K的制备和活性研究[D]. 上海: 复旦大学, 2008.
[31]NOH K H, SON J W, KIM H J, et al. Ginsenoside compound K production from ginseng root extract by a thermostable beta-glycosidase from Sulfolobus solfataricus[J]. Biosci Biotechnol Biochem, 2009, 73 (2): 316-321.
[32]金香梅. 微生物转化人参主皂苷为稀有皂苷CK的研究[D]. 延吉: 延边大学, 2010.
[33]刘丹. 人参总皂苷的微生物转化及药理活性研究[D]. 延吉: 延边大学, 2010.
[34]李东霄, 常景玲, 张志宏. 微生物转化人参皂苷Rc和Rd的研究[J].江苏农业科学, 2010(4): 22-23.
[35]YOO M H, YEOM S J, PARK C S, et al. Production of aglycon protopanaxadiol via compound K by a thermostable β-glycosidase from Pyrococcus furiosus[J]. Appl Microbiol Biotechnol, 2011, 89(4): 1019-1028.
[36]KIM B H, LEE S Y, CHO H J, et al. Biotransformation of Korean Panaχ ginseng by pectinex[J]. Biol Pharm Bull, 2006, 29(12): 2472-2478.
[37]姜彬慧, 韩颖, 赵余庆, 等. 酶转化三七叶总皂苷制备人参皂苷C-K的工艺优化[J]. 中草药, 2004, 35(9): 986-989.
[38]JIANG Binhui, ZHAO Yuqing, HAN Ying, et al. Enzymatic transformation of notoginsenoside Fe by β-glucanase [J]. Journal of Chinese Pharmaceutical Sciences, 2006, 15(1): 6-9.
[39]KO S R, SUZUKI Y, SUZUKI K, et al. Marked production of ginsenosides Rd, F2, Rg3, and compound K by enzymatic method[J]. Chem Pharm Bull, 2007, 55(10): 1522-1527.
Research Progress on Ginsenoside CK Production by Microbial Transformation
LI Xue,ZANG Pu,ZHANG Lian-xue*,GAO Yu-gang*,LI Ping,HAO Jian-xun,WANG Ya-xing
(College of Traditional Chinese Medicine, Jilin Agricultural University, Changchun 130118, China)
Rare ginsenoside compound K (CK) is a non-natural diol-type saponin. It is a metabolic product from other diol-type saponins in human intestine. Due to its anti-tumor and other beneficial effects, plenty of ginsenoside CK are needed to meet the needs of medical care and scientific research. For this resson, attempts have been done to produce ginsenoside CK effectively under human controlled conditions. In this paper, we review recent progress on ginsenoside CK preparation by microbial transformation, with the purpose to provide some references for future development of better methods to produce ginsenoside CK.
ginseng;ginsenoside CK;microbiao transformation
O629.13
A
1002-6630(2012)11-0323-05
2011-04-19
科技部科技人员服务企业行动计划项目(2009GJB10031);第46批中国博士后科学基金项目(20090461042);科技部科技支撑计划项目(2011BAI03B01);国家自然科学基金项目(31070316);科技部科技成果转化项目(2010GB2B100100);吉林省科技条件与平台建设计划项目(20112101)
李学(1987—),女,硕士研究生,研究方向为生药学。E-mail:lisnow999@126.com
*通信作者:郜玉钢(1969—),男,副教授,博士,研究方向为生药学。E-mail:gaoyugang_2006@163.com张连学(1956—),男,教授,博士,研究方向为中药学。E-mail:zlxbooksea@163.com

