日本血吸虫调宁蛋白样蛋白P14基因疫苗对小鼠免疫保护作用研究*
唐小牛,汪礼文,姚 勇,汪学龙
血吸虫病是一种严重危害人体健康的人兽共患寄生虫病。目前是一个全球性的重要公共卫生问题,主要流行于非洲、拉丁美洲和亚洲的70多个国家,尤其是热带和亚热带地区,受血吸虫病威胁的人口达6亿,感染者高达2亿,其中2千万患者有较重的临床症状并伴有不同程度的劳动力丧失[1-2],每年约有50万患者死于血吸虫病。因此,世界卫生组织在70年代就提出了防治血吸虫病的规化措施[3]。多年来,防治血吸虫病的主要策略是以化疗为主,辅以灭螺及环境卫生管理等综合性措施。控制血吸虫病最重要的措施仍然是应用安全有效的抗血吸虫药物吡喹酮,但仅仅依靠吡喹酮化疗只能减少或降低人群血吸虫感染率,而不能阻断疫区血吸虫病的传播和再感染发生[4-5],所以化疗需要反复进行[6-7]。而且该药对哺乳期妇女并不安全,因此有大部分感染人群不能接受治疗。因此继续寻找新的血吸虫病防治措施成为专家学者关注的焦点[8]。
开展的对血吸虫病流行区人群化疗后再感染状况的一系列调查研究表明,人体对血吸虫感染有获得性免疫力[9-11],这为血吸虫病疫苗的研制提供了理论依据。WHO认为应优先考虑发展人用血吸虫病疫苗作为化疗或其它防治措施的必要补充,发展血吸虫病疫苗已成为各国专家学者的共识,是世界范围内血吸虫病防治科研工作的研究热点[12-13]。
本研究前期试验中,我们对日本血吸虫P14钙结合蛋白样蛋白基因真核表达载体的构建、表达和鉴定[15]。在此用无内毒素大量质粒提取试剂盒大量制备了真核表达重组质粒pcDNA3.1(+)-SjP14、pcDNA3.1(+)-SjGST 和空质粒 pcDNA 3.1(+),免疫BALB/c小鼠,观察小鼠的免疫保护力,探讨pcDNA3.1(+)-SjP14作为日本血吸虫疫苗的可能性。
1 材料与方法
1.1 实验材料
1.1.1 阳性钉螺 日本血吸虫阳性钉螺购自江西省血吸虫病防治研究所。
1.1.2 实验动物 体重18~22g、5~8w龄雌性BALB/c小鼠购买自安徽医科大学实验动物中心。
1.1.3 DNA 疫 苗 pcDNA3.1(+)-SjP14 和pcDNA3.1(+)-SjGST 由本室构建[14-15]。
1.1.4 主要试剂 无内毒素大量质粒提取试剂盒为北京百泰克生物技术公司产品。
1.2 方法
1.2.1 DNA疫苗的大量制备 -80℃取出带重组质粒的E.coliBL21,于3mL/3μL Amp LB液体培养基中,37℃,225r/min振摇3h后,转入100 mL/100Amp LB液体培养基中,37℃,225r/min振摇过夜,采用北京百泰克生物技术公司无内毒素大量质粒提取试剂盒,按试剂盒说明书大量提取质粒pcDNA3.1(+)-SjP14、pcDNA3.1(+)空质粒和pcDNA3.1(+)-SjGST。
1.2.2 免疫动物 将BALB/C小鼠随机分为4组,每组10只。分别为:生理盐水组给予100μL/鼠/次;空质粒组100μg/鼠/次;pcDNA3.1(+)-SjP14组,给予 100μg/鼠/次;pcDNA3.1(+)-SjP14+ pcDNA3.1(+)-SjGST 组分别给予100 μg/鼠/次。经肌肉注射,共3次,每次间隔2w。
1.2.3 尾蚴攻击感染 末次免疫后2w经腹部皮肤感染日本血吸虫尾蚴(30±1)条/鼠。
1.2.4 用 ELISA 方法检测IgG1、IgG2a、总IgG 于首次免疫前1d、尾蚴攻击前1d、解剖前1d分别经眶静脉采血,分离血清,-20℃保存备用。用ELISA方法检测IgG1、IgG2a、总IgG。
1.2.5 免疫保护效果观察 尾蚴攻击6w后解剖小鼠,行左心室-门静脉灌注冲洗收集成虫,计算减虫率;留取肝脏,部分用5%KOH消化后在显微镜下行虫卵计数,计算减卵率。部分肝脏用于组织病理学分析(HE染色法),观察肝细胞变化及肉芽肿情况。
减虫率:分别计数每只小鼠中血吸虫成虫数,计算每组小鼠的平均成虫数和雌虫数,按如下公式计算:


减卵率:称取鼠肝总重量,按常规方法用5%的KOH消化1g肝组织,计算每克肝组织虫卵数(EPG),按下述公式计算肝组织减卵率:
1.2.6 小鼠肝脏切片HE染色
1.2.7 统计学处理 数据录入excel2003,采用spss11.0进行统计分析,计量资料以±s表示,多组间比较采用方差分析,以α=0.05为检验水准。
2 结 果
2.1 小鼠肝脏组织学的变化 大体解剖可见生理盐水组肝脏表面可见弥漫性粟粒样虫卵结节分布,结节隆起密集,体积较大,空质粒组肝脏呈暗褐色,质硬,表面有沟纹,可见大量灰白色虫卵结节。pcDNA3.1(+)-SjP14核酸疫苗组小鼠肝脏色泽略带暗红色,质地较软,表面较光滑,隐约可见少量灰白色小点,虫卵结节较少;SjP14+SjGST核酸疫苗联用组,肝脏颜色呈鲜红色,表面光滑,虫卵结节少,质软。组织切片镜下显示(图1),生理盐水组肝组织中可见大量的虫卵肉芽肿形成,肉芽肿体积较大,周围有大量淋巴细胞、嗜酸性细胞、巨噬细胞和浆细胞浸润,大量的肝细胞变性坏死;空质粒组也见大量肉芽肿,周围有大量淋巴细胞和巨噬细胞浸润,但是肝细胞变性坏死度较重;pcDNA3.1(+)-SjP14组肝脏病较生理盐水组明显减轻,小鼠肝细胞混浊肿胀,偶见坏死的肝细胞,汇管区卵肉芽肿数量减少,炎性细胞浸润主要以嗜酸性粒细胞和淋巴细胞为主,可见少量巨嗜细胞和浆细胞pcDNA3.1(+)-SjP14+SjGST病变程度最轻,肝小叶结构完整,虫卵肉芽肿周围炎症反应轻,细胞浸润不明显,肉芽肿面积较小。
2.2 血清IgG1、IgG2a、总IgG的检测 图2、图3、图4分别显示,免疫6w后,SjP14组小鼠血清抗体IgG1、IgG2a和总IgG均较对照组明显升高,SjP14+SjGST联合应用作用更显著。

图1 各组小鼠肝脏病理切片(HE染色)A.生理盐水组 B.空质粒组 C.SjP14组 D.SjP14+SjGST组Fig.1 Photomicrographs of liver in each group(HE stain)A:NS group;B:pcDNA3.1(+)vector group;C:SjP14group;D:SjP14+SjGST group

图2 各组小鼠血清特异性IgG1抗体水平Fig.2 Specific IgG1antibody in sera of mice

图3 各组小鼠血清特异性IgG2a抗体水平Fig.3 Specific IgG2aantibody in sera of mice

图4 各组小鼠血清特异性总IgG抗体水平Fig.4 Total IgG antibody in sera of mice
2.3 减虫率和减卵率 由表1可见,SjP14核酸疫苗能明显减少被尾蚴攻击小鼠静脉内成虫数量,SjGST和SjP14核酸疫苗共同免疫则能提高SjP14疫苗抗尾蚴感染的作用,减虫率分别达到44.6%(P<0.05),56.2%(P<0.01)。由表2可见,SjP14组和SjGST和SjP14联合组小鼠肝脏内虫卵数明显低于生理盐水和空质粒对照组(P<0.01),SjGST和SjP14联合组减卵率由单用SjP14的61.5%提高到73.6%。
2.4 减卵率(表2)
表1 各组小鼠的成虫检获情况(±s)Tab.1 Reduction rate of worm burden in each group(±s)

表1 各组小鼠的成虫检获情况(±s)Tab.1 Reduction rate of worm burden in each group(±s)
与对照组比较:*P<0.05,**P<0.01Compared with control group:*P<0.05,**P<0.01
组别Group小鼠数(只)No.mice成虫数(条/鼠)Worm burden减虫率(%)Reduction rate(%)生理盐水Saline 10 22.4±1.9空质粒Empty plasmid 10 21.8±1.8 SjP14 10 12.3±1.4 44.6*SjP14+SjGST 10 9.8±1.6 56.2**
表2 各组小鼠的虫卵检获情况(±s)Tab.2 Reduction rate of liver egg in each group(±s)
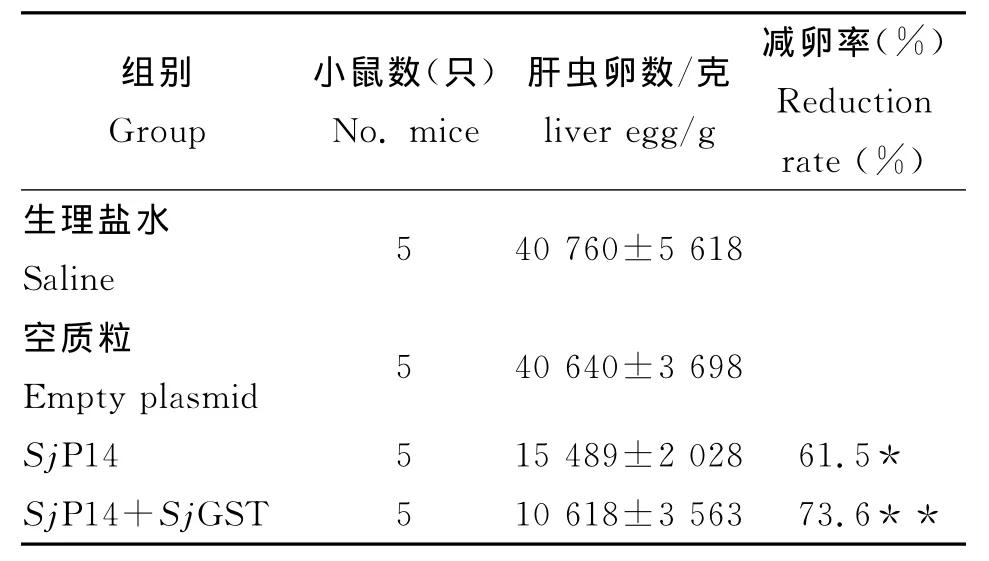
表2 各组小鼠的虫卵检获情况(±s)Tab.2 Reduction rate of liver egg in each group(±s)
与对照组比较:*:P<0.01,**:P<0.01Compared with control groups:*:P<0.01,**:P<0.01
?
3 讨 论
核酸疫苗能够把一个或几个编码目标抗原的cDNA片段克隆到真核表达载体内,并表达出近似天然的抗原,从而诱导出较强的体液和细胞免疫应答。DNA疫苗进入体内,少量被宿主细胞摄取后进入细胞核,在载体启动子的操纵下,抗原基因转录为mRNA,该mRNA又被胞浆粗面内质网上的核糖体翻译生成细胞质内蛋白质。少量表达的蛋白在细胞内被水解酶降解成8~12个氨基酸的短肽,这些短肽含有不同的抗原表位,相关蛋白通过转运进入内质网腔,与I型MHC分子的重链及β2-微球蛋白结合在一起,通过高尔基复合体转移出细胞质,定位于细胞表面,被CD+4T细胞识别,刺激MHCI型限制分子的CD+4细胞毒性T细胞产生抗原特异性CTL,对表达外源基因的细胞发挥细胞毒性作用[16]。
已进行与日本血吸虫疫苗相关的动物实验,获得了不少日本血吸虫抗原,但这些抗原只能起到部分保护作用,它们仍然没有达到致弱尾蚴保护作用的水平[12]。因此有必要继续寻找新的疫苗抗原分子,促进血吸虫疫苗研发的进程。
现已发现调宁蛋白具有很多生物学功能,包括(1)参与平滑肌收缩的调控;(2)参与细胞信号转导;(3)维持细胞骨架;(4)参与血管病变及肿瘤的基因调节。不管脊椎动物还是无脊椎动物在其生命活动当中调宁蛋白都发挥着重要作用。调宁蛋白样蛋白已经在许多无脊椎动物中被克隆和表征,包括最近报道的棘球绦虫、盘尾丝虫、秀丽小杆线虫及日本血吸虫等4种寄生虫[17-19]。目前已知的日本血吸虫疫苗的抗原免疫保护都没有达到50%水平,而旋盘尾丝虫的OV9M基因编码的碱性调宁蛋白样蛋白具有高度免疫原性,所以本实验选择日本血吸虫的碱性调宁蛋白样蛋白作为抗原,以观察该抗原的免疫保护力。结果表明,pcDNA3.1(+)-SjP14DNA 疫苗能诱导小鼠产生显著的抗日本血吸虫感染的保护性免疫作用,pcDNA3.1(+)-SjP14 +SjGST 联合应用其作用增强。与生理盐水组和空质粒组相比较,其减虫率和减卵率均有显著性差异。小鼠肝脏切片HE染色显示其肝细胞坏死、虫卵量、炎性细胞的浸润均明显减轻。本实验还发现特异性IgG1和IgG2a抗体水平均明显升高,以初次免疫后12w时最明显,攻击感染后有较明显下降,提示可能诱导了Thl/Tcl型和Th2/Tc2型混合型应答。通过以上分析提示SjP14有希望作为一种新的、有效的抗日本血吸虫感染的候选疫苗分子。
[1]Chitsulo L,Engels D,Montresor A,et al.The global status of schistosomiasis and its control[J].Acta Trop,2000,77(1):41-51.DOI:10.1016/S0001-706X(00)00122-4
[2]Department of International Cooperation,Ministry of Health,China.Schistosomiasis fact sheet[R].World Health Organization Bulletin,2008,404(2):13-14.(in Chinese)卫生部国际合作司国际合作处.血吸虫病的实况报道[R].世界卫生组织简报,2008,404(2):13-14.
[3]Special Programme for Research and Training in Tropical Diseases.Tropical disease research:progress 1975-94:highlights 1993-94:twelfth programme report of the UNDP/World Bank/WHO Special Programme for Research and Training in Tropical Diseases(TDR)[M].Geneva:World Health Organization,1995:77.
[4]Chen MG.Schistosomiasis in the world and its control progress[J].Chin J Schisto Control,2002,14(2):81-83.(in Chinese)陈铭刚.世界血吸虫病流行情况及防治进展[J].中国血吸虫病防治杂志,2002,14(2):81-83.
[5]Jiang Y,Jiang ZJ.Overview on drug research for schistosomiasis control[J].Chin J Schisto Control,2001,13(1):59-60.(in Chinese)江艳,蒋作君.血吸虫病防治药物研究概况[J].中国血吸虫病防治杂志,2001,13(l):59-60.
[6]Yuan HC,Zhang SJ,Liu ZL,et al.Research on epidemiological factors and optimization control strategy for schistosomiasis in lakeshore areas[J].Chin J Schisto Control,1995,7(4):1993-2001.(in Chinese)袁鸿昌,张绍基,刘志德,等.湖滩地区血吸虫病流行因素与优化控制策略的研究[J].中国血吸虫病防治杂志,1995,7(4),1993-2001
[7]Wu ZD,Zhang SJ,Pan BR,et asl.Reinfection withSchistosoma japonicumafter treatment with praziquantel in Poyang lake region,China[J].Southeast Asian J Trop Med Public Health,1994,25(1):163-169.
[8]Bergquist NR,Colley DG.Schistosomiasis vaccines:research to development[J].Parasitol Today,1998,14(3):99-104.DOI:10.1016/S0169-4758(97)01207-6
[9]Gryseels B.Human resistance toSchistosomainfection:Age or experiencef[J].Parasitol Today,1994,10(10):380-384.DOI:10.1016/0169-4758(94)90226-7
[10]Waine GJ,McManus DP.Schistosomiasis vaccine development--the current picture[J].Bioessay,1997,19 (5):435-443.DOI:10.1002/bies.950190511
[11]Zhang Z,Wu H,Chen S,et al.Association between IgE antibody against soluble egg antigen and resistance to reinfection withSchistosomiasis japonica[J].Trans R Soc Trop Med Hyg,1997,91(5):606-608.DOI:10.1016/S0035-9203(97)90047-X
[12]Bergquist NR,AI-Sherbiny M,Barakat R,et al.Blueprint for schistosomiasis vaccine development[J].Acta Trop,2002,82(2):183-192.DOI:10.1016/S0001-706X(02)00048-7
[13]Bergquist NR,Leonardo LR,Mitchell GF.Vaccine-linked chemotherapy:can schistosomiasis control benefit from an integrated approach[J].Trends Parasitol,2005,21 (3):112-117.DOI:10.1016/j.pt.2005.01.001
[14]Luo QL,Shen JL,Wang XL,et al.Immunodiagnosis of acute schistosomiasis using 26ku glutathione-S-transferase recombinant protein ofSchistosoma japonicum[J].Acta U Medicinalis Anhui,2005,40(6):491-494.(in Chinese)罗庆礼,沈继龙,汪学龙,等.重组日本血吸虫26ku谷胱甘肽-硫-转移酶的表达、纯化及其免疫特性分析用于急性血吸虫病免疫诊断[J].安徽医科大学学报,2005,40(6):491-494.
[15]Wang LW,Tang XN,Yao Y,et al.Construction,expression and identification of the eukaryotic expression vector carryingSchistosoma japonicumP14gene[J].Acta U Medicinalis Anhui,2011,46(4):321-324.(in Chinese)汪礼文,唐小牛,姚勇,等.日本血吸虫P14钙结合蛋白样蛋白基因真核表达载体的构建、表达和鉴定[J].安徽医科大学学报,2011,46(4):321-324.
[16]Simmonds RS,Sheaer MH,Kennedy RC.DNA vaccines-From principle to practice[J].Parasitol Today,1997,13(9):328-331.DOI:10.1016/S0169-4758(97)01106-X
[17]Martin RM,Gasser RB,Jones MK,et al.Identification and characterization of myophilin,a muscle-specific antigen ofE-chinococcus granulosus[J].Mol Biochem Parasitol,1995,70(1-2):139-148.DOI:10.1016/0166-6851(95)00020-2
[18]Irvine M,Huima T,Prince AM,et al.Identification and characterization of anOnchocerca volvuluscDNA clone encoding a highly immunogenic calponin-like protein[J].Mol Biochem Parasitol,1994,65(1):135-146.DOI:10.1016/0166-6851(94)90122-8
[19]Goetinck S,Waterston RH.TheCaenorhabditis elegansmuscle-affecting geneunc-87encodes a novel thin filament-associated protein[J].J Cell Biol,1994,127(1):79-93.
——以江苏省为例

