导入抗逆基因的转双抗虫基因741杨的获得1)
金 华 尚敏克 姜国斌
(大连民族学院,大连,116600)
杨树是世界上分布最广、适应性最强的树种,也是优良的水土保持植物[1]。通过基因工程技术对杨树进行抗逆性的遗传改良受到世界各国学者和研究人员的普遍关注[2-3]。近年来,在杨树基因工程研究中所涉及的外源基因主要包括用以清除活性氧的GSH基因[4]、液泡Na+/H+逆向转运蛋白基因At-NHX1[5]及甘露醇合成基因mtl-D[6]等,部分研究结果已证实,转基因植株增强了对干旱、低温或盐渍等逆境胁迫耐性。当然,在杨树的遗传转化中,转化成功与杨树的基因型、外植体以及转化条件等有很大关系[7-10]。
NDPK2基因主要编码植物核苷二磷酸激酶2(NDPK2)。近年来的研究表明,NDPK2与促分裂原蛋白激酶(MAPK)级联反应,结合 MAPK3和MAPK6[11],进而上调 POD、CAT、硫氧还蛋白、硫氧还蛋白还原酶和过氧化物还原酶等多种抗氧化酶基因的表达,调节细胞的氧化还原状态[12]。拟南芥核苷二磷酸激酶2基因(AtNDPK2)对大麦[13]、马铃薯[14]的遗传转化研究也表明,AtNDPK2基因的过量表达增强了作物对干旱或极端温度的忍耐性。At-NDPK2基因对作物的遗传转化具有重要的实践意义。但迄今为止,未见有关此基因在杨树中转化的报道。
转双抗虫基因741杨是河北农业大学林学院生物技术实验室和中国科学院合作,运用农杆菌介导法将Bt杀虫蛋白基因(BtCry1Ac)和慈菇蛋白酶抑制基因(AHPI),即双价抗虫基因同时转入优良毛白杨无性系741杨获得的转双抗虫基因无性系[15]。本试验旨在以转抗虫基因741杨为试验材料,通过对转化条件的优化,建立稳定的遗传转化体系,并采用农杆菌介导的转化方法,胁迫诱导型启动子SWPA2调控的AtNDPK2基因导入转双抗虫基因741杨,以期获得既抗虫且抗非生物胁迫能力强的转基因杨树新品系。
1 材料与方法
1.1 试验材料
供试杨树品种转基因741杨,由河北农业大学左永忠教授惠赠。继代培养1个月的无菌苗叶片外植体,用于再生体系优化及基因转化的材料。根癌农杆菌(Agrobacterium tumefaciens)菌株EHA105及质粒pCAMBIA2300,均由韩国生命工学研究院环境生命工学研究中心提供。含有目的基因的重组质粒载体,也由该中心构建,包含胁迫诱导型启动子SWPA2,并携带拟南芥核苷二磷酸激酶2(AtDNPK2)基因,筛选标记为潮霉素磷酸转移酶基因(hpt)。
1.2 外植体不定芽再生体系的优化
选取生长良好、健壮的继代培养试管苗,用解剖刀剪取叶片,在叶片一侧垂直主脉剪1个伤口,然后将其接种于附加不同质量浓度 6-BA(0.1、0.5、1.0、1.5 mg/L)和 IBA(0.05、0.10、0.20 mg/L)的 MS 培养基中,接种时叶正面朝上放置,下表皮与培养基接触。
每种培养基接种40个叶片(4个培养皿,每个培养皿接种10块片),培养温度(25±2)℃,光照强度2 500 lx,光照时间14 h/d。30 d后统计诱导不定芽分化的情况。
1.3 根的诱导
将长至3~4 cm的不定芽的单芽切下,转入未加任何激素的MS或1/2MS生根培养基中,30 d后统计结果。
选择转基因741杨生根诱导效果好的培养基作为基本培养基,附加不同质量浓度的IBA(0、0.02、0.05、0.10、0.20 mg/L)和 NAA(0、0.02、0.05、0.10、0.20 mg/L),30 d后分别统计生根率。每个处理接种10瓶,每瓶3个外植体。
1.4 影响转化效率因素的确定
从平板上挑取单菌落,接种于含10 mL附加抗生素的YEP液体培养基(pH为7.2)中,在恒温摇床上,于28℃、180~200 r/min震荡培养至对数生长期(OD6000.6~OD6000.8)。取1 mL菌液分别加至20 mL新鲜液体YEP培养基中(不含抗生素)继续震荡6 h左右,使OD600为0.5左右,作为工程菌侵染悬浮液。
共培养时间设5 个梯度:2、3、4、5、6 d。菌液中与共培养培养基中的pH值为5.2、5.8,并加入 AS(200 μmol/L)。转基因741杨中已携带卡那霉素筛选基因,因此,本试验所使用的质粒以潮霉素为筛选标记基因。潮霉素的质量浓度设为 0、1、2、3、5、7、10、15 mg/L。本试验中每个处理选用100个外植体。试验重复3次,每次每个处理10皿,每个培养皿10个外植体。
1.5 PCR方法对转基因毛白杨的检测
采用CTAB法[16]提取5株转基因植株的DNA,以pCAMBIA1300为阳性对照,以未转化植株叶片的DNA为阴性对照。上游引物:5'-ATTTATCGGCAAGGTGGAGGTT-3',下游引物:5'-CCCGGTGAGGTGATTTGAA-3'。反应体系为:94℃ 1 min,54℃ 1 min,72℃ 2 min,35个循环;最后在72℃下继续延伸10 min。扩增产物用0.8%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 不同培养基对不定芽的诱导
在芽和根形成的过程中,激素的浓度及配比起着关键的作用。本试验选用了6-BA和IBA进行组合,诱导叶片不定芽的形成。
从表1 可看出:6-BA1.0 mg/L+IBA0.1 mg/L组合诱导不定芽效果最好,形成的不定芽数目多,分化率也高,达到了92.5%,而且不定芽生长健壮;6-BA 1.5 mg/L+IBA0.2 mg/L处理虽然不定芽分化最早,但不定芽数目和分化率都不如6-BA1.0 mg/L+IBA0.1 mg/L处理。因此,转基因741杨叶片外植体最佳不定芽诱导培养基选为:MS+6-BA1.0 mg/L+IBA0.1 mg/L。

表1 不同激素对不定芽生成的影响
2.2 不同激素对生根的影响
将长至3~4 cm的不定芽单芽切下,转入MS或1/2MS生根培养基中,30 d时统计试验结果发现:1/2MS培养基生根诱导率达到了86.67%,并且主根数远远多于MS培养基诱导的主根数。无机离子减半的MS培养基有利用根的诱导,这与祁春芳等[17]的研究结果是一致的。
本试验以1/2MS为基本培养基,附加不同质量浓度的IBA或NAA进行生根诱导试验,结果表明:当IBA的质量浓度为0.05 mg/L时,生根诱导率为100%,并且根粗壮、次生根多。故选择1/2MS附加0.05 mg/L的IBA为生根培养基诱导转基因741杨无菌苗的生根。
2.3 潮霉素质量浓度的确定
筛选培养基潮霉素的质量浓度设定为1、2、3、5、7、10、15 mg/L,3 周后进行统计,结果如表 2。当潮霉素的质量浓度为3 mg/L时,叶片全部变黄,部分坏死且不能分化出芽。因此,认为3 mg/L为合适的潮霉素筛选质量浓度。

表2 不同质量浓度的潮霉素对741毛白杨叶片分化的影响
2.4 共培养时间对转化的影响
最佳共培养时间确定的目的是既要保证外植体能与农杆菌很好地共生,又要不使农杆菌在后续培养中难于被抑制。试验结果表明,共培养2、3 d后进行愈伤诱导,抗性愈伤组织诱导率并无显著差异,均在28%左右。但在共培养4 d及长于4 d的情况下,农杆菌会过度繁殖,导致外植体出现软腐现象,从而失去再生出愈伤组织的能力。因此,选择3 d为最佳共培养时间。
2.5 乙酰丁香酮的加入以及pH值对转化的影响
本试验在农杆菌菌液和共培养培养基中加入乙酰丁香酮并且调节了不同的pH值,研究其对转化效果的影响。
从表3中可以看出,是否加入乙酰丁香酮(AS),以及不同的pH值对潮霉素抗性芽诱导率有差异。其中处理C5(共培养培养基加入乙酰丁香酮、pH值调到5.2)诱导潮霉素抗性芽效果最显著,这与文献[9]的研究结果一致。可能由于共培养过程是Ti质粒实现T-DNA的转化时期,在这个过程中加入乙酰丁香酮使与肿瘤形成有关的Vir区基因处于高度活化状态,提高了Ti质粒转化率。效果最不显著的是处理C4,即在菌液中加入了乙酰丁香酮,并将共培养培养基调到pH=5.2。同时能看出,共培养培养基pH=5.2时要比pH=5.8时潮霉素抗性芽的诱导率高。AS加在农杆菌和外植体共培养的培养基中诱导率并不是最高,这可能是由于AS诱导剂剂量过大所致。

表3 不同pH值以及乙酰丁香酮对产生潮霉素抗性芽的影响
2.6 转化和筛选
一个高效的组培再生系统和遗传转化体系是植物基因工程成功的先决条件。文中采用优化的741毛白杨无性系叶片最适再生转化系统为:不定芽筛选培养基为 MS+6-BA1.0 mg/L+IBA0.1 mg/L+Cef400 mg/L+Hyg3 mg/L;转化生根植株培养基为1/2MS+IBA0.05 mg/L+Cef400 mg/L+Hyg5 mg/L。按此方法,转基因741杨叶片不定芽转化频率可达40%,得到了抗潮霉素转基因741杨无性系5株。
2.7 PCR 检测
对所得5株潮霉素抗性转基因741杨无性系均作PCR检测,其中1株呈阳性反应。PCR检测结果见图1。
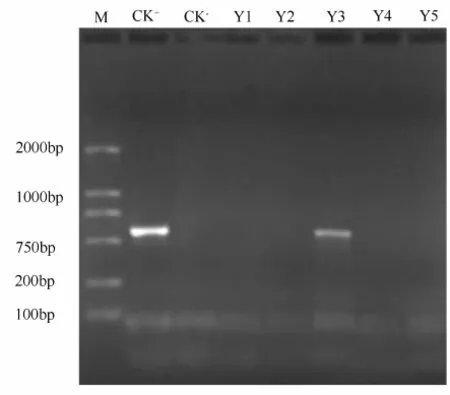
图1 转AtNDPK2基因741毛白杨基因组PCR检测
电泳分析表明:在检测的5株抗性植株中,有1个抗性植株经过PCR扩增后得到1条约为544 bp的片段,该片段大小与AtNDPK2基因大小基本一致,而未经过转基因试验的组培苗植株基因组中没有扩增出对应片段,因此,可以初步说明外源AtNDPK2基因已经整合到转基因741杨基因组中。
3 结论与讨论
本研究以转双抗虫基因741杨的试管苗叶片为外植体,在 MS加入 1.0 mg/L 6-BA 和 0.1 mg/L IBA为不定芽诱导培养基,以及1/2MS加入0.05 mg/L IBA为生根培养基,建立了高效快速的转基因741杨组培再生体系。并利用农杆菌EHA105介导法将构建好的植物表达载体pCAMBIA2300转化转基因741杨,获得了再生植株。对影响转基因741杨遗传转化因素进行的研究结果表明:最佳共培养时间为3 d;潮霉素的最适筛选质量浓度为3 mg/L;共培养培养基加入乙酰丁香酮、pH=5.2时,诱导抗性芽效果最为显著。
成功的遗传转化首先依赖于良好的植物再生系统的建立。郑均宝[18]等以741杨的叶片为外植体,采用不同质量浓度组合的BA和NAA对741杨的叶片再生体系进行了研究,结果表明,不定芽诱导的最佳培养基为6-BA3.0 mg/L+NAA 0.3 mg/L,最佳生根培养基为 1/2MS+IBA0.3 mg/L;于学宁[19]建立的741杨的再生体系为:不定芽诱导的最佳培养基为6-BA1.0 mg/L+NAA0.1 mg/L,最佳生根培养基为MS+IBA0.3 mg/L。本试验在诱导不定芽时用IBA代替了NAA,也得到了较高的诱导率,研究结果表明,未转基因741杨与已转双抗虫基因741杨在叶片离体再生方面并不存在太大的差异。试验中还发现,pH值对抗性芽诱导影响也较大。Horford等[20]研究表明,AS的诱导效果与培养基的pH值有关,pH值为5.2时转化效果最好。本试验结果表明,在培养基pH为5.8时,加入AS对转化效果影响不显著。而将pH值调至5.2后,加入AS可明显地促进转基因741杨的遗传转化。这可能是培养基的pH值较低时有利于农杆菌Vir区基因的活化,活化的Vir区基因易将目的基因导入切口处的细胞,从而提高了转基因741杨的遗传转化效率。
由于转基因741杨植株内已含有抗卡那霉素筛选标记基因NPT-II,所以本试验将潮霉素磷酸转移酶基因连接T-DNA上作为筛选标记基因。经过含有潮霉素的培养基上的选择并获得的抗潮霉素再生植株,再经过PCR检测表现阳性者,初步确定为转AtNDPK2基因的再生植株。这类植株正在扩繁,准备抗逆试验并栽培在试验地上对植株的形态学和经济性状进行观察,同时进行进一步的分子生物学分析。
[1]尹伟伦.国际杨树研究新进展[M].哈尔滨:东北林业大学出版社,2001.
[2]卢孟柱,胡建军.我国转基因杨树的研究及应用现状[J].林业科技开发,2006,20(6):1-4.
[3]贾士荣,曹东孙.转基因植物[J].植物学通报,1992,9(2):3-15.
[4]Gallardo F,Fu J,Canton F R,et al.Expression of a conifer glutamine synthetase gene in transgenic poplar[J].Planta,1999,210(1):19-26.
[5]姜超强,郑青松,刘兆普,等.转AtNHX1基因杨树Tr品系的耐盐性研究[J].植物生态学报,2010,34(5):563-570.
[6]孙仲序,杨红花,崔得才,等.转基因杨树的抗盐性分析[J].生物工程学报,2002,18(4):481-485.
[7]陈颖,李强,李玲,等.抗虫转基因欧洲黑杨的Western印迹法分析[J].林业科学,1996,32(3):274-276.
[8]陈颖,韩一凡,李玲,等.苏云金杆菌杀虫晶体蛋白基因转化美洲黑杨的研究[J].林业科学,1995,31(2):97-103.
[9]郝贵霞,朱祯,朱之悌,等.豇豆蛋白酶抑制剂基因转化毛白杨的研究[J].植物学报,1999,41(12):1276-1282.
[10]李明亮,张辉,胡建军,等.转Bt基因和蛋白酶抑制剂基因杨树抗虫性的研究[J].林业科学,2000,36(2):93-97.
[11]Moon H,Lee B,Choi G,et al.NDP kinase 2 interacts with two oxidative stress-activated MAPKs to regulate cellular redox state and enhances multiple stress tolerance in transgenic plants[J].Proceedings of the National Academy of Sciences,2003,100(1):358-363.
[12]Yang K A,Moon H,Kim G,et al.NDP kinase 2 regulates expression of antioxidant genes inArabidopsis[J].Proceedings of the Japan Academy,Series B,2003,79B(3):86-91.
[13]Um M O,Park T I,Kim Y J,et al.Particle bombardment-mediated transformation of barley with anArabidopsisNDPK2 cDNA[J].Plant Biotechnology Reports,2007,1(2):71-77.
[14]Tang L,Kim M D,Yang K S,et al.Enhanced tolerance of transgenic potato plants overexpressing nucleoside diphosphate kinase 2 against multiple environmental stresses[J].Transgenic Research,2008,17(4):705-715.
[15]田颖川,郑均宝,李常青,等.转双抗虫基因杂种741毛白杨的研究[J].植物学报,2000,42(3):263-268.
[16]Porebski S,Bailey L G,Baum B R.Modification of a CTAB DNA extraction protocol for plants containing high polysaccharide and polyphenol components[J].Plant Molecular Biology Reporter,1997,15(1):8-15.
[17]祁春芳,郑智礼.白杨派杨树组培技术研究[J].山西林业科技,2000(4):21-23.
[18]郑均宝,张玉满,杨文芝.741杨离体叶片再生及抗虫基因转化[J].河北农业大学学报,1995,18(3):20-25.
[19]于学宁,曹帮华,曹玉翠,等.741杨离体快繁和叶片再生体系的建立[J].山东科学,2008,21(1):35-38.
[20]Holford P,Hernandez N,Newbury H J.Factors influencing the efficiency of T-DNA transfer during co-cultivation ofAntirrhinum majuswithAgrobacterium tumefaciens[J].Plant Cell Reports,1992,11(4):196-199.

