3株鸡大肠埃希菌地方分离株I型菌毛的免疫原性
王 东,王旭青,王建波,蒲建明,丁林军,刘军红,张燕飞,殷 东,马全鑫,扈登强
(1.宁夏大学西部特色生物资源保护与利用教育部重点实验室,宁夏银川750021;2.宁夏大学外国语学院2009级英语师范专业,宁夏银川750021;3.银川市农业局,宁夏银川750001;4.吴忠市畜牧局,宁夏吴忠751100;5.宁夏博奥药业有限公司,宁夏银川750021)
大肠杆菌病是鸡的主要传染病之一,给养鸡业造成严重的经济损失。目前鸡大肠杆菌病的主要防治手段为药物防治和免疫接种。药物防治虽然有一定的防治效果,但长期使用会产生耐药菌株并导致家禽产品中出现药物残留;免疫接种主要使用菌体灭活疫苗,对相同血清型鸡大肠埃希菌所致疾病效果良好,但由于大肠埃希菌的血清型众多,不同地区不同鸡场的优势血清型不尽相同[1-3],因而菌体灭活疫苗的通用性较差。国内外已有研究报道,从致病性大肠埃希菌中提取的I型菌毛具有良好的免疫原性,能抵抗同源菌株的攻击[4-6]。本研究提取宁夏地区鸡大肠埃希菌3种优势血清型O15、O78、O18菌株的I型菌毛,分别制成菌毛亚单位疫苗,免疫接种雏鸡,通过攻毒试验和抗体水平检测,评价天然I型菌毛亚单位疫苗的免疫效果,为研制鸡大肠埃希菌新型疫苗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株 3 株鸡大肠埃希菌 ZW2(O15)、LXY1(O78)、FWM1(O18),均为宁夏地区优势血清型菌株,由宁夏大学西部特色生物资源保护与利用教育部重点实验室从宁夏地区发病鸡场分离并鉴定。
1.1.2 试验用动物 1日龄海塞克斯雏鸡,购于银川市某种鸡场。
1.1.3 培养基及试剂 营养肉汤、营养琼脂、麦康凯培养基为杭州天和微生物试剂有限公司产品;弗氏完全佐剂、弗氏不完全佐剂、牛血清白蛋白、HRP标记兔抗鸡IgG为Sigma公司产品。
1.2 方法
1.2.1 细菌培养 取鸡大肠埃希菌 ZW2(O15)、LXY1(O78)、FWM1(O18)菌株,分别接种麦康凯培养基,37℃培养20h后,挑取典型菌落接种营养肉汤培养基,37℃振荡培养72h,收集菌液备用。
1.2.2 菌毛提取 将收集的菌液4 000r/min离心20min,PBS悬浮沉淀,置60℃水浴作用30min,室温磁力搅拌30min,8 000r/min离心20min,收集上清液,加饱和硫酸铵溶液,4℃过夜;14 000r/min离心20min,PBS悬浮沉淀,放透析袋中4℃透析;将透析液10 000r/min离心20min,取上清液保存备用。采用紫外分光光度法测定菌毛蛋白浓度,电镜观察和SDS-PAGE鉴定菌毛[7-8]。
1.2.3 亚单位疫苗制备 用PBS将菌毛蛋白浓度调整为600μg/mL,按1∶1的比例与弗氏佐剂混合,按常规方法乳化成弗氏佐剂疫苗,4℃保存备用[9]。
1.2.4 无菌检验 将制备的亚单位疫苗分别接种普通肉汤、营养琼脂平板和麦康凯培养基,37℃培养24h~48h,观察是否有细菌生长。
1.2.5 安全性试验 将制备的亚单位疫苗皮下注射7日龄雏鸡10只,2.0mL/只,观察10d,记录试验鸡精神、运动和食欲等生理活动是否正常。
1.2.6 动物免疫 1日龄雏鸡隔离饲养至7日龄时,分为13组,每组10只。1、5、9组免疫O15菌毛疫苗;2、6、10组免疫 O78菌毛疫苗;3、7、11组免疫 O18菌毛疫苗;4、8、12组为攻毒对照组;13组为阴性对照组。首次免疫使用弗氏完全佐剂疫苗,免疫剂量为0.5mL/只,皮下注射。首次免疫后间隔7d,进行第二次免疫,使用弗氏不完全佐剂疫苗,免疫剂量与首次免疫相同。
1.2.7 攻毒试验 第二次免疫后间隔14d,用鸡大肠埃希菌普通肉汤24h培养物进行攻毒,攻毒途径为肌肉注射。1组~4组接种O15菌液,攻毒剂量5.7×109cfu/只;5组~8组接种O78菌液,攻毒剂量6.4×109cfu/只;9组~12组接种 O18菌液,攻毒剂量7.2×109cfu/只。攻毒后,观察各组试验鸡发病与死亡情况。攻毒后第7d,扑杀所有存活试验鸡,观察试验鸡肝脏、心包及气囊的病变。根据病变程度,分为0~4级。0级:没有病变;1级:气囊、心包浑浊,轻度肝周炎;2级:浆液性气囊炎、心包炎,中度肝周炎;3级:纤维素性气囊炎、心包炎、肝周炎;4级:严重的纤维素性气囊炎、心包炎、肝周炎[10-11]。
1.2.8 抗体测定 试验鸡在7、14、21、28日龄时翅静脉采血,每组5只,每只1mL,分离血清后备用。采用间接ELISA方法检测鸡大肠埃希菌天然I型菌毛亚单位疫苗免疫鸡的抗体水平[11]。
2 结果
2.1 疫苗的无菌检验结果
接种疫苗的普通肉汤、营养琼脂平板和麦康凯培养基,37℃培养48h后,无细菌生长。
2.2 疫苗的安全性检验结果
接种亚单位疫苗的雏鸡,观察10d,精神、运动和食欲等生理活动未见异常表现。
2.3 疫苗的攻毒试验结果
免疫组和阳性对照组分别攻击3株鸡大肠埃希菌强毒菌液后,试验鸡陆续出现死亡,剖检发现有不同程度的心包炎、气囊炎、肝周炎。攻毒后第7d,扑杀所有存活试验鸡,观察病变等级。天然I型菌毛亚单位疫苗免疫保护试验结果见表1。
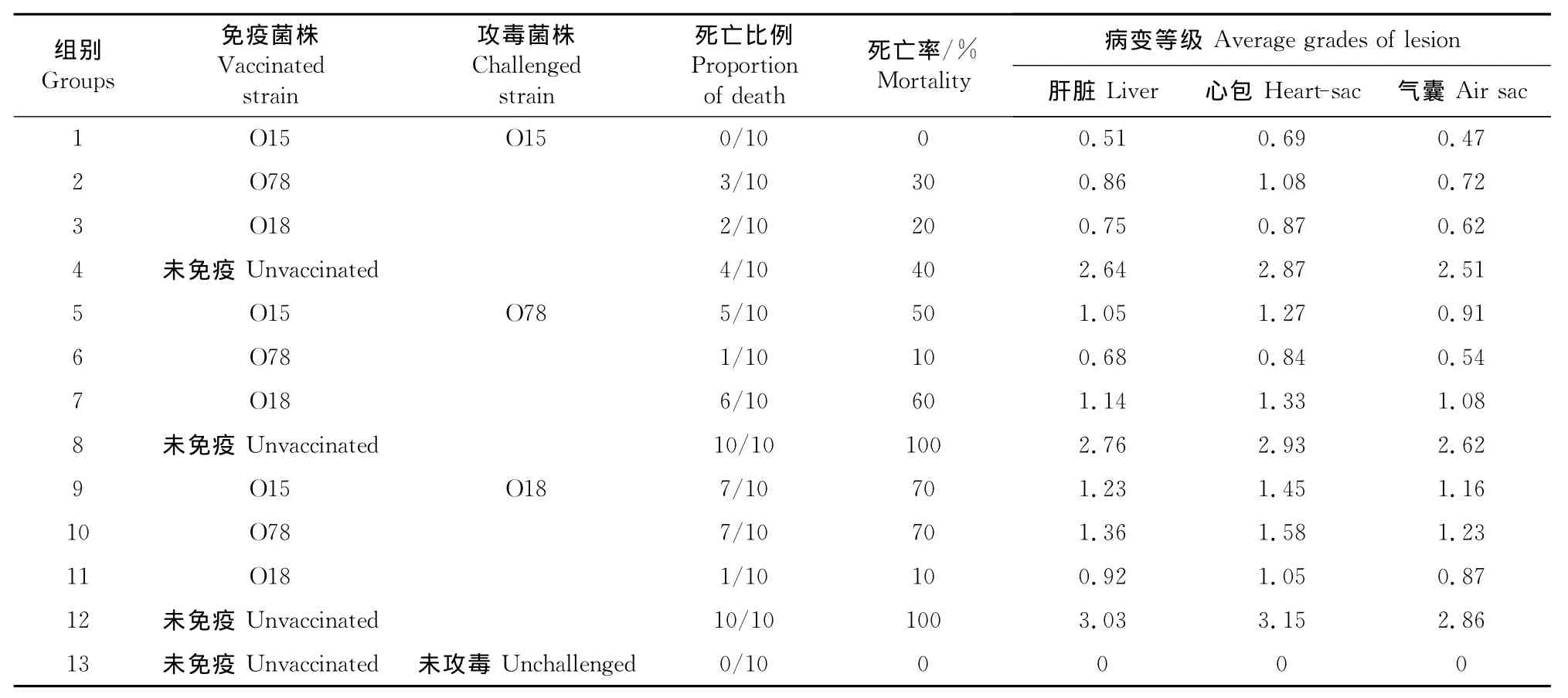
表1 天然I型菌毛亚单位疫苗免疫保护试验结果Table 1 Immune protection of the subunit vaccine of natural type 1pili of avian E.coli
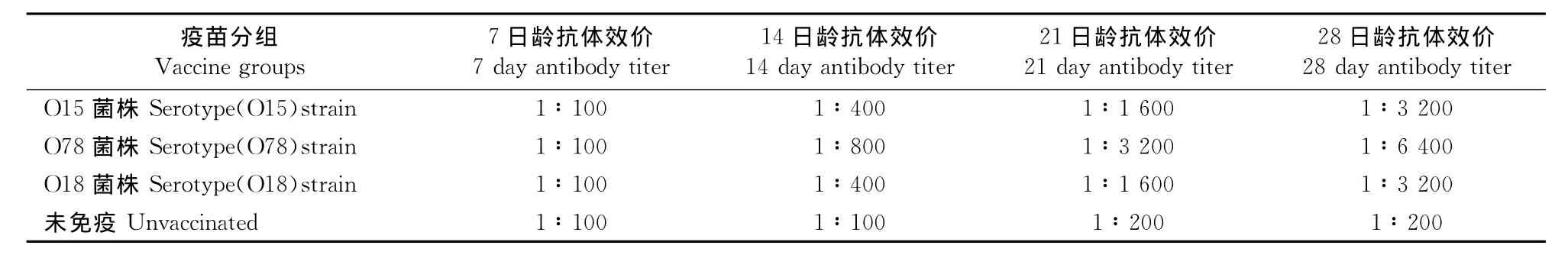
表2 鸡血清ELISA抗体效价测定结果Table 2 Serum antibody titers of vaccinated chickens detected by ELISA
从表1得知,I型菌毛不仅具有良好的免疫原性,而且具有一定的交叉保护作用。免疫组鸡死亡率为0~70%,攻毒对照组鸡死亡率为40%~100%,免疫组鸡的死亡率明显低于未免疫鸡;免疫鸡用同源菌株攻毒后死亡率为0~10%,用异源菌株菌株攻毒后死亡率为20%~70%,阴性对照组鸡死全部存活,说明鸡大肠埃希菌I型菌毛同源菌株之间免疫保护率高于异源菌株,异源菌株之间有一定交叉保护作用。剖检攻毒死亡鸡和存活鸡,观察病变,免疫组鸡病变程度显著轻于未免疫鸡。
2.4 抗体水平测定结果
试验鸡免疫接种天然I型菌毛亚单位疫苗后,在7、14、21、28日龄时采血,采用间接ELISA方法检测抗体效价(表2)。由表2看出,天然I型菌毛疫苗首次免疫后7d,雏鸡血清内出现特异性抗体;随着免疫次数的增加和免疫日龄的延长,抗体水平相应提高。
3 讨论
I型菌毛是禽大肠埃希菌的重要致病因子,在感染过程中,可与禽呼吸道黏膜上皮细胞表面的相应受体以一种“锁-钥匙”的方式特异性结合;结合后的E.coli不易被机体清除,很容易侵入呼吸道深部增殖,从而在致病过程中发挥重要作用[12-13]。I型菌毛可诱导机体产生抗体,此抗体与入侵细菌菌毛结合,封闭菌毛上受体结合位点,阻断感染的第一个环节,从而防止禽大肠杆菌病的发生[14]。因此,将I型菌毛制成亚单位疫苗可以有效防制大肠杆菌病的侵袭。戴鼎震等用含I型菌毛的O1、O78及O88菌株,提取菌毛制备单价菌毛油乳苗,免疫接种1日龄雏鸡后经气囊攻毒,免疫鸡用同源菌株攻毒后死亡率12.5%,用异源菌株攻毒后死亡率37.5%~62.5%[9]。隋兆峰等[7]提取 O78和O24菌株的菌毛制备单价菌毛油乳苗,接种1日龄雏鸡后于4周龄攻毒,同源菌株攻毒后死亡率8.33%~16.67%,用异源菌株攻毒出现8.33%~33.33%的死亡率。本研究选择宁夏地区的3个优势血清型O15、O78、O18菌株,大容量培养后提取I型菌毛,制备天然菌毛亚单位油佐剂疫苗。分别于7日龄和14日龄时两次免疫接种,28日龄时攻毒;采用间接ELISA方法测定免疫鸡抗体水平。试验结果表明,未免疫鸡的死亡率40%~100%,免疫鸡用同源菌株攻毒后死亡率0~10%,用异源菌株攻毒后死亡率20%~70%;免疫组鸡在肝脏、心包和气囊的病变程度显著轻于未免疫鸡。上述研究结果说明,鸡大肠埃希菌I型菌毛不但对同源菌株具有良好的免疫原性,而且对异源菌株具有一定的交叉保护作用。
对疫苗的免疫效果进行有效评估是正确衡量免疫原的关键因素之一,对于菌毛亚单位疫苗而言,除了做免疫保护性试验外,还应该从体液免疫方面检测疫苗的免疫效果。李晋红等提取O2菌株菌毛后制备蜂胶疫苗,免疫雏鸡后采用微量凝集试验检测抗体消长情况,免疫后2d检测到抗体,6d抗体达到较高水平[10]。王辉平等提取O78菌株菌毛后制备油佐剂疫苗,免疫雏鸡后采用ELISA方法检测抗体消长情况,一免后4d后出现抗体,14d后抗体达较高水平[11]。本研究应用提取的菌毛亚单位疫苗免疫接种雏鸡,免疫后7、14、21d时分别采血,采用间接ELISA方法检测抗体水平,试验结果显示,首次免疫后7d,雏鸡血清内出现抗体;免疫后21d时的抗体水平高于14d,免疫后14d时的抗体水平高于7d。上述研究结果表明,鸡大肠埃希菌天然菌毛蛋白能够刺激雏鸡免疫系统产生抗体,并且抗体水平变化情况符合抗体产生的一般规律。
鸡大肠埃希菌的菌毛提取方法主要有热敏法和匀浆法。热敏法对温度和加热时间要求严格,温度过高以及加热时间过长都可能导致菌毛变性失活;通常采用60℃加热20min~30min提取菌毛,能保持菌毛蛋白抗原活性;隋兆峰等采用此方法提取I型菌毛[7]。匀浆法一般要求控制好切割速度和温度,切割速度过高,可能破坏蛋白质的完整结构,而且在切割过程中会产生大量的热量;切割速度过低,无法使菌毛有效脱落;一般要求冰浴条件下,10 000r/min间歇匀浆10min~20min;戴鼎震等应用该方法提取I型菌毛[9]。由于热敏法提取较匀浆法更为方便,因此,本研究采用热敏法提取鸡大肠埃希菌I型菌毛并获得成功。
[1]马兴树,朱美霞,王 斌,等.河北省南部鸡肝周炎大肠杆菌的分离及血清型鉴定[J].中国农学通报2009,25(1):12-16.
[2]李先磊,吕点点,刘立超,等.湖南省岳阳市鸡源性大肠埃希菌血清型鉴定[J].安徽农业科学,2009,37(26):12590-12591.
[3]吴华俊,任 文,周梅霞,等.扬州地区鸡病原性大肠埃希菌的分离与鉴定[J].现代农业科技,2009(15):306-307.
[4]Gyimah J E,Panigrahy B.Immunogenicity of an oil-emulsifiedEscherichiacoli(serorype O1)pili vaccine in chickens[J].Avian Dis,1985,29:1078-1083.
[5]甘黎明,蒋加进,陈钟鸣,等.鸡大肠杆菌重组1型菌毛疫苗的免疫原性[J].安徽农业科学,2011,39(36):22346-22347.
[6]水小溪,李寒鸣,蔡 乐,等.鸡致病性E.coliO24基因工程包涵体疫苗的制备及免疫原性[J].河北师范大学学报:自然科学版,2010,34(1):103-107.
[7]隋兆峰,刘文强,范伟兴,等.鸡致病性大肠杆菌I型菌毛交叉保护性研究及其结构基因FimA的序列分析[J].中国预防兽医学报,2003,25(6):440-444.
[8]焦利敏,廖学品,石 碧.紫外分光光度法下直接测定蛋白质溶液的浓度[J].化学研究与应用,2007,19(5):562-566.
[9]戴鼎震,郑明球,恽时锋.鸡大肠杆菌I型菌毛亚单位苗交叉保护的初步研究[J].畜牧与兽医,1999,31(5):1-2.
[10]李晋红,林维庆,黄淑坚.鸡病原性大肠杆菌(O2)亚单位疫苗的研究[J].华南农业大学学报,1995,16(3):72-78.
[11]王辉平,张中直,甘孟侯.鸡病原性大肠杆菌(血清型O78)纤毛亚单位苗免疫原性的研究[J].畜牧兽医学报,1994,25(2):174-179.
[12]Beachey E H.Bacterial adherence:Adhesin-receptor interactions mediating the attachment of bacteria to mucosal surfaces[J].Infect Dis,1981,143:325-345.
[13]Vidotto MC,Navarro HR,Gaziri LC.Adherence pili of pathogenic strains of avianEscherichiacoli[J].Vet Microbio1,1997,59:79-87.
[14]Gyimah J E,Panigrahy B,Williams J D.Immunogenicity of anEscherichiacolimultivalent pilus vaccine in chickens[J].Avian Dis,1986,30(4):687-689.

