以葡萄糖和木糖为双底物生物合成乙偶姻的条件优化
张燎原,洪欲强,陈 双,胡开辉
(福建农林大学生命科学学院,福建 福州 350002)
乙偶姻(Acetoin, AC)又名3-羟基丁酮,广泛存在于玉米、葡萄、可可、苹果、香蕉、麦芽、动物组织中,也是多种微生物糖代谢的中间产物[1]。因其具有令人愉快的奶油香味,主要用于奶油、乳品、酸奶和草莓型等香料的生产,我国GB 2760-1986规定允许食用[2]。此外,乙偶姻还可以作为一种C4平台化合物,广泛应用于众多行业,2004年美国能源部将其列为30种优先开发利用的平台化合物之一[3]。
乙偶姻的合成方法有微生物法和化学法,与化学法相比,微生物法因原料可再生、反应条件温和、环境友好等优点而备受关注[4,5]。自然界中有许多微生物能够合成乙偶姻,主要包括克雷伯氏菌属(Klebsiella)、肠杆菌属(Enterobacter)、芽孢杆菌属(Bacillus)、沙雷氏菌属(Serratia)以及乳球菌属(Lactococcus)等[6~9]。其中芽孢杆菌属因安全及产量高被学者们广泛研究,如Bacillussubtilis、Bacilluslicheniformis、Paenibacilluspolymyxa等[10~12],这些菌株虽然在产量上已获得提高,但因成本高仍然难以实现工业化生产。目前报道的乙偶姻生产菌基本都是以葡萄糖为碳源,因此,寻找更廉价的生产原料及筛选能高效利用这些廉价原料的菌株具有重要意义。
作者在此筛选到一株能利用木糖和葡萄糖作为双底物产乙偶姻的多粘芽孢杆菌,并对该菌株产乙偶姻的培养条件和培养基组分进行了优化,以期获得高产量的乙偶姻。
1 实验
1.1 培养基
筛选培养基(g·L-1):木糖 20,NaCl 0.5,MgSO40.5,(NH4)2SO42,KH2PO40.5,琼脂粉20,pH 值7.0。
LB培养基(g·L-1):蛋白胨 10,酵母粉 5,NaCl 10,pH 值7.0。
种子培养基(g·L-1):葡萄糖10,酵母粉1,蛋白胨2,(NH4)2SO46,KH2PO410,NaCl 0.5,MgSO40.5,pH 值7.0。
初始发酵培养基(g·L-1):葡萄糖40,木糖20,蛋白胨5,酵母粉10,KH2PO40.5,pH 值7.2。
1.2 菌株筛选
采集福建农林大学中华植物园土壤。称取1 g土壤溶于50 mL无菌水中,漩涡振荡5 min,80 ℃水浴中静置30 min以获得菌株,梯度稀释,涂布到固体筛选培养基中37 ℃培养48 h,挑单菌落于种子培养基中37 ℃培养12 h。保藏菌种,同时分别转接至装有20 mL初始发酵培养基的250 mL三角瓶中,37 ℃、150 r·min-1下发酵24 h,取样,通过VP(Voges-Proskauer)实验定性分析单菌落是否产乙偶姻,对产乙偶姻的样品采用气相色谱进行定量分析,确定乙偶姻产量最高的菌株。
1.3 菌株16S rDNA鉴定
将乙偶姻产量最高的菌株接种至LB液体培养基中,于37 ℃摇床培养12 h,离心收集菌体,采用基因组提取试剂盒(百泰克生物技术有限公司)提取基因组DNA。
以基因组DNA为模板,采用通用引物(16S1:AGAGTTTGATCCTGGCTCAG和16S2:AAGGAGGTGATCCAGCCGCA)进行PCR扩增反应,反应体系为:模板DNA 2.0 μL,10×PCR buffer (含20 mmol·L-1MgCl2) 5 μL,DNA聚合酶(5 U·μL-1) 1.0 μL,dNTPs(10 mmol·L-1) 1.0 μL,引物(10 mmol·L-1)各2 μL,ddH2O 37.0 μL,总体积为50 μL。反应条件为:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1.5 min,30个循环;72 ℃ 10 min。
PCR产物经回收后进行商业测序,测序结果在NCBI数据库中进行Blast比对,并结合生理生化特征鉴定菌株。
1.4 培养条件优化
以初始发酵培养基为基础发酵培养基,在转速为150 r·min-1的条件下,分别对培养温度、pH值、装液量和接种量(体积比,下同)进行优化(培养温度分别控制在28 ℃、30 ℃、34 ℃、37 ℃、40 ℃;培养基pH值分别控制在5.0、6.0、7.0、8.0、9.0;装液量分别为在250 mL三角瓶中装10 mL、15 mL、20 mL、25 mL、30 mL;接种量分别控制在1%、3%、5%、7%、9%),发酵时间为24 h,取样离心,取上清液-20 ℃保存待测。
1.5 培养基组分优化
综合已报道对乙偶姻生物合成影响较大的培养基组分,选择葡萄糖-木糖(2∶1,质量比)、蛋白胨、酵母粉、MnSO4、FeSO4、KH2PO4和乙酸钠等7个组分进行PB(Plackett-Burman)实验,从中筛选对乙偶姻合成具有显著影响的组分,在此基础上,采用响应面法(RSM)确定具有显著影响组分的最佳浓度,培养基组分优化发酵时间为48 h。
1.6 分析与检测
菌体浓度:以发酵液在600 nm波长下的吸光度OD600来表征。
发酵液中葡萄糖和木糖浓度:取上清液适度稀释,采用葡萄糖检测试剂盒(上海捷门生物技术公司)检测葡萄糖浓度,采用地衣酚法测定木糖浓度[13]。
乙偶姻浓度:采用Aglient GC9860型气相色谱仪测定。色谱柱采用毛细管柱DB-5,采用FID氢火焰检测器,氮气作为载气,流速为1 mL·min-1,柱温为50 ℃保留1.5 min,然后25 ℃·min-1程序升温到180 ℃保留10 min,进样口温度为215 ℃,检测器温度为245 ℃。上清液用乙酸乙酯萃取,进样,最后根据标准曲线计算乙偶姻浓度[14]。
2 结果与讨论
2.1 菌株筛选
固体筛选培养基平板中长出15个单菌落,挑取单菌落接种至初始发酵培养基中培养后,经VP实验验证共有10株菌呈阳性,表明从土壤中筛选到10株产乙偶姻的菌株。采用气相色谱对10株乙偶姻产生菌进行定量分析,结果如图1所示。
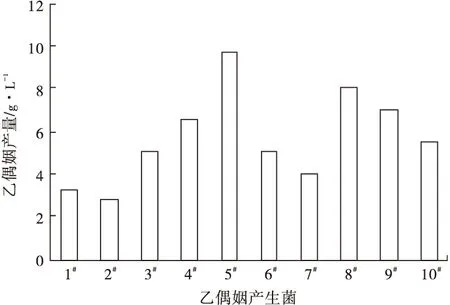
图1 乙偶姻产生菌产乙偶姻比较
从图1可以看出,菌株5#乙偶姻产量最高,为9.69 g·L-1。因此,采用该菌株进行后续的培养条件和培养基组分优化研究。
2.2 16S rDNA分子鉴定(图2)
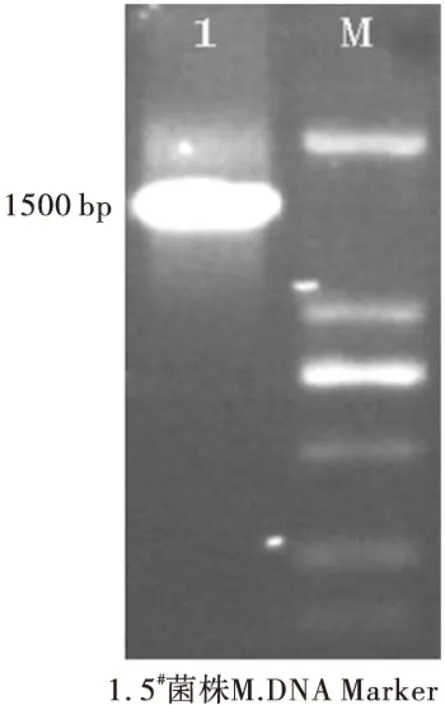
图2 5#菌株的16S rDNA分子鉴定
从图2可以看出,5#菌株经通用引物扩增和琼脂糖凝胶电泳,在约1500 bp的位置出现了清晰的条带。切胶回收进行商业测序,测序结果显示该条带大小为1461 bp,提交NCBI数据库进行Blast序列比对,与多粘芽孢杆菌同源性为99%,结合菌落形态和生理生化特征鉴定,确定5#菌株为多粘芽孢杆菌(Paenibacilluspolymyxa),命名为LY107。
2.3 发酵条件的优化
通过单因素实验分别考察培养温度、pH值、装液量和接种量对LY107产乙偶姻的影响,结果如图3所示。

图3 LY107发酵条件单因素实验优化
从图3可以看出,培养温度和pH值对菌株LY107产乙偶姻有显著的影响,培养温度为37 ℃、pH值为7.0时的乙偶姻产量最高,因此确定LY107产乙偶姻的最适培养温度和pH值分别为37 ℃和7.0;装液量和接种量对LY107产乙偶姻的影响相对较小,其中装液量的影响主要在于影响氧气的供应,氧气供应过多将导致糖酵解产生的丙酮酸流向TCA循环,而氧气供应不足会使产生的乙偶姻进一步转化为2,3-丁二醇,装液量为15 mL时的乙偶姻产量最高,因此,确定最适装液量为250 mL三角瓶中装液15 mL;乙偶姻产量随着接种量的增大而增加,但接种量达到5%后,乙偶姻的产量变化不大,因此,确定最适接种量为5%。
2.4 发酵培养基的优化
PB实验被用于筛选对乙偶姻产量具有显著影响的因子,PB实验设计见表1,结果见表2。
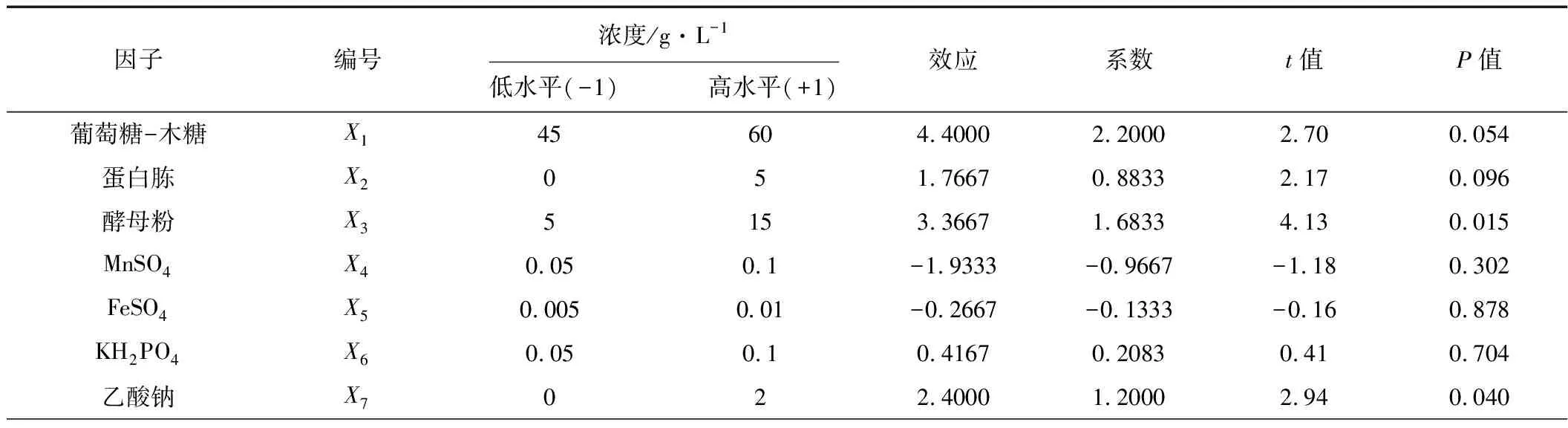
表1 PB设计筛选培养基组分
注:R2=90.75%
从表1的P值(P<0.05)可知,酵母粉和乙酸钠对乙偶姻的合成具有显著影响,酵母粉在氮源和微量元素的提供上有利于乙偶姻的合成,乙酸钠被认为是乙偶姻操纵子转录表达的诱导剂;其次是碳源葡萄糖-木糖和蛋白胨;而从t值可知,MnSO4和FeSO4呈负效应,其余组分都是正效应,即促进乙偶姻生成,因此,最终确定葡萄糖-木糖、蛋白胨和KH2PO4取高水平,MnSO4和FeSO4取低水平,而酵母粉和乙酸钠的浓度则需要通过RSM进一步确定。

表2 PB设计实验结果
从表2可以看出,不同组分浓度的组合导致乙偶姻产量从9.4 g·L-1至19.1 g·L-1显著变化,说明培养基组分对乙偶姻的合成有较大的影响。
根据PB设计分析结果,影响乙偶姻产量的2个重要影响因素为酵母粉和乙酸钠。采用MINITAB15.0软件中心复合方法,酵母粉和乙酸钠(分别编号为X3、X7)的中心点分别取15 g·L-1和2 g·L-1,设计2因素5水平响应面实验,其余培养基组分(g·L-1)为:葡萄糖-木糖(2∶1)60,蛋白胨5,MnSO40.05,FeSO40.005 ,KH2PO40.1,实验设计及结果见表3,响应面模型分析见表4。

根据回归方程,利用MINITAB15.0软件绘制响应面及其等高线,如图4所示。
从图4可以看出,两因素之间交互作用不显著,最佳点落在实验考察的区域内。
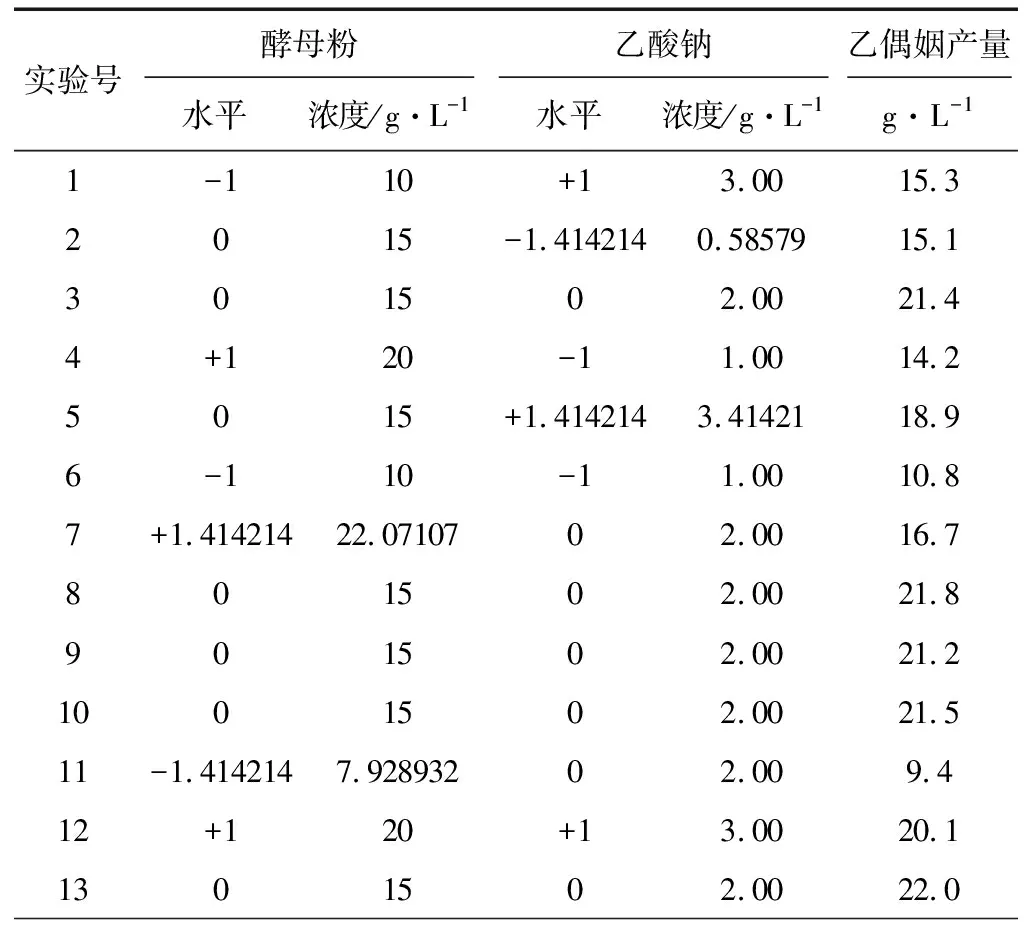
表3 中心复合实验设计及实验结果
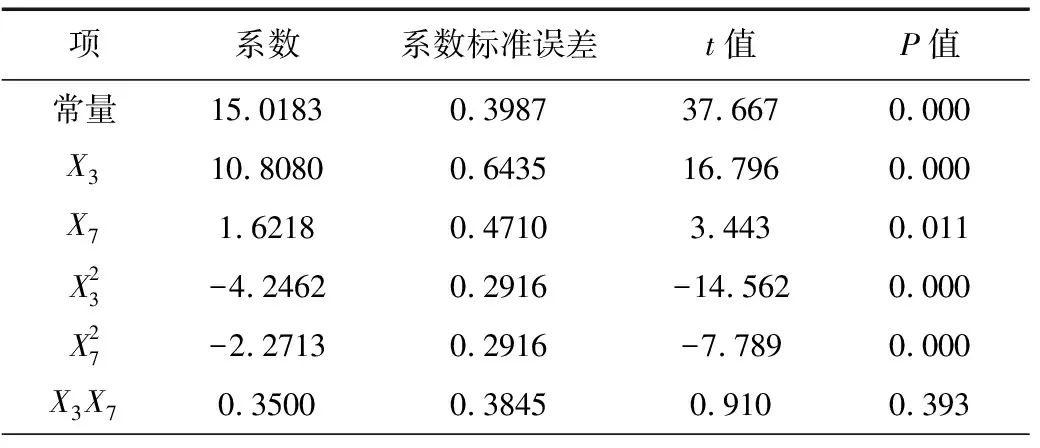
表4 响应面模型分析
通过MINITAB15.0软件中“响应优化器”进行寻优,得到优化结果为:酵母粉16.5 g·L-1、乙酸钠2.47 g·L-1,乙偶姻的预测值为22.38 g·L-1。最终确定优化培养基组分(g·L-1)为:葡萄糖-木糖60,蛋白胨5,酵母粉16.5,MnSO40.05,FeSO40.005,KH2PO40.1,乙酸钠2.47。
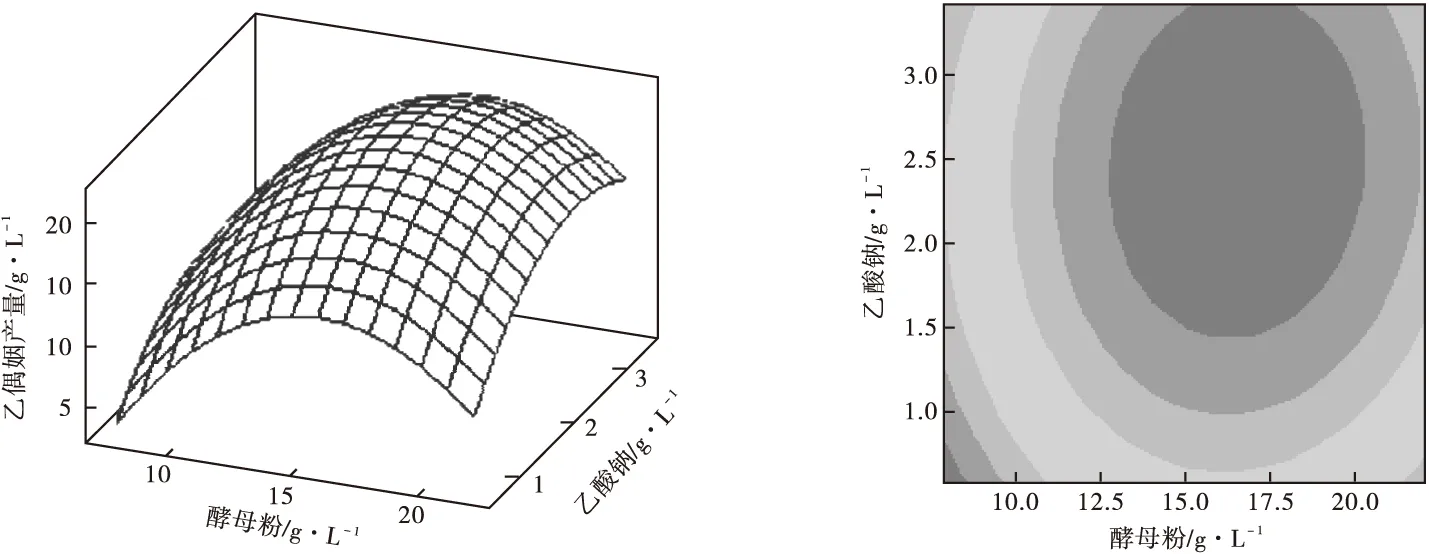
图4 响应面曲面图和等值线图分析
2.5 验证实验
采用优化后的发酵条件和发酵培养基组分在摇瓶中进行验证实验,结果如图5所示。

图5 多粘芽孢杆菌LY107产乙偶姻过程
从图5可以看出,从生长来看,发酵过程中细胞经历短暂的延滞期后快速进入对数期,24 h后菌体密度(OD600)达到最大值15.66;糖耗曲线表明多粘芽孢杆菌LY107首先利用速效碳源葡萄糖,在18 h葡萄糖快利用完时才开始利用木糖,说明发酵过程中存在葡萄糖效应;采用优化发酵条件和发酵培养基的乙偶姻最高产量为23.9 g·L-1,与预测值22.38 g·L-1接近,葡萄糖-木糖转化率为79.9%,基本验证了模型的可靠性。
3 结论
筛选到一株可以利用木糖产乙偶姻的菌株,经16S rDNA和生理生化鉴定为多粘芽孢杆菌,命名为LY107。以葡萄糖-木糖(2∶1,质量比)为碳源模拟木质纤维素水解液发酵产乙偶姻,经单因素实验优化培养条件为:培养温度37 ℃、pH值7.0、装液量为15 mL/250 mL、接种量5%(体积比)。经Plackett-Burman实验和RSM优化培养基组分(g·L-1)为:葡萄糖-木糖60,蛋白胨5,酵母粉16.5,MnSO40.05,FeSO40.005,KH2PO40.1,乙酸钠2.47。在优化培养条件和培养基组分下,乙偶姻的最高产量为23.9 g·L-1、葡萄糖-木糖转化率为79.9%。
[1] 任潇,马小琛,聂志奎,等.枯草芽孢杆菌发酵产3-羟基丁酮的条件优化[J].食品科技,2010,35(8):13-17.
[2] 韩丽,赵祥颖,刘建军.3-羟基丁酮的研究概况及进展[J].山东食品发酵,2006,(3):34-37.
[3] 纪晓俊,黄和,杜军.3-羟基丁酮的合成以及应用进展[J].现代化工,2008,28(4):18-22.
[4] 任潇,纪晓俊,孙世闻,等.肌酸比色法快速测定发酵液中3-羟基丁酮的含量[J].食品科技,2009,34(8):260-263.
[5] Zhang X, Yang T W, Lin Q, et al. Isolation and identification of an acetoin high production bacterium that can reverse transform 2,3-butanediol to acetoin at the decline phase of fermentation[J].World J Microbiol Biotechnol, doi:10.1007/s11274-011-0754-y.
[6] Yu E K , Saddler J N. Fed-batch approach to production of 2,3-butanediol byKlebsiellapneumoniaegrown on high substrate concentration[J].Appl Environ Microbial,1983,46(3):630-635.
[7] Zeng A P, Biebl H, Deckwer W D. Production of 2,3-butanediol in a membrane bioreactor with cell recycle[J].Appl Microbial Biotechnol,1991,34(4):463-468.
[8] Dettwiler B, Dunn I J, Heinzle E, et al. A simulation model for the continuous production of acetoin and butanediol usingBacillussubtiliswith integrated pervaporation separation[J].Biotechnol Bioeng,1993,41(8):791-800.
[9] Bassit N, Boquien C Y, Picque D, et al. Effect of initial oxygen concentration on diacetyl and acetoin production byLactococcuslactissubsp.Lactisbiovar diacetylactis[J].Appl Environ Microbiol,1993,59(6):1893-1897.
[10] Xiao Z J, Liu P H, Qin J Y, et al. Statistical optimization of medium components for enhanced acetoin production from molasses and soybean meal hydrolysate[J].Appl Microbiol Biotechnol,2007,74(1):61-68.
[11] Nakashimada Y, Kanai K, Nishio N. Optimization of dilution rate pH and oxygen supply on optical purity of 2,3-butanediol produced byPaenibacilluspolymyxain chemostat culture[J].Biotechnol Lett,1998,20(12):1133-1138.
[12] Liu Y F, Zhang S L, Yong Y C, et al. Efficient production of acetoin by the newly isolatedBacilluslicheniformisstrain MEL09[J].Process Biochem,2011,46(1):390-394.
[13] 张翠英,肖冬光,韩宁宁,等.木糖发酵高产2,3-丁二醇菌株的选育[J].食品研究与开发,2011,32(9):168-170.
[14] Zhang L Y, Shen Y L, Wei D Z, et al. Microbial production of 2,3-butanediol by a mutagenized strain ofSerratiamarcescensH30[J].Bioresource Technol,2010,101(6):1961-1967.

