光皮桦EST-SSR PCR反应体系的优化
陈 争,姜小凤,童再康
(浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安311300)
光皮桦Betula luminifera为中国特有的优良的速生阔叶用材树种[1],对于发展山区经济,调整林分结构,改善生态环境都有十分重要的意义。有关光皮桦研究的报道主要集中在群体特征研究、造林试验、种苗繁育和组织培养等方面[2-3],分子生物学方面的研究较少[4]。简单重复序列(simple sequence repeat,SSR),又称微卫星(microsatellite,MS),广泛分布于各类真核生物基因组的不同位置,具有共显性遗传,多态性含量高,同时具有特异性强、可靠性高和重复性好等特点[5],是一种较理想的DNA分子标记[6]。传统开发基因组SSR(genomic SSR,gSSR)操作繁杂,成本高,极大地制约了SSR标记的发展和应用[7]。随着测序技术的不断进步,测序速度的提高和测序成本的下降,很多物种都积累了大量的表达序列标签(expressed sequence tag,EST)序列,这些序列已经成为开发SSR标记(EST-SSR)的重要资源。与gSSR相比,获得EST-SSR要经济得多,并且EST-SSR源于基因的转录区,虽多态性相对较差,但与功能基因之间的关联较密切,因此具有更高通用性[2]。目前,EST-SSR在农作物[8-11]中的开发广泛应用,在林木[12-15]中的开发也越来越多。在利用EST-SSR分子标记进行相关研究工作之前,需针对研究的物种,对EST-SSR聚合酶链式反应(PCR)反应体系和程序进行优化筛选,以期获得可靠性高、稳定性好的扩增结果,确保EST-SSR分析结果的可靠性和重复性。尤卫艳等[5]利用光皮桦近缘种的gSSR引物初步建立了光皮桦的SSR反应体系。本研究在此基础上,利用本实验室开发的EST-SSR引物优化EST-SSR反应体系,为以后的遗传图谱构建和遗传多样性分析等研究建立基础。
1 材料与方法
1.1 材料
供试材料光皮桦采自浙江农林大学遗传学科光皮桦无性系育种园,取正常生长的嫩叶,-70℃冰箱保存备用。引物来自于本实验室设计的EST-SSR引物,随机选择其中有扩增产物的7对(表1)。

表1 7对光皮桦EST-SSR引物Table 1 Seven EST-SSR primers of Betula luminifera
1.2 主要试剂
10×缓冲液,Mg2+,rTaq DNA聚合酶,dNTPs均购自生工生物工程(上海)有限公司,引物由南京金斯瑞生物科技有限公司合成。DNA标记DL2000和20 bp DNA ladder购自宝生物工程(大连)有限公司。
1.3 方法
1.3.1 DNA提取及检测 光皮桦基因组DNA提取采用改良的十六烷基三甲基溴化铵法(CTAB):取5 g叶片在液态氮(研钵中预加少量PVP粉末)中研磨成粉末,转移至预热的2.0 mL的离心管(加入1 000 μL CTAB提取液和20 μL β-巯基乙醇充分混匀,65℃水浴保温20 min),65℃水浴保温30~60 min,隔10 min上下摇晃混匀;冷却至室温,12 000 r·min-1离心10 min;取上清加入等体积氯仿异戊醇混合液(体积比为24∶1),12 000 r·min-1离心10 min,重复1次该步骤;取上清加入2/3体积的异丙醇,混匀,室温放置15 min;12 000 r·min-1离心10 min,弃上清液;用体积分数为70%乙醇漂洗2次;至乙醇挥发完后,加入TE缓冲液50 μL溶解DNA。用ND-1000微量分光光度计测定DNA的浓度和纯度,并取适量样品,于10.0 g·kg-1琼脂糖凝胶电泳检测,紫外凝胶成像系统下观察并照相。从提取到的DNA样品中取出部分,根据测定的浓度将每个样品稀释至20.0 mg·L-1,保存在-20℃冰箱中待用。
1.3.2 正交设计优化EST-SSR PCR反应体系 采用正交设计L25(56)对EST-SSR PCR反应体系中的5个因素:DNA模板浓度,引物浓度,Mg2+浓度,三磷酸碱基脱氧核苷酸(dNTPs)浓度和DNA聚合酶量进行优化。试验方案见表2,3次重复。
1.3.3 PCR扩增 PCR扩增程序为:94℃预变性5 min;进行35个循环的94℃变性30 s,49~60℃(根据各引物的退火温度)退火30 s,72℃延伸40 s;循环结束后,再72℃延伸7 min,4℃保存。扩增反应结束后,每管各加入适量的上样缓冲液,混合均匀后,10 g·L-1的琼脂糖凝胶电泳检测。电泳结束后,应用Quantity One软件测定各电泳条带的光密度,应用SPSS 19.0软件对结果进行统计分析,确定最佳的反应体系。
1.3.4 退火温度确定 在试验确定的最佳反应体系的基础上,对本次试验中扩增条带较弱的引物的退火温度进行筛选。设定退火温度为49~60℃,自动生成12个梯度(49,50,51,52,53,54,55,56,57,58,59和60℃),扩增产物用10 g·L-1的琼脂糖凝胶电泳检测。

表2 L25(56)正交设计表Table 2 Orthogonal design with L25(56)
1.3.5 EST-SSR PCR反应体系的稳定性检测 进行2个层次的稳定性检测:①同一引物对不同模板的扩增;②不同引物对同一模板的扩增。扩增产物分别在10 g·L-1的琼脂糖凝胶和80 g·L-1的非变性聚丙烯酰胺凝胶上进行电泳检测,以检测优化的PCR反应体系的稳定性和可靠性。
2 结果与分析
2.1 正交设计优化光皮桦EST-SSR PCR反应体系
按表2设计的选择Ble122引物进行PCR扩增后,10.0 g·L-1的琼脂糖凝胶电泳检测,应用Quantity One软件测定各电泳条带的光密度,应用SPSS 19.0软件对结果进行统计分析,方差分析结果见表3。由表3可以得到:因素DNA模板浓度和引物浓度对试验结果有极显著影响,dNTPs浓度、Mg2+浓度和rTaq酶量对试验结果影响不显著,各因素对试验结果影响的主次顺序是:DNA模板浓度>引物浓度>rTaq酶量>dNTPs浓度>Mg2+浓度。
由SPSS 19.0软件分析的单因素统计量表中可以得到各因素水平对试验结果影响的强弱顺序,其中各因素水平对试验结果影响最强的分别是:DNA模板浓度4.0 mg·L-1,引物浓度0.500 μmol·L-1,Mg2+1.250 mmol·L-1,dNTPs 0.250 mmol·L-1,rTaq 酶 0.072 5 × 16.67 mkat·L-1,即为最佳反应体系。图1 和图2分别为因素DNA模板浓度和引物浓度对试验结果影响趋势图。

表3 应用SPSS 19.0进行方差分析Table 3 Analysis of variances by SPSS 19.0

图1 DNA模板浓度对试验结果的影响趋势图Figure 1 Test result vary with different concentrations of DNA templates
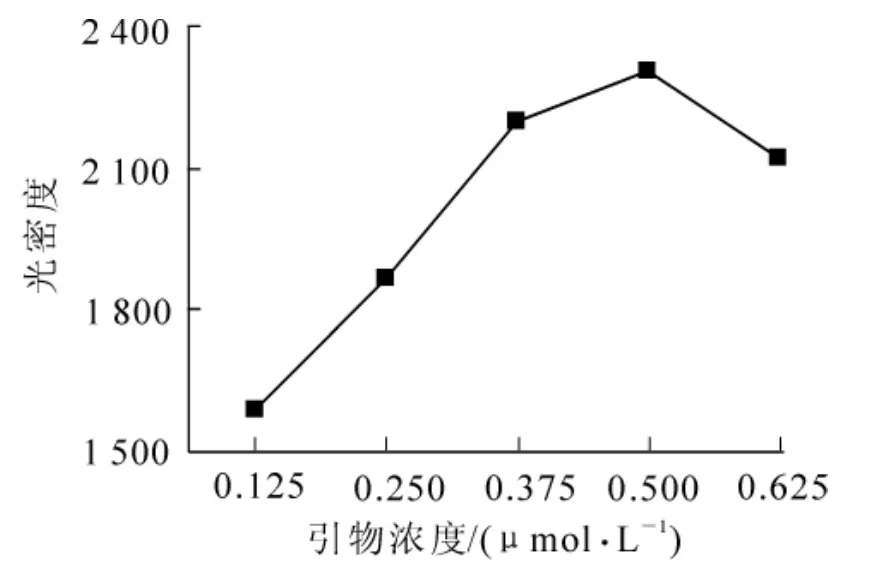
图2 引物浓度对试验结果的影响趋势图Figure 2 Test result vary with different concentrations of primer
2.2 最佳退火温度的确定
不同的引物退火温度可能不同。PCR反应中,退火温度的高低直接影响引物与模板 DNA的特异性结合。选择引物Ble103进行49~60℃的12梯度最适退火温度确定试验,结果如图3。温度过高或过低扩增效果均不理想,因此确定最适退火温度是54℃。
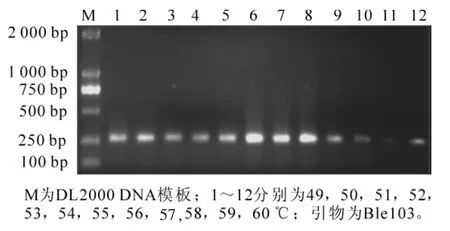
图3 不同退火温度下EST-SSR PCR扩增结果Figure 3 Result of EST-SSR PCR amplification at different annealing temperature
2.3 光皮桦EST-SSR PCR反应体系及反应参数的稳定性检测
选择引物Ble143对5个不同种源(分别来自浙江临安,广西龙胜,四川都江堰,贵州修文,福建武夷山)的光皮桦DNA模板进行PCR扩增,选择引物Ble103,Ble109,Ble143,Ble177,Ble209共5对同一模板(来自于广西龙胜)进行PCR扩增,对优化后的光皮桦EST-SSR PCR反应体系进行稳定性检测,结果均能获得清晰可辨的条带(图4和5)。体系优化后选择引物Ble244对光皮桦37株不同植株的DNA模板进行扩增,80 g·L-1的非变性聚丙烯酰胺凝胶电泳,银染获得清晰的结果(图6)。

图4 光皮桦EST-SSR PCR产物琼脂糖凝胶电泳(同引物不同模板)Figure 4 Result of EST-SSR PCR amplification in AGE of different DNA templates
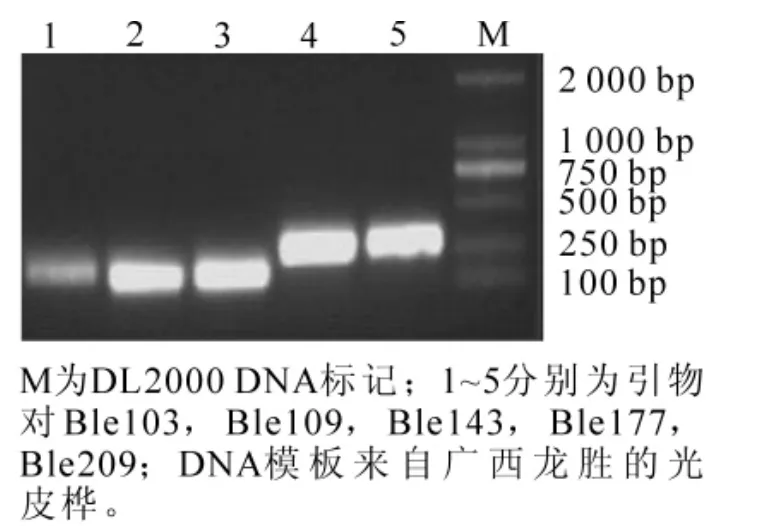
图5 光皮桦EST-SSR PCR产物琼脂糖凝胶电泳(不同引物同模板)Figure 5 Result of EST-SSR PCR amplification in AGE of different primers

图6 光皮桦EST-SSR PCR产物非变性聚丙烯酰胺凝胶电泳Figure 6 Result of EST-SSR PCR amplification in PAGE
3 结论与讨论
笔者采用正交设计方法优化了光皮桦EST-SSR反应体系,并对结果进行了验证。在正交设计的基础上,得出了光皮桦EST-SSR最佳PCR反应体系:DNA模板质量浓度为4.0 mg·L-1,引物浓度为0.500 μmol·L-1,Mg2+1.250 mmol·L-1,dNTPs 0.250 mmol·L-1,rTaq 酶 0.072 5 × 16.67 mkat·L-1。与尤卫艳等[4]初步建立的SSR反应体系相比,DNA模板用量、dNTPs和Taq酶均有少量增加,Mg2+浓度有所降低,但引物浓度相差较大,可能与本试验中采用的引物来自于光皮桦自身EST序列设计的引物有关,也可能与公司合成的引物纯度有关。SSR体系优化的方法有多种,一般均采用多次单因素设计的方法。然而,当变化1种因素水平时,固定的其余因素水平往往靠经验或参考相近物种确定,这样既不能考察PCR体系中各因素的交互作用,也不能完全保证各因素最佳的组合就是最佳反应体系。完全组合设计虽然可以考察 PCR体系中各因素的相互作用,得到的最佳反应体系也较稳定,但工作量很大,试验周期长。正交设计则是从复因子试验的结果中挑选几个处理进行试验,就可得到具有代表性的结果,相对于单因素设计减少了处理组合。对PCR体系优化的报道很多,但对试验结果的判断大多依据直观分析方法,因此,不能很好地估计试验误差,并对试验结果优劣的判断带有主观性。本研究利用Quantity One软件对这一方面进行了尝试,通过比较其光密度值的大小,分析结果更准确可靠且操作简单,是一种较好的PCR应体系的优化分析方法。由于引物不同,其退火温度也不同:温度高,扩增产物的特异性强;温度低,扩增产物的产量高。因此,采用不同的引物时,建议进行梯度退火试验,以确定最佳的退火温度。
[1]郑万钧.中国树木志:第2卷[M].北京:中国林业出版社,1985:2124-2131.
[2]陈伟,施季森,刘希华.光皮桦研究现状及遗传改良策略[J].南京林业大学学报:自然科学版,2006,30(1):119-122.CHEN Wei,SHI Jisen,LIU Xihua.Present research and tactics for genetic improvement of Betula luminifera Winkl.[J].J Najing For Uni Nat Sci Ed,2006,30(1):119-122.
[3]胡晓媛,李志真,梁一池.优良速生树种光皮桦研究进展[J].福建林业科技,2006,33(2):159-163.HU Xiaoyuan,LI Zhizhen,LIANG Yichi.The progress of the studies on the excellent fast-growing tree Betula luminifera [J].J Fujian For Sci Technol,2006,33(2):159-163.
[4]尤卫艳,黄华宏,程龙军,等.光皮桦SSR分子标记体系的建立[J].浙江林学院学报,2010,27(3):464-469.YOU Weiyan,HUANG Huahong,CHENG Longjun,et al.An SSR molercular labeling technique system for Betula luminifera [J].J Zhejiang For Coll,2010,27(3):464-469.
[5] BOZHKO M,RIEGEL R,SCHUBERT R,et al.Acyclophilin gene marker confirming geographical diferentiation of Noway spruce populations and indicating viability response on excess soilborn salinity [J].Mol Ecol,2003,12(3):147-155.
[6] TÓTH G,GÁSPÁRI Z,JURKA J.Microsatellites in different eukaryotic genomes:survey and analysis [J].Genome Res,2000,10:967-981.
[7] KOTA R,VARSHNEY R K,THIEL T,et al.Generation and comparison of ESTs derived SSRs and SNPs in barley(Hordeum vulgare L.)[J].Hereditas,2001,135:145-151.
[8] CHO Y G,ISHII T,TEMNYKH S,et al.Diversity of microsatellites derived from genomic libraries and Gene Bank sequences in rice(Oryza sativa L.)[J].Theor Appl Genet,2000,100:713-722.
[9] GUPTA P K,RUSTGI S,SHARMA S,et al.Transferable EST-SSRs markers for the study of polymorphism and genetic diversity in bread wheat[J].Mol Genet Genomics,2003,270:315-323.
[10] THIEL T,MICHALEK W,VARSHNEY R K,et al.Exploiting EST databases for the development and characterization of gene-derived SSR markers in barley(Hordeum vulgare L)[J].Theor Appl Genet,2003,106:411-422.
[11] HACKAUF B,WEHLING P.Identification of microsatellite polymorphisms in an expressed portion of the rye genome[J].Plant Breed,2002,121:17-25.
[12]张新叶,宋丛文,张亚东,等.杨树EST-SSR标记的开发[J].林业科学,2009,45(9):53-59.ZHANG Xinye,SONG Congwen,ZHANG Yadong,et al.Development of EST-SSR in Populus deltoides and P.euramericana [J].Sci Silv Sin,2009,45(9):53-59.
[13] RUNGIS D,BERUBE Y,ZHANG J,et al.Robust simple sequence repeat markers for spruce(Picea spp.) from expressed sequence tags [J].Theor Appl Genet,2004,109:1283-1294.
[14] LIEWLAKSANEEYANAWIN C,RITLAND C E,EL-KASSABY Y A,et al.Single-copy,species-transferable microsatellite markers developed from loblolly pine ESTs [J].Theor Appl Genet,2004,109:361-369.
[15]王艳敏,魏志刚,杨传平.白桦EST-SSR信息分析与标记的开发[J].林业科学,2008,44(2):78-84.WANG Yanmin,WEI Zhigang,YANG Chuanping.Data mining for SSRs in ESTs and EST-SSR marker development in Betula platyphylla [J].Sci Silv Sin,2008,44(2):78-84.

