IL-8RB mRNA和IL-8RB蛋白在妊娠早期小鼠子宫内膜的表达
白慧茹 崔春霞 宋芳 顾捷 苏丽娟 刘萨日娜(内蒙古医科大学,010059)
IL-8RB mRNA和IL-8RB蛋白在妊娠早期小鼠子宫内膜的表达
白慧茹 崔春霞 宋芳 顾捷 苏丽娟 刘萨日娜(内蒙古医科大学,010059)
目的 研究妊娠早期小鼠子宫内膜中IL-8RB在mRNA水平和蛋白质水平的表达情况。方法 应用半定量RT-PCR、免疫组织化学显色和图像分析技术,观察IL-8RB在妊娠1 d、4 d、5 d、6 d小鼠子宫内膜中的表达情况。结果 免疫组化染色结果显示在子宫内膜腔上皮,IL-8RB于妊娠4 d表达最强,妊娠5 d开始逐渐下降,妊娠6 d降至妊娠1 d水平;在子宫内膜腺上皮和基质,IL-8RB的表达水平随妊娠天数的增加而逐渐升高。RT-PCR结果显示IL-8RB mRNA表达规律与IL-8RB蛋白在子宫内膜腔上皮的表达相一致。结论 IL-8RB可能通过与其配体白细胞介素-8结合而参与小鼠胚泡着床过程。
IL-8RB;子宫内膜;着床;逆转录多聚酶链反应;免疫组织化学
目前已知白细胞介素-8(interleukin-8,IL-8)的受体有IL-8RA(IL-8 receptor A)和IL-8RB,均属于G蛋白偶联受体[1],其中IL-8RB与IL-8的亲和力强于IL-8RA。IL-8RB主要表达于中性粒细胞表面,正常月经周期子宫内膜的上皮细胞、基质细胞也有表达[2],但是其在妊娠早期子宫内膜的表达情况尚不清楚。本研究运用半定量RT-PCR、免疫组织化学的方法检测妊娠早期小鼠子宫内膜IL-8RB的表达,为进一步阐述它在小鼠胚泡着床过程中的作用机制提供可能的动物实验资料。
1 资料与方法
1.1 研究对象 妊娠小鼠:昆明种动情期雌鼠与同品系雄鼠2∶1合笼,次日清晨发现阴栓者为妊娠1 d的小鼠。子宫内膜组织标本:分别于妊娠1 d、4 d、5 d、6 d用断颈法处死雌鼠,迅速剪开腹腔,取双侧子宫,标本分为两份,一份用Bouin液固定,常规石蜡包埋;另一份冻存于-80℃,以供提取RNA用。
1.2 主要试剂 兔抗人IL-8RB多克隆抗体购于Santa Cruz公司;PV-6001免疫组化试剂盒、DAB显色试剂盒购于北京中杉金桥生物技术有限公司。RNArose Reagent购于上海华舜生物工程有限公司;通用RT-PCR试剂盒购于北京博大泰克生物基因技术有限责任公司;IL-8RB和内参照β-actin的引物均委托大连宝生物工程有限公司合成。
1.3 免疫组织化学染色 切片常规脱蜡至水;3%H2O2去离子水室温闭光孵育15 min,封闭内源性过氧化物酶;滴加兔抗人IL-8RB多克隆抗体工作液(1∶150),37℃恒温箱中孵育2 h;滴加羊抗兔IgG抗体-HRP多聚体,37℃恒温箱中孵育30 min。以上各步之间用0.01M PBS缓冲液(pH 7.5)洗3次,每次5 min。最后,DAB室温闭光显色4 min,Mayer苏木精复染细胞核,脱水、透明、封片。阴性对照用抗体稀释液代替一抗,其他步骤同上。
1.4 RT-PCR法 使用RNArose Reagent抽提总RNA并做定量检测,依据下述体系进行反转录,总体积为20 μL,其中dNTPs 1 μL,MMLV(反 转 录 酶 )1 μL,Oligo(dT)16 μL,Rnasin 0.4 μL,RNA 样 品 2 μL,ddH2O 10.6 μL,5 ×MMLV酶反应缓冲液4 μL。将上述成分混匀后,37℃水浴2 h,95℃热变性5 min。反转录产物-20℃保存。然后进行PCR,PCR反应体系总体积为25 μL,其中dNTPs 0.5 μL,ddH2O 7.8 μL,10×PCR反应缓冲液2.5 μL,Taq酶0.2 μL,cDNA 4 μL,IL-8RB或β-actin的上游引物5 μL,IL-8RB或β-actin的下游引物5 μL。PCR反应条件:94 ℃预变性2 min,94 ℃预变性50 s,55 ℃退火50 s,72 ℃延伸1 min,共进行35个循环,72℃再延伸8 min。分别以妊娠1 d、4 d、5 d、6 d小鼠子宫内膜cDNA为模板,进行PCR。PCR产物分析:取5 μL DNA Marker、10 μL PCR产物点样,2.0%琼脂糖凝胶电泳分离,电压为90 V,电泳时间30 min,凝胶成像系统紫外光下观察电泳条带,拍照。
1.5 图像分析及统计学处理
1.5.1 免疫组织化学图像分析及统计学处理 用JeDa 801图像分析系统测定各天妊娠小鼠子宫内膜IL-8RB蛋白表达的相对含量,取6张不同孕鼠子宫内膜切片,每张切片在光学显微镜下(×200),于腔上皮、腺上皮和基质的不同部位各自随机测10个单位面积,IL-8RB蛋白相对含量用(±s)表示。数据采用SPSS 13.0软件进行统计,用单因素方差分析(one-way ANOVA)中的LSD法处理,并进行两两比较,P<0.05表示差异有统计学意义。
1.5.2 RT-PCR图像分析及统计学处理 采用JeDa 801凝胶成像分析系统照像并利用相应的系统软件对DNA条带进行灰度扫描,将同一标本IL-8RB DNA条带的灰度值/β-actin DNA条带的灰度值作为相对光密度值,表示IL-8RB mRNA的相对含量,分别计算妊娠1 d、4 d、5 d、6 d小鼠子宫内膜组织的平均光密度值(%),用(±s)表示。数据采用SPSS 13.0软件进行统计,用单因素方差分析(one-way ANOVA)中的LSD法处理,并进行两两比较,P<0.05表示差异有统计学意义。
2 结果
2.1 免疫组织化学染色结果(图1~4) IL-8RB蛋白主要定位在子宫内膜的腔上皮细胞、腺上皮细胞的胞质内以及基质中,呈棕黄色颗粒,不同妊娠天数阳性反应强弱不等。蓝紫色为Mayer苏木精复染细胞核。妊娠早期小鼠子宫内膜中IL-8RB蛋白表达的半定量结果显示(表1):在子宫内膜腔上皮,妊娠1 d阳性反应最弱,妊娠4 d表达最强,妊娠5 d有所下降,妊娠6 d降至妊娠1 d的水平,不同妊娠天数两两相比,除妊娠1 d与妊娠6 d二者比较无差异外,其余差异均有高度统计学意义(P<0.01);在子宫内膜腺上皮和基质,随妊娠天数增加IL-8RB的表达逐渐增强,其中妊娠5 d与妊娠6 d的腺上皮相比、妊娠4 d与妊娠5 d的基质相比,P>0.05,差异无统计学意义,其余两两相比,P<0.01,差异均有高度统计学意义。
2.2 RT-PCR分析(图5) IL-8RB和β-actin的RT-PCR产物与理论长度一致,分别为509 bp和473 bp。IL-8RB mRNA在妊娠早期小鼠子宫内膜组织中的半定量分析结果为:妊娠1 d表达最弱(0.108 6±0.021 8),妊娠4 d表达最强(0.298 5±0.032 2),妊娠5 d有所下降 (0.206 6±0.025 8),妊娠6 d(0.110 3±0.022 4)降至妊娠1 d的水平,不同妊娠天数两两相比,除妊娠1 d与妊娠6 d二者比较无差异外,其余差异均有高度统计学意义(P<0.01)。
表1 IL-8RB蛋白在妊娠早期小鼠子宫内膜表达水平比较结果(±s)

表1 IL-8RB蛋白在妊娠早期小鼠子宫内膜表达水平比较结果(±s)
妊娠天数 腔上皮 腺上皮 基质1 d 0.096±0.011 0.088±0.009 0.065±0.004 4 d 0.143±0.010 0.092±0.007 0.082±0.004 5 d 0.112±0.014 0.099±0.010 0.080±0.005 6 d 0.101±0.012 0.101±0.009 0.088±0.005
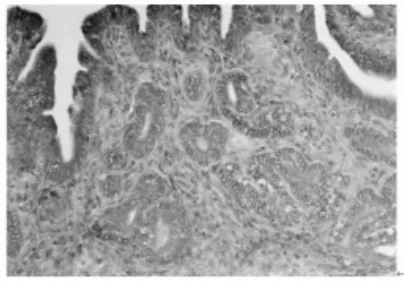
图1 妊娠1 d小鼠子宫内膜CXCR2蛋白的表达
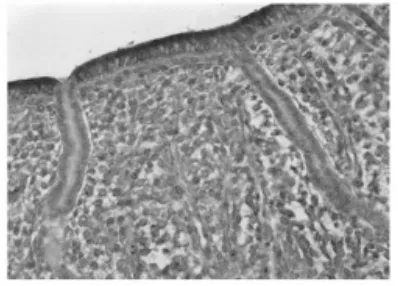
图2 妊娠4 d小鼠子宫内膜CXCR2蛋白的表达

图3 妊娠5 d小鼠子宫内膜CXCR2蛋白的表达
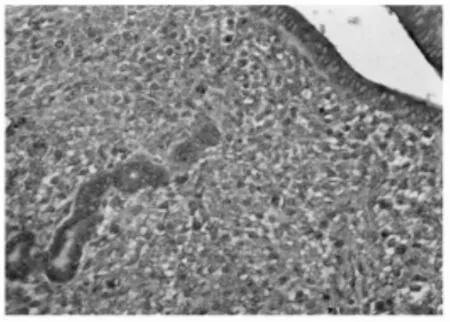
图4 妊娠6 d小鼠子宫内膜CXCR2蛋白的表达

图5 IL-8RB mRNA在妊娠早期小鼠子宫内膜的表达
3 讨论
近年来,人们对IL-8在哺乳动物生殖生理过程中的作用研究取得一定进展,并且认为是IL-8与其相应的受体IL-8RBA或IL-8RB结合,从而趋化和激活中性粒细胞发挥作用[3-5]。1998年Iwabe等人[6]通过实验证实在子宫内膜上皮细胞和基质细胞中有IL-8R mRNA的表达,直到2003年Naciye M等人[2]才首次报道在正常月经周期子宫内膜上皮细胞和基质细胞中均有IL-8RA和IL-8RB蛋白的表达。
需要特别指出的一点是,目前,关于IL-8RA和IL-8RB在着床前后子宫内膜的表达情况国内外研究的甚少,Francisco Dominguez等人[7]在体外建立的植入模型中探讨胚泡对于子宫内膜趋化因子受体表达的影响,发现在没有胚泡存在的情况下,仅为数很少的几个子宫内膜上皮细胞有几乎不可测到的IL-8RA的表达;而在人类胚泡存在的情况下,IL-8RA阳性细胞不仅数量增加,而且染色的强度也相应增加。而对于IL-8RB的表达则未见表述。我们的实验发现:IL-8RB无论是从蛋白水平还是从mRNA水平其在妊娠早期小鼠子宫内膜的表达均呈时相性,妊娠1 d小鼠子宫内膜处于分泌期,IL-8RB有表达,与Naciye M等人报道的结果一致[2];小鼠胚泡的着床行为发生在妊娠4 d、5 d,这与IL-8RB在妊娠4 d达到高峰相符,妊娠5 d、6 d胚泡埋入子宫内膜,IL-8RB表达回落。同时IL-8RB在腔上皮细胞中的表达趋势与IL-8在妊娠早期小鼠子宫内膜腔上皮表达趋势相吻合[8]。mRNA的表达受到多重因素的复合调控,其与蛋白的表达很难同步[9-10],本研究结果中IL-8RB mRNA与IL-8RB蛋白的表达规律基本趋于一致,在国内外文献中尚未见到报道。其趋于一致的变化规律是否稳定还需科研工作者的进一步研究。从本文的研究结果,我们推测在胚泡着床过程中,腔上皮通过自分泌机制上调IL-8与IL-8RB的表达,IL-8与腔上皮细胞的IL-8RB直接结合,从而介导胚泡与子宫内膜的相互作用。随着胚泡植入子宫内膜,IL-8RB在腺上皮细胞和基质中的表达越来越强,我们认为IL-8与腺上皮和基质中的IL-8RB直接结合,促使子宫内膜基质蜕膜化,为胚泡的植入创造有利的条件。此外,本研究所得到的IL-8RB mRNA在妊娠早期小鼠子宫内膜的表达规律与IL-8RB蛋白的表达相一致,这一结果填补了国内外研究IL-8RB mRNA在着床前后子宫内膜表达情况的空白。
综上所述,IL-8RB在妊娠早期子宫内膜的表达规律说明IL-8RB可能通过与其配体IL-8直接结合,参与小鼠胚泡的着床过程。当然着床是一个复杂的过程,起作用的不只是一个因子,而是由一些因子共同作用而精密调节的[11-12],IL-8的受体-配体系统在胚泡着床中的具体作用值得深入研究。另外,IL-8RB在胚胎分化和发育过程中起何种作用也受到国内外学者的重视[13-14],检测妊娠6 d以后IL-8RB的表达情况是深入研究的其中一个方向和分支。
[1]Hoch RC,Schtaufstaetter IU,Cochrane CG,et al.In vivo,in vitro,and moleculer aspects of interleukin-8 and interleukin-8 receptors[J].J Lab Clin Med,1996,128(2):134-145.
[2]Naciye M,StevenFP,UmitAK,etal.Chemokine receptor expression in human endometrium[J].Biol Reprod,2003,68(5):1491-1495.
[3]Garcia-Velasco JA,AriciA.Chemokinesandhuman reproduction[J].Fertil Steril,1999,71(6):983-993.
[4]Manna SK,Sarkar A,Sreenivasan Y.α-melanocyte-stimulating hormonedown-regulatesCXC receptorsthrough activation of neutrophil elastase[J].Eur J Immunol,2006,36(3):754-769.
[5]Dame JB,Juul SE.The distribution of receptors for the proinflammatory cytokines interleukin (IL)-6 and IL-8 in the developing human fetus[J].Early Human Development,2000,58(1):25-39.
[6]Iwabe T,Harada T,Tsudo T,et al.Pathogenetic significance of increased levels of interleukin-8 in the peritoneal fluid of patientswith endometriosis[J].FertilSteril,1998,69(5):924-930.
[7]Francisco Dominguez,Arancha Galan,Jose Juan Luna Martin,et al.Hormonal and embryonic regulation of chemokine receptors CXCR1,CXCR4,CCR5 and CCR2B in the human endometrium and the human blastocyst[J].Mol Hum Reprod,2009,19(4):189-199.
[8]姜雯,宋芳,岳淑芬,等.白细胞介素-8在妊娠早期小鼠子宫内膜的表达及对胚泡着床的影响[J].解剖学杂志,2005,28(6):629-631.
[9]Noda A,Kinoshita K,Sakurai A,et al.Hyperglycemia and lipopolysaccharidedecreasedepression effectof interleukin 8 production by hypothermia:an experimental study with endothelial cells[J].Intensive Care Med,2008,34(1):109-115.
[10]Li HP,Guo YJ,Zhu HS,et al.IL-8 mRNA expression in the mouse mammary glands during pregnancy and lactation[J].Genet Mol Res,2012,11(AOP):353-361.
[11]Milne SA,Critchley HO,Drudy TA,et al.Perivascular interleukin-8 messenger ribonucleic acid expression in human endometrium varies across the menstrual cycle and in early pregnancy decidua[J].JClin EndocrinolMetab,1999,84(7):2563-2567.
[12]ShiYL,LuoXZ,Zhu XY,etal.Effectsofcombined 17β-estradiol with TCDD on secretion of chemokine IL-8 and expression of its receptor CXCR2 in endometriotic focus-associated cells in co-culture[J].Hum Reprod,2006,21(4):870-879.
[14]Caballero-Campo P,Dominguez F,Coloma J,et al.Hormonaland embryonicregulation ofchemokinesIL-8,MCP-1 and RANTES in the human endometrium during the window of implantation[J].Mol Hum Reprod ,2002,8(4):375-384.
Objective To study the expression of IL-8RB in mRNA and protein in mouse endometrium during early pregnancy.Methods The expressions of IL-8RB in mouse endometrium on pregnant Day 1,Day 4,Day 5,and Day 6 were investigated by means of semi-quantitative RT-PCR,immunohistochemistry coloration method and image analysis techniques.Results Immunohistochemistry coloration results showed,in the luminal epithelium of endometrium,the expression of IL-8RB was the strongest on pregnant Day 4,then decreased gradually on Day 5,on Day 6 it reached the level of Day 1.In the glandular epithelium and stroma of endometrium,the expression of IL-8RB increased gradually with the pregnant progress.RT-PCR results showed the expression of IL-8RB mRNA was consistent with the expression of IL-8RB protein in the luminal epithelium of endometrium.Conclusion IL-8RB might take part in the process of mouse blastocyst implantation by combining with its ligand interleukin-8.
IL-8RB;Endometrium;Implantation;Reverse transcriptase polymerase chain reaction(RT-PCR);Immunohistochemistry
1005-619X(2012)12-1062-03
2012-10-22)

