芸薹根肿菌(Plasmodiophora brassicae)单孢分离接种及生理小种的鉴定
李 茜, 沈向群, 耿新翠, 李 林
(沈阳农业大学园艺学院,沈阳 110866)
近百年来十字花科作物的根肿病一直在不断蔓延,成为该类作物的主要威胁[1]。芸薹属油用品种、大白菜、羽衣甘蓝、结球甘蓝、萝卜、芥菜等均可被十字花科蔬菜根肿病菌感染[2]。分类学家已经根据分子数据将根肿病菌重新分类到新分类单元,它既不是一种真菌,也不是黏菌[3],而是一个具有两种不同鞭毛变形虫的原生生物多样化群组[4]。
虽然自然界根肿病菌的种群是生理性多样化分化型混合的状态,但是种中也观察到根毛侵染,皮层侵染仅发生在十字花科植物的感病植株上[4]。研究发现根肿菌生活史的大部分时期都是单倍体,发生核配后立即进行减数分裂形成次生游动孢子囊,最后形成休眠孢子[5]。可以猜测到单一的休眠孢子的后代带有同样的基因型。要确定这是否是同宗或异宗配合,根肿病菌单孢的研究十分必要。为了对这些病原菌的遗传进行研究和筛选出专化抗源,获得单孢子菌株也是非常重要的。
不同生态环境的根肿菌可以形成不同的致病性,根肿病菌也组成了一些不同的致病型,除了用病原菌根感染宿主组织和愈伤组织进行培养外,根肿病菌不能进行人工培养,所以试验一直都较难进行[6]。因为这个原因,根肿病菌研究比其他病原菌准确性差,特别是生理小种分化型的研究,在世界上仅仅只有几个菌株分离成功的报道。韩国是完全使用营养液培养[7],不能为根肿病菌提供理想的增殖环境;日本则是将孢子接种在无菌土壤中[8],接种成功率较低;加拿大使用琼脂法[9],对不同接菌条件下单孢菌株进行比较,对最适合发病的土壤传播并没有进行试验对比。在国内没有纯粹单孢分离生理小种的研究报道。
本文改进了单一孢子分离及接种的方法,通过进行大量接种试验,提高了单孢感染的成功率,并对不同小种分离后致病性的不同进行了鉴定。
1 材料与方法
1.1 单孢分离材料
1.1.1 供试感病品种
大白菜主栽品种‘91-12’来自辽宁凌海,是沈阳市主栽品种,能够被试验用菌高度感染。
1.1.2 根肿病菌来源
根肿病菌生理小种3个,分别取自沈阳新民市、四川彭州市和四川西昌县,通过Williams鉴别寄主鉴定,分别确定为生理小种4、生理小种7、生理小种10优势种群。其中生理小种4为平原地区病菌,生理小种7、生理小种10为高山地区病菌。
1.2 单孢分离与接种
从被感染的大白菜根上取下根瘤组织,在培养皿中加入无菌蒸馏水捣碎。孢子悬浮液通过8层纱布过滤后离心,3000r/min离心9min,弃上清液,沉淀用蒸馏水悬浮后再4000r/min离心12min,2次重复。弃上清液,用蒸馏水悬浮沉淀物,将悬浮液的浓度调至2×103/mL 4℃保存备用[10]。单孢接菌稀释液不可放置过夜,否则细胞会因为半透膜渗透作用,吸水涨破。单孢浓度控制在每0.5μL的液滴中含有1个单孢,孢子悬浮于灭菌的载玻片上并用盖玻片盖上。液滴在显微镜下重新使用微管吸入,反复检查至少3次,以确保只含有一个孢子。
大白菜种子55℃温汤浸种30min,蒸馏水冲洗后进行在显微镜下观察,确保种皮表面没有黏着根肿菌,并用无菌蒸馏水冲洗3次。将种子放在湿润的滤纸上于25℃下培养1~2d。当开始长出根毛时将其单独放入培养皿中,在显微镜下使用微管轻轻将载玻片上的单孢粘到根毛上,之后幼苗保持在25℃16h光照,20℃8h黑暗条件下,在生长箱中培养21d[11]。
1.3 单孢菌继代扩繁
21d后将幼苗移入装有灭菌土(pH6~6.5)的无菌苗钵中,在20~25℃的温室中单独培养40~50d,在流动的水中进行冲洗并确认病症。将疑似发病的菌根放回原钵中,在菌根中间重新播入灭菌后的白菜种子,继续培养,再培养40~50d后确认病症。重复进行操作,直到能观察到明显发病为止。
单孢接种后,确认病症的个体虽然被病原菌侵入,但还没有形成可以满足肉眼观察的膨大程度,使用单孢子接种后的寄主幼苗根再接种,在最适合该菌的土壤环境下增殖。
用棕色玻璃瓶遮光临时保存扩繁后的菌根,营养液浸根放入瓶中,用棉花封口,25℃保存3~5d。根瘤腐烂后,将其倒入到装有无菌土的穴盘中央,并将种子播种到病根土上。
1.4 单孢后代的小种鉴定
1.4.1 Williams鉴别寄主[12]
使用Williams鉴别寄主鉴定:寄主分别为2个结球甘蓝品种JQ(‘Jersey Queen’)、BS(‘Badger Shipper’),2个芜菁甘蓝品种 LT(‘Laurentian’)、WB(‘Wilhelmsburger’),4个寄主均由韩国坂田种苗公司提供。按照病菌在4个寄主上致病性的分化来确定生理小种,使用其原钵土+原钵菌根方法进行接种,避免交叉感染。
1.4.2 接种体的制备及接种方法[13]
每份扩繁后的菌株取鲜重15g进行匀浆,配制菌液100mL,利用血球计数板计算并将菌液孢子浓度稀释为12×107个/mL,将菌液加入到300g无菌土中,搅拌均匀,密封48h以上,此时病菌孢子浓度为4×107个/g。装入32钵穴盘中,穴盘底部封严,防止病菌从底部小孔互相感染。钵中心插一深3cm、直径2cm的圆穴,置入病菌土,每穴在病菌土上播4粒种子,使每份菌土保苗(1种鉴别寄主)20株以上。采用十字花式分离栽种,可以有效避免病菌交叉感染。苗床温度播种后控制在25℃,土壤湿度为90%,pH 控制在6~7[14]。
1.4.3 病情调查
接种后45d开始调查,根据国际通用病情分级标准[15]:0级,根系发育正常,根部没有肿瘤;1级,1%~30%的根着生少许肿瘤,相互不连接;2级,31%~60%的根着生肿瘤,有大的肿块,相互连接;3级,61%~100%的根着生肿瘤,纺锤形瘤着生在主根使其膨大,膨大延伸到下胚轴,植株发育矮小,生长停止。

表1 十字花科根肿病生理小种Williams鉴别系统[11]1)

2 结果与分析
2.1 单孢分离
950株幼苗接种单休眠孢子并存活,因为密度极低,在外观上病症极小。两年接种扩繁后,筛选出观察到形成菌根瘤的植物,显微镜检测后成功感染单孢为27株(表2)。

表2 在2日龄大白菜根毛上单孢接种根肿病菌87d后发病情况
单孢接种后,孢子增殖是呈指数倍数增加的:开始时由于菌量很小,所以只能在主根上轻微发病。主根上出现小突起(为接种单孢扩繁后的细胞群);随着接种时间的延长、扩繁代数的增加,孢子总数增加,植物根部病变的范围扩大,量变增大,植株感病后因受病菌的刺激造成细胞增生,作物根部形成大小不等的肿瘤(表3)。感染的成功率低可能由于存在技术固有局限性或休眠孢子接种后存活率低。
4号和10号小种进行到第3代扩繁时,除个别植株外,大部分植株主根根瘤长到3级后就停止生长,不再膨大。表明由一个单孢接种的菌根,其病原菌的致病性与田间根肿表现出显著差异,单孢可能由于纯化后病菌活力下降导致没有充分增殖,降低了感病能力[16]。

表3 单孢扩繁的发病情况
7号小种扩繁后3株植株外观没有任何感病症状,离心镜检后却发现含有病菌。且其接种的成功率明显比其他两个小种低,可以看出它相对于其他两个小种为弱势种群,不易感染寄主。
2.2 单孢后代生理小种鉴定
接菌浓度、寄主种群数相同,但是其感染鉴别寄主的能力不同(表4)。
试验所选择的根肿菌生理小种4、生理小种7、生理小种10均为中国平原地区及高山地区主要的致病种群,每一种在当地都给十字花科蔬菜的种植带来了极大的经济损失。但是从分离出来的单孢菌株的致病性来看又有所不同。
平原地区生理小种4在东北本地传染力极强,而其单孢分离出来的菌株也均能显著感染鉴别寄主,包括其中分离出来的诸如生理小种2、生理小种11等单孢菌株若对该鉴别寄主没有抗性,则一定能够深度感染鉴别寄主,感染率多集中在70%~80%,感染力较强。
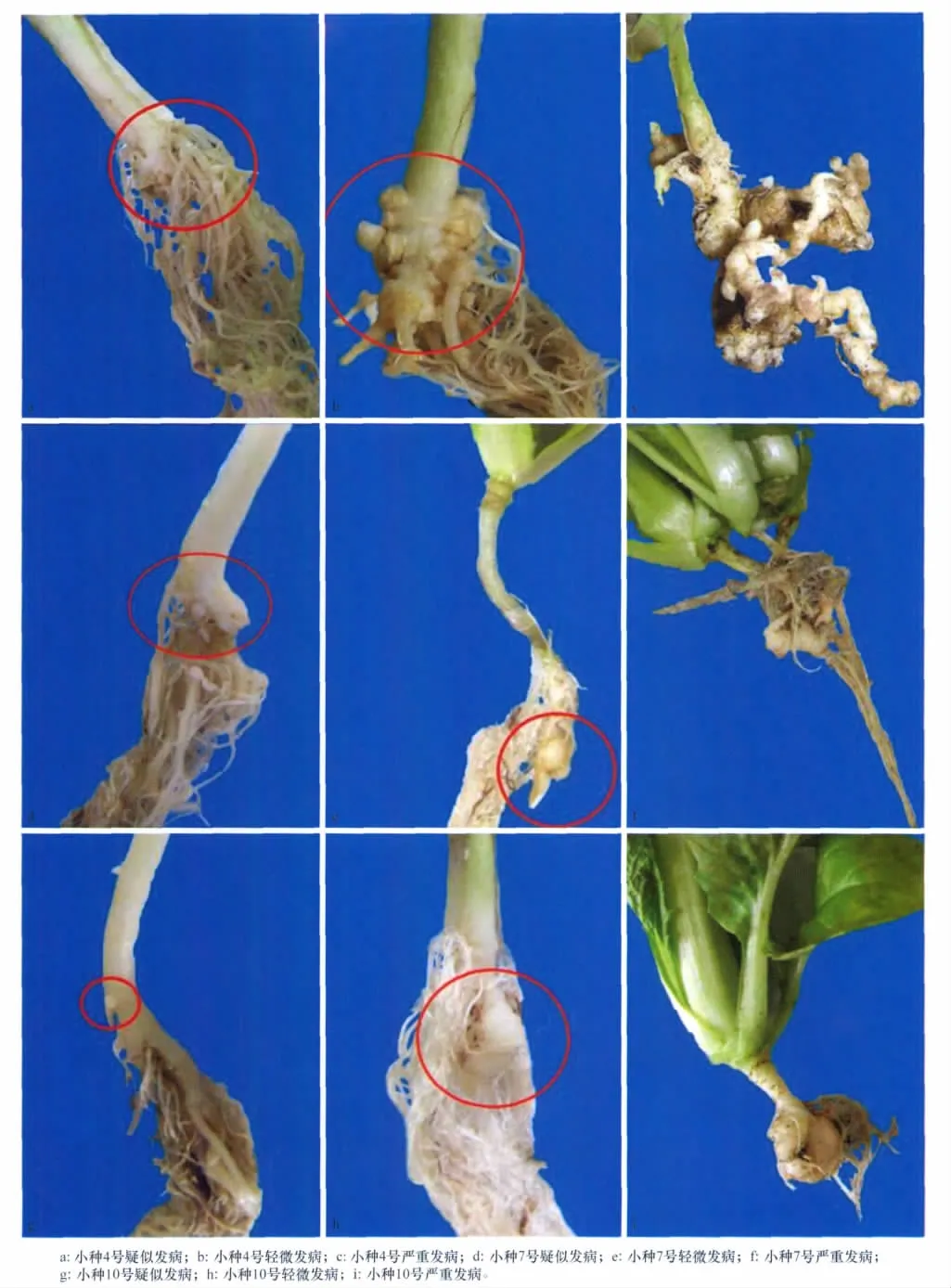
图1 由单一的休眠孢子接种大白菜病情指数分级标准
高山地区生理小种10分离出来的10号小种,虽然为同一种群生理小种分离出来的单孢菌株,但其致病力也不同,编号9对鉴别寄主的感染力较弱,仅为其余8株小种单株感染力的一半左右;而分离出的其他小种的单孢小种12单株和小种14单株感染鉴别寄主的能力较弱,仅为30%~40%,可以看出单孢分离出来的原混生含量较少的附生菌株,致病性较差,不能大量感染鉴别寄主。
高山地区生理小种7虽然混生状态为较强的致病菌,但是单孢分离后致病性非常弱,可见其如果要致病需要小种间协同作用,才能够使植物大面积发病。若只有一种小种则致病力较弱。

表4 采用Williams鉴别寄主对经过继代扩繁发病明显的27株进行小种鉴定的结果1)
由以上鉴定结果可以发现,平原地区根肿菌和高山地区的根肿菌显著不同。
平原地区典型生理小种4在东北本地传染力极强,其单孢分离出来的菌株也均能显著感染鉴别寄主,且扩繁能力较强,能够使鉴别寄主重度感病,苗期感染3级情况较多,严重影响鉴别寄主的发育,重则导致绝收,对十字花科蔬菜主产区生产造成严重威胁[18]。因此平原地区应主要选育抗生理小种4的抗病品种。
高山地区典型生理小种7为弱势小种,3株植株外观没有任何感病症状,离心镜检后却发现含有病原菌孢子,而有明显症状的植株进行Williams鉴定后没有分离出7号小种。虽然混生状态为较强的致病菌,但是单孢分离后致病性非常弱,需要小种间协同致病,才能够使植物大面积发病。
高山地区另一典型生理小种10也分离出3个小种。虽然为同一种群生理小种10分离出来的10号小种单孢菌株,但其致病力却不同。编号9对鉴别寄主的感染力仅为其余的10号小种单株的一半左右;12号小种单株和14号小种单株感染鉴别寄主的能力较弱,说明单孢分离出来的原混生含量较少的附生菌株,致病性较差,不能大量感染鉴别寄主。生理小种10对‘Laurentian’无致病性,可以考虑在高山发病地区种植芜菁甘蓝。
3 讨论
芸薹根肿菌(Plasmodiophora brassicae)生活史的大部分时期都属单倍体[19],发生核配后立即进行减数分裂形成次生游动孢子囊,最后形成休眠孢子[20]。各小种根肿病菌孢子经倒置显微镜观察,休眠孢子形状多为圆形或近圆形,偶见不规则的椭圆形、三角形。悬浮液经观察有1、2、4核的休眠孢子的频率分别为89.3%、10.3%和0.3%[21]。双核休眠孢子平均直径(4.9μm)均大于单核休眠孢子直径(3.5μm)。大型4核休眠孢子(直径≥5μm)有异常不规则形状,活性差,接种成功率极低。单核孢子接种成活率最高。
接种两个月后,950株接种单休眠孢子的植株存活了46株,其中27株形成了菌根,成功感染率为核58.7%,明显高于以前的研究结果[22]。单孢接种有两个技术问题,一个是单孢子获得:经过显微镜多次检测,确保其中只含有一个孢子,增加了单孢接种的准确度[7]。二是成功接种到寄主幼苗上使用无菌土,在适合植物生长的环境下隔离培养,有利于植物发病,病菌实现稳定的增殖[8]。本研究感染非常成功可能是由于两个原因:接种选定活性较强的单核休眠孢子,并使用微管接种使游动孢子有更多感染机会;接种后暗培养2d,使病菌附着并初步进入根毛中,使单株直立便于放入单独容器中进行培养,25℃暗条件下经过3~5d腐烂的根瘤作为病菌来源有利于休眠孢子活化[14]。
从上述小种构成看,原始种群4中分离出2、4、8、11号4个小种,4号单株占63.6%为优势种群,原始种群经过Williams鉴定显示为4号。一个原始种群4,进行单孢分离后一般产生不同的其他种群,新产生的4号小种及其派生的2、8、11单孢菌株的致病性差异可能是由于不同致病型之间的相互作用。一个致病原始小种不同的孢子接种后可能会产生其他致病型,混合后可能会导致在相同的鉴定小种号存在多种致病型。10号优势种群中分离出10、12、14号,10号单株占81.8%为优势种群,原始种群经过Williams鉴定显示为10号。
原始种群7单孢分离后,编号1、2单株致病性较低可能是由于其内部不同小种构成了致病型的混合物,反映了致病性菌株和非致病性菌株之间的协同作用。非致病性菌株也可能诱发抗病的宿主植物染病,从而导致植物发病。编号3、4、5虽然外表没有感病迹象,但是它也在宿主体内增殖,宿主对它有抗性,可能是致病型和宿主基因型之间复杂的相互作用,但以何种形式相互作用,抑制发病的物质基础是什么,仍待深入研究。
本文通过分析27株单孢菌株:非本身小种以外的9个菌株,是通过再接种也不易大量增殖的病原菌株,和被接种的3个小种是有区别的。它们虽然单独看起来是弱势种群,但随着作物品种的多样化可能会转为新的病原型,并成为新的遗传性感染源,或通过跟别的病原型重复感染等的相互作用,有可能引起病害蔓延。
对不同地区生理小种进行大量单孢接种,可以提高接种成功率,且较易分离出罕见生理小种,并为探明根肿菌各种不同生理小种之间是否存在致病性变异和建立生理小种鉴别体系、筛选出专化抗性品种提供依据。
[1] 徐瑞英,徐瑞芹.十字花科根肿病的发生与防治[J].吉林蔬菜,2006(2):41-42.
[2] Crete R.Distribution and importance of cruciferae growing areas and clubroot in 1974[J].Clubroot Newsl,1975,13:3.
[3] Nikolaev S I,Berney C,Fahrni J F,et al.The twilight of Heliozoa and rise of Rhizaria,an emerging supergroup of amoeboid eukaryotes[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101:8066-8071.
[4] Dixon G R.The biology of Plasmodiophora brassicae Wor.a review of recent advances[J].Acta Hortic,2006,706:271-282.
[5] Narisawax K,Kageyama K.Efficient root infection with single resting spores of Plasmodiophora brassicae[J].Mycological Research,1996,100(7):855-858.
[6] Elke Diederichsen,Martin Frauen,Linders E G A,et al.Status and perspectives of clubroot resistance breeding in crucifer crops[J].J Plant Growth Regul,2009,28:265-281.
[7] Se Jeong Jangs,Seung Hwan Heo,Chang Soon Jang,et al.Races and Dominant population of Chinese cabbage clubroot pathogen,Plasmodiophora brassicae in Korea[J].Research in Plant Disease,2007,13(1):45-49.
[8] Koji Kageyama,Yoriko Kamimura,Mitsuro Hyakumachi.A simple inoculation method with a single resting spore of Plasmodiophora brassicae[J].日植病报,1996,61:415-418.
[9] Xue S,Cao T.Isolation and variation in virulence of singlespore isolates of Plasmodiophora brassicae from Canada[J].Plant Disease,2008,92(3):456-462.
[10]杨佩文,李家瑞,杨勤忠,等.十字花科蔬菜根肿病菌休眠孢子的分离与检测[J].云南农业大学学报,2002,17(3):301-303.
[11]Fähling M,Graf H,Siemens J.Characterization of a singlespore isolate population of Plasmodiophora brassicae resulting from a single club[J].Journal of Phytopathology,2004,152(7):438-444.
[12]Williams P H.A system for the determination of races of Plasmodiophora brassicae that infect cabbage and rutabaga[J].Phytopathology,1966,56:624-626.
[13]沈向群,聂凯,吴琼,等.大白菜根肿病主要生理小种种群分化鉴定初报[J].中国蔬菜,2009(8):59-62.
[14]肖崇刚,郭向华.十字花科蔬菜根肿病菌的生物学特性研究[J].菌物系统,2002,21(4):597-603.
[15]孙保亚,沈向群,郭海峰,等.十字花科植物根肿病及抗病育种研究进展[J].中国蔬菜,2005(4):34-37.
[16]吉川宏昭.アブラナ科野菜の根こぶ病抵抗性育种に关する研究[J].野菜、茶业试验场研究报告(野菜、花卉),1993,A7:61-68.
[17]唐文华.北京十字花科蔬菜根肿病的发生和鉴定[J].植物保护,1990,16(1):17-18.
[18]章元寿.植物病理生理学[M].南京:江苏科学技术出版社,1993.
[19]吕理乐.十字花科蔬菜根肿菌[J].云南农业大学学报,2002,17(2):134-136.
[20]Larnmerink J.Physiological specialization of Plasmodiophora brassicae Wor.New Zealand[J].Agriculture Research,1964,7:37-41.
[21]Castlebury L A,Maddox J V,Glawe D A.A technique for theextraction and purification of viable Plasmodiophora brassicae resting spores from host root tissue[J].Mycologia,1994.86,458-460.
[22]Rarisawa K,Kageyama K,Hashiba T.Efficient root infection with single resting spores of Plasmodiophora brassicae[J].Mycological Research,1996,100(7):855-858.

