银杏叶提取物对大鼠高血压、高血糖合并高脂血症的治疗作用*
鲁 茜1,汪建云1,羊倩倩2,张明珠2,尹家乐2,印晓星1**
徐州医学院药学院 1临床药理学教研室,2新药与临床应用实验室,江苏 徐州 221004
随着人们生活水平的不断提高以及饮食结构的变化,高血压、高血脂、高血糖的患者逐年增多。高血压、高血脂、高血糖俗称“三高”,三者可单独存在,相互之间也紧密联系。1988年美国学者Reaven就发现血脂异常、高血压、高血糖常发生在同一个体,并提出“X综合征”的概念(又称高代谢综合征)[1]。当这些疾病共同存在时,其对靶器官的损害远较单种疾病单独存在时更为严重,甚至危及生命。然而目前临床上对于这些患者的治疗往往采用联合用药的方法,即分别对高血压、高血糖以及高血脂进行治疗,这样既增加了药物使用的种类,同时也相应地增加了药物的不良反应。中医药具有多靶点作用、多途径起效的特点,为高血压、高血脂、高血糖的治疗提供了广阔的前景。
银杏叶为银杏科植物银杏的干燥叶,中医主要用于治疗肺虚咳嗽、冠心病、心绞痛、高脂血症等。银杏叶提取物(Ginkgo biloba extract,GBE)是采用现代提取技术从银杏叶中提取的活性物质,主要活性化学成分为黄酮类及萜类。药理学研究表明,GBE中黄酮类成分具有清除自由基、抗氧化、降血脂、改善血流动力学等药理作用,银杏内酯类成分具有抑制血小板活化因子及炎症分泌物的作用[2-3]。近来的研究还发现,GBE能够降低血糖水平,改善胰岛素抵抗,有效防治糖尿病并发症[4]。然而其用于“三高”患者的防治尚未见报道。因此,本研究在建立的实验性高血压、高血糖合并高血脂的大鼠模型上,观察GBE对其的防治作用。
1 材 料
1.1 实验动物
成年自发性高血压大鼠(SHR)及Wistar大鼠,雄性,16周龄,体重280 g±20 g,由北京维通利华实验动物技术有限公司提供,动物合格许可证编号:SCXK(京)2007-0001。
1.2 药物与试剂
链脲佐菌素(streptozotocin,STZ),美国 Sigma 公司;GBE(含银杏黄酮>24%,萜类>6%),邳州富伟生化有限公司提供;总胆固醇(TC)试剂盒、甘油三酯(TG)试剂盒、血清高密度脂蛋白(HDL-C)试剂盒、血清低密度脂蛋白(LDL-C)试剂盒、总超氧化物歧化酶(T-SOD)试剂盒、过氧化氢酶(CAT)可见光试剂盒、谷胱甘肽(GSH)试剂盒及丙二醛(MDA)试剂盒均购自南京建成生物工程研究所;胆固醇、胆酸钠购自安徽天启化工科技有限公司;高脂高糖饲料的组成:猪油10%,蔗糖20%,胆固醇2.5%,胆酸钠0.5%,基础饲料67%,由徐州医学院实验动物中心配制。
1.3 仪器
全自动无创血压测量仪(BP-6A,成都泰盟科技有限公司);半自动生化分析仪(Microlab 300,荷兰威图科学公司);豪稳倍易型血糖仪(美国强生医疗器材有限公司)。
2 方法和结果
2.1 方法
2.1.1 实验性高血压、高血糖合并高血脂大鼠模型的制备 SHR大鼠适应性饲养1周后,称重,给予高脂高糖饲料喂养4周后,腹腔一次性注射STZ 35 mg·kg-1,72 h后眼眶取血,测定空腹血糖≥13.88 mmol·L-1者为糖尿病模型鼠,造模成功。
2.1.2 分组与给药 将成模的56只SHR大鼠随机分成7组:“三高”模型组、GBE低、中、高三个剂量治疗组、卡托普利组、二甲双胍组及洛伐他汀组,每组8只;以Wistar大鼠及SHR作为对照,谓正常组和SHR组,给予正常饲料喂养。其余各组以成模当日作为实验第1天,继续喂以高脂高糖饲料,GBE低中高三个治疗组给药剂量分别为50、100、200 mg·kg-1,卡托普利组剂量为 15 mg·kg-1,二甲双胍组剂量 15 mg·kg-1,洛伐他汀组剂量为 40 mg·kg-1,以1%羧甲基纤维素配成不同浓度的混悬液灌胃给药,每天1次,正常组和SHR组均给予同体积的1%羧甲基纤维素,共治疗8周。
2.1.3 大鼠尾动脉血压测量 室温保持在25℃±2℃,应用全自动无创血压测量仪,采用尾部加压法测量血压。正式测量前,将大鼠用套笼固定放入36℃电热加温恒温箱内,预热约20 min,待大鼠稳定后测压。连续测定血压3次,每次间隔5 min,取平均值作为测压结果。
2.1.4 大鼠血糖的测定 各组大鼠禁食12 h后,眼眶采血,用血糖仪测定各组大鼠血糖。
2.1.5 大鼠糖化血红蛋白的测定 大鼠眼眶采血后,采用挪威特种蛋白金标检测仪(NycoCard Reader II,挪威 Axis-Shield PoC AS公司)及其相关配套试剂盒测定大鼠全血中糖化血红蛋白水平。
2.1.6 大鼠血生化指标的测定 各组大鼠禁食12 h后,眼眶采血,离心后取血浆,采用半自动生化仪及其配套试剂盒测定血总胆固醇、甘油三酯、高密度脂蛋白及低密度脂蛋白。
2.1.7 抗氧化指标及丙二醛的测定 严格按照试剂盒说明书测定CAT、T-SOD、GSH、MDA水平。
2.1.8 统计学处理 各组数据用SPSS 13.0统计软件处理,计量资料以±s表示,多组间比较采用单因素方差分析(ANOVA),两组间比较采用q检验。
2.2 结果
2.2.1 各组大鼠给药前后的血压比较 与正常组相比,给药前SHR组、模型组大鼠的收缩压与舒张压均显著升高(P<0.01),说明此高血压模型建立。给予GBE药物进行治疗后,与模型组相比,GBE高剂量组大鼠的收缩压明显下降(P<0.05),GBE中、高剂量组大鼠的舒张压也出现显著下降(P<0.05);与给药前相比,GBE中、高剂量均可显著降低大鼠的收缩压及舒张压(P<0.01 或 P<0.05),而卡托普利组对大鼠收缩压及舒张压均有明显的降低作用(P<0.01)(见表 1)。
表1 各组大鼠给药前后的血压比较(±s,n=8)
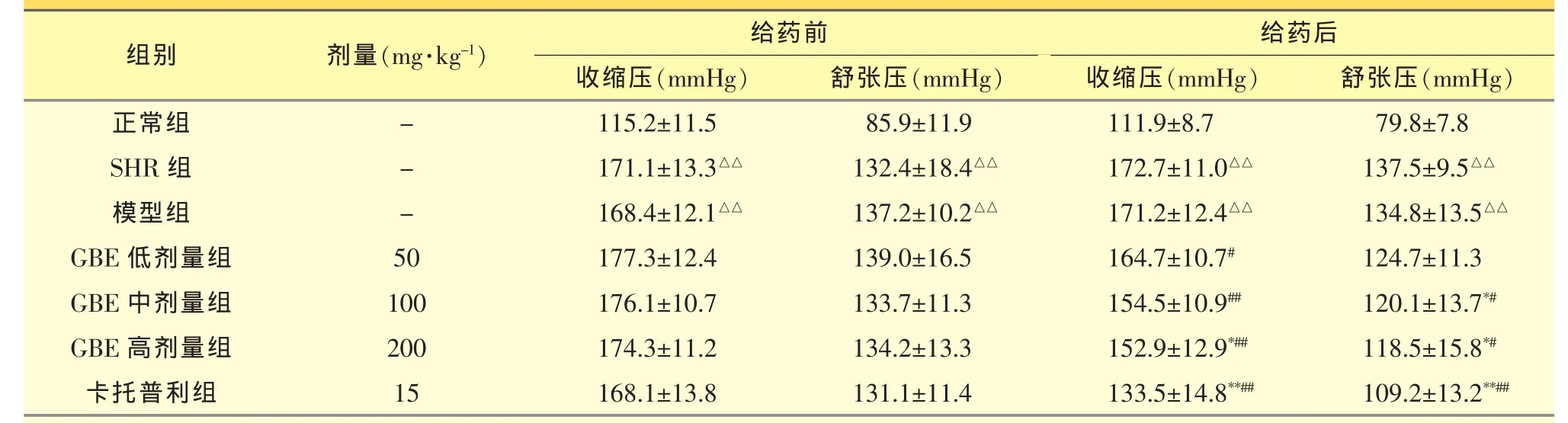
表1 各组大鼠给药前后的血压比较(±s,n=8)
与正常组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01;与给药前比较,#P<0.05,##P<0.01
2.2.2 各组大鼠给药前后血糖水平的比较 与正常组相比,模型组大鼠的空腹血糖和糖化血红蛋白水平显著升高(P<0.01),表明糖尿病模型造模成功。与给药前相比,GBE高剂量组及二甲双胍组大鼠的空腹血糖及糖化血红蛋白的水平均显著下降(P<0.05 或 P<0.01);与模型组相比,GBE 中、高剂量组及二甲双胍组大鼠的空腹血糖有了明显下降(P<0.05),GBE高剂量组及二甲双胍组治疗后糖化血红蛋白水平也相应出现了降低(P<0.05)。见表2。
表2 各组大鼠给药前后血糖水平的比较(±s,n=8)
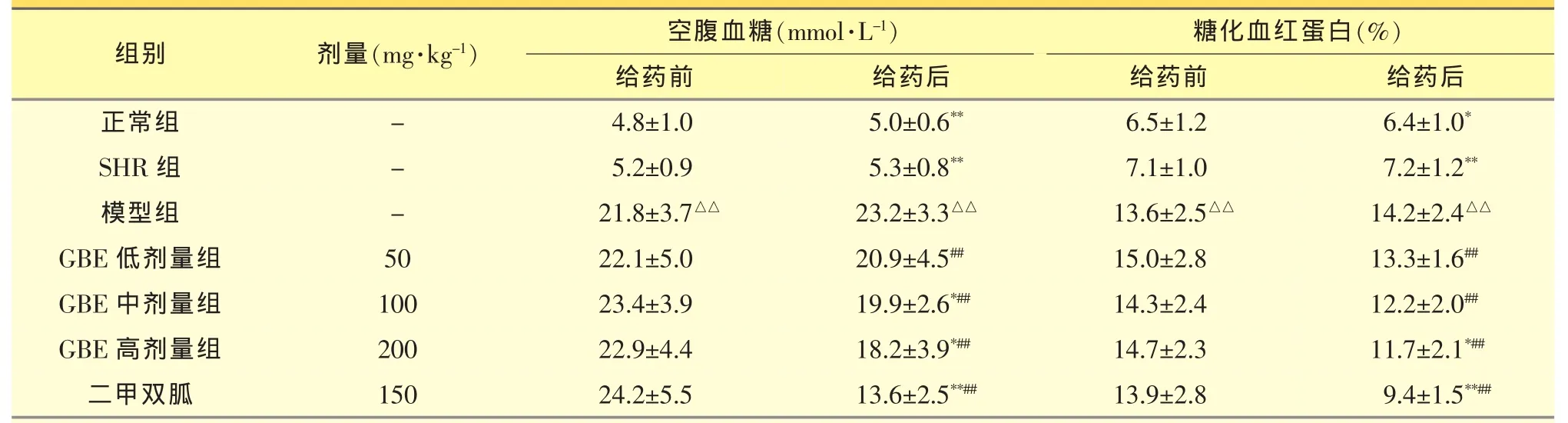
表2 各组大鼠给药前后血糖水平的比较(±s,n=8)
与正常组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01;与给药前比较,##P<0.01
mg·kg-1)19.9±2.6*##二甲双胍18.2±3.9*##15024.2±5.513.6±2.5**##13.9±2.89.4±1.5**##
2.2.3 各组大鼠给药前后血脂的比较 与给药前相比,模型组大鼠血清TG、TC、LDL-C水平显著升高(P<0.01 或 P<0.05),HDL-C 水平显著降低(P<0.05)。GBE或洛伐他汀治疗后,与模型组相比,GBE中、高剂量组大鼠的TG、TC及LDL-C水平明显降低,HDL-C 水平明显升高(P<0.01 或 P<0.05),但与给药前相比无显著性差异(见表3)。此结果表明GBE中、高剂量能够降低高脂饲料导致的TG、TC及LDL-C水平的升高,增加大鼠血清中HDL-C水平,具有一定的降血脂作用。
表3 各组大鼠给药前后血脂的比较(±s,n=8)

表3 各组大鼠给药前后血脂的比较(±s,n=8)
与正常组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01;与给药前比较,#P<0.05,##P<0.01
?
2.2.4 GBE对血清中丙二醛及抗氧化指标的影响与正常组相比,模型组大鼠的血浆中T-SOD水平、CAT活性和GSH酶活力显著降低,MDA水平显著增高(P<0.01),表明模型大鼠的抗氧化能力下降,脂质过氧化能力增强。与模型组相比,GBE中、高剂量能够显著升高大鼠血清中GSH酶活力、T-SOD水平、CAT活力(P<0.05或 P<0.01),降低 MDA 水平(P<0.01),而卡托普利对抗氧化酶活性无显著影响,见表4。此结果表明GBE能显著改善高血压、高血糖合并高脂血症大鼠的氧化应激状态,减轻其脂质过氧化,这对大鼠的高血脂及高血糖具有一定的改善作用。
3 讨 论
高血压、糖尿病合并高脂血症被世界卫生组织列为终生难治性疾病,目前治疗这类疾病的主要方法是以各相关疾病有循证医学支持的指南为基础,在改变饮食结构及生活方式的基础上联合用药,因患者服用药物的种类较多,故药物之间的相互作用不可避免,从而增加了不良反应的风险。
为研究GBE对高血压、高血糖及高血脂的防治作用,本实验采用经遗传变异产生的自发性高血压大鼠作为实验动物,以同品系的Wistar大鼠作为正常对照,通过高脂高糖饲料喂养,并小剂量注射STZ建立动物模型。结果显示模型组大鼠存在高血压、高血糖、高TC、高TG、高LDL-C及低HDL-C的特点。
表4 GBE对大鼠血清中丙二醛和抗氧化酶活力的影响(±s,n=8)
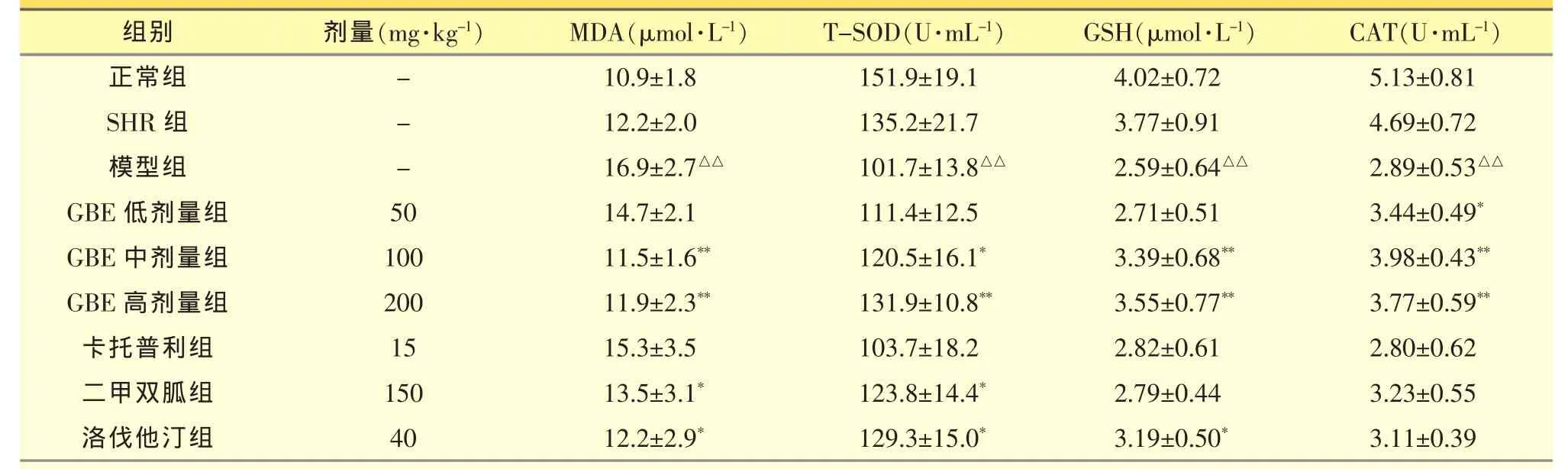
表4 GBE对大鼠血清中丙二醛和抗氧化酶活力的影响(±s,n=8)
与正常组比较,△△P<0.01;与模型组比较,*P<0.05,**P<0.01
13.5±3.1*
目前临床上常用的抗高血压药物如利尿剂、β-受体阻断药、钙通道拮抗剂等尽管可有效降压,但是对于合并血糖升高的患者不能有效改善胰岛素抵抗,有的甚至还可引起血糖和血脂的升高。而血管紧张素转换酶抑制剂及血管紧张素Ⅱ受体拮抗剂不但能降低血压,而且还能够增加胰岛素的敏感性,目前已用于糖尿病肾病的临床治疗[5-6]。研究发现,GBE也具有血管紧张素转换酶抑制剂的同样作用[7]。本实验中证实GBE中、高剂量均可显著降低收缩压和舒张压,因此推测这种降压作用很可能是通过抑制血管紧张素转换酶,减少血管紧张素Ⅱ的生成,从而导致血管舒张而产生的。
糖化血红蛋白是血红蛋白与葡萄糖的长期非酶糖化的产物,它的形成是一个连续、缓慢、不可逆的非酶促反应过程,它反映了测定前4~6周的血糖水平,而且不受血糖暂时波动的影响。因此糖化血红蛋白和空腹血糖的水平对糖尿病患者的治疗、改善预后以及预防有着重要的临床意义。在本实验中,GBE中、高剂量可降低大鼠的空腹血糖,高剂量还可降低糖化血红蛋白水平,说明GBE对糖尿病患者的血糖升高有着一定的防治作用。这种作用很可能与GBE的抗氧化作用、保护了胰岛β细胞,促进胰岛素分泌有关[8]。
糖尿病患者多伴有脂代谢紊乱,高脂血症可导致机体氧化、抗氧化状态失衡,机体的脂质过氧化增强,加剧了氧化应激损伤,导致动脉粥样硬化等心脑血管疾病的发生发展[9]。丙二醛是脂质过氧化的主要产物,本实验模型组大鼠血清中丙二醛含量较正常对照组显著增高,而抗氧化酶如超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶的活力显著降低,表明糖尿病及高脂血症的存在严重削弱了机体的抗氧化防御系统,使其处于氧化应激状态。给予GBE治疗后,大鼠血清中三种抗氧化酶的活性显著增强,丙二醛水平显著降低;且GBE还可显著降低高脂血症大鼠的TG、TC、LDL-C,并升高HDLC含量,表明GBE可显著增加高脂血症大鼠机体的抗氧化能力以及降低其血脂,从而减少因高脂血症产生的过量自由基对机体的损伤作用,这可能是GBE实现调节血脂的机制之一。
GBE作为传统的天然药物具有广泛的药理作用,也蕴含着许多新的待开发的用途。本文的研究表明,GBE可降低高血压、高血糖合并高脂血症大鼠的血压、空腹血糖、糖化血红蛋白以及TG、TC、LDL-C水平,并升高HDL-C含量,展现出GBE作为天然药物多组分、多靶点的治疗优势,然而其具体的作用机制仍需进一步深入研究。
[1]Reaven G.Metabolic sy ndro me∶pathophysiology and implications for management of cardiovascular disease[J].Circulation,2002,106(3)∶286-8.
[2]Eckert A.Mitochondrial effects of Ginkgo biloba extract[J].Int Psychogeriatr,2012,24(l)∶S18-20.
[3]Lim S,Yoon JW,Kang SM,et al.EGb761,a Ginkgo biloba extract,is effective against atherosclerosis in vitro,and in a rat model of type 2 diabetes[J].PLoS One,2011,6(6)∶e20301.
[4]Lu Q,Yin XX,Wang JY,et al.Effects of Ginkgo biloba on prevention of development of experimental diabetic nephropathy in rats[J].Acta Pharmacol Sin,2007,28(6)∶818-28.
[5]马妮娜,沈潞华.氯沙坦对高血糖合并高血压患者胰岛素敏感性的影响 [J]. 中国全科医学 ,2008,11(22):2019-24.
[6]Tominaga N,Robert A,Izuhara Y,et al.Very high doses of valsartan provide renoprotection independently of blood pressure in a type 2 diabetic nephropathy rat model[J].Nephrology,2009,14(6)∶581-7.
[7]Pinto Mda S,Kwon YI,Apostolidis E,et al.Potential of Ginkgo biloba L.leaves in the management of hyperglycemia and hypertension using in vitro models[J].Bioresour Technol,2009,100(24)∶6599-609.
[8]李旭升,黄斌伦,陈国荣,等.银杏叶提取物对糖尿病大鼠血糖代谢的影响 [J].浙江中西医结合杂志,2004,14(7)∶403-4.
[9]Kaneto H,Katakami N,Matsuhisa M,et al.Role of reactive oxygen species in the progression of type 2 diabetes and atherosclerosis [J].Mediators Inflamm,2010,2010∶453892.

