力竭运动对大鼠窦房结超级化激活环核苷酸门控通道的影响
薄冰常芸
1 上海体育学院(上海 200438)
2 国家体育总局体育科学研究所
·基础研究·
力竭运动对大鼠窦房结超级化激活环核苷酸门控通道的影响
薄冰1,2常芸2
1 上海体育学院(上海 200438)
2 国家体育总局体育科学研究所
目的:探讨2周力竭运动对大鼠窦房结超级化激活环核苷酸门控通道亚基HCN1、HCN2、HCN4mRNA表达及通道电流密度的影响。方法:健康雄性SD大鼠180只,8周龄,体重(220±8)g,共分9组,每组20只,包括安静对照组(C组)1组、一次力竭组(O组)4组和反复力竭组(R组)4组。安静对照组不施加任何运动影响,反复力竭各组大鼠尾部负重为体重的3%,每天1次力竭游泳,每次运动时间控制在2小时左右,每周运动6天,共2周,一次力竭组大鼠在正常喂养2周后进行一次力竭游泳运动,运动方案同反复力竭组。运动组大鼠分别于运动后即刻、4小时、12小时、24小时不同时相取材,一次力竭运动各组分别命名O-0h、O-4h、O-12h、O-24h,反复力竭运动各组分别命名R-0h、R-4h、R-12h、R-24h。应用实时荧光定量PCR技术测定HCN通道亚基HCN1、HCN2、HCN4mRNA表达变化,细胞急性分离及全细胞膜片钳技术测定通道电流密度变化,观察力竭游泳运动对大鼠窦房结细胞膜上HCN通道的影响。结果:(1)与对照组相比,一次力竭组O-0h组HCN1、HCN4mRNA相对表达量显著升高(P<0.05,P<0.01),O-4h组HCN1、HCN4显著升高(P<0.01,P<0.05);反复力竭组R-0h与R-4h组HCN1显著下降(P<0.01,P<0.01);反复力竭各组HCN2、HCN4 mRNA表达显著下降(P< 0.01)。(2)反复力竭各时相组HCN通道电流密度显著低于对照组及一次力竭组。结论:两周力竭运动可引起窦房结HCN通道亚基HCN2及HCN4 mRNA表达下降,通道If电流密度减少,这可能成为运动引发窦房结功能障碍的离子通道机制之一。
力竭运动;窦房结;超级化激活环核苷酸门控通道
窦房结(SAN)细胞以舒张期缓慢自动除极为特征,即在动作电位末期自发除极至下一动作电位的阈电位,这也是窦房结细胞生成自发起搏活动的电学基础[1],同时也是建立在起搏细胞膜上多种离子通道共同活动的基础之上。在参与起搏活动产生及调节的多种机制中,HCN通道携带的“funny电流”作为起搏电流,发挥着极其重要的作用[2,3]。
1977 年,Normo等[4]在对兔窦房结进行研究时发现一种特性与众不同的电流,将其命名为“funny电流 (funny current,If)”。 随着研究的不断深入,DiFrancesco等[5]发现该电流在窦房结细胞超级化时被激活,因而该电流也称为超级化激活电流,携带这一电流的通道被称为超级化激活环核苷酸门控通道(Hyperpolarization-activated cyclic nucleotide-gated channels,HCN channel)。If是由Na+和K+组成的混合型阳离子电流,称之为“funny电流”,是因为在生理条件下,If的激活是通过超级化电压阶跃至接近细胞静息电位的内向电流,约为-40 mV,这表现出If的开放与静息期膜电位的关系。基于这一特性,Brown等[6]认为If参与静息电位并引起细胞膜动作电位除极;If的最大激活电位在-100mV,完全活化电流―电压关系曲线显示反转电位接近-10 mV,表明If在细胞舒张期去极化生成中的重要作用。因为内向电流的激活可引起去极化,If的激活电压与窦房结细胞舒张期去极化电压(接近-40 mV到-65 mV)重叠,因此,If适宜成为舒张期去极化的“起搏”电流。
从小鼠[7]、兔[8]和人[9]中克隆出4种编码生成If电流的HCN通道基因亚型,命名为HCN1-4。每种亚型都含有6个跨膜区域和1个环核苷酸结合区域(cyclic nucleotide-binding domain,CNBD)。HCN通道的4种基因亚型在哺乳动物心脏组织中均被发现,窦房结组织的主要亚型是HCN1、HCN2和HCN4,负责形成携带If电流的通道,其中,最主要的HCN转录产物是HCN4。
相关研究发现,HCN通道改变可导致窦房结产生自发起搏活动及其频率异常[2,3],但运动医学领域关于运动对于窦房结细胞HCN通道的影响却未见报道,因此,本文即以HCN通道亚基mRNA表达及通道电流密度为切入点,应用实时荧光定量PCR、细胞急性分离及全细胞膜片钳技术,观察力竭游泳运动对大鼠窦房结细胞膜上HCN通道的影响,为进一步探讨运动性窦房结功能障碍及运动性心律失常提供实验论据。
1 材料与方法
1.1 动物与分组
健康雄性SD大鼠180只,8周龄,体重(220±8)g,由北京维通利华实验动物技术有限公司提供,动物生产许可证号2011-0001。动物提取后,随机分为9组,每组20只,包括安静对照组1组、一次力竭组4组和反复力竭组4组。运动组大鼠分别于运动后即刻、4小时、12小时、24小时不同时相取材,一次力竭运动各组大鼠分别以O-0h、O-4h、O-12h、O-24h命名,反复力竭运动各组大鼠分别以R-0h、R-4h、R-12h、R-24h命名,以观察运动结束后窦房结HCN通道亚基mRNA表达及电流密度变化与时间的关系。国家标准啮齿动物饲料喂养,自由饮食。饲养环境为室温(18±2)℃,光照时间12小时,相对湿度为40%~50%。本实验在国家体育总局体育科学研究所分子生物学实验室及病理学实验室完成。
1.2 运动方案
安静对照组不施加任何运动。运动组大鼠进入动物房后先适应3天,然后进行2天适应性游泳运动(20分钟/次)。反复力竭各组大鼠尾部负重约为体重的3%,进行2周力竭游泳,每周运动6天,每天1次,每次运动2个小时左右。每次运动结束后,用干毛巾迅速擦干大鼠身上水分,电吹风把毛吹干后,放回笼中休息。并在最后一次力竭游泳后即刻、4小时、12小时、24小时不同时相取材。一次力竭运动各组大鼠正常喂养2周后,进行一次性力竭游泳运动,尾部负重约为体重的3%,并在力竭运动后即刻、4小时、12小时、24小时不同时相取材。力竭标准参照Thomas[10]的报道,即经过10s后动物仍不能返回水面,并且捞出后置于平面不能完成翻正反射。
1.3 测试方法
1.3.1 实时荧光定量PCR检测
1.3.1.1 大鼠心脏窦房结组织取材
使用10%水合氯醛(1ml/100g体重)腹腔注射麻醉,待大鼠结膜反射、翻正反射消失后,仰卧固定,75%酒精消毒胸腹部皮肤。打开胸腔后游离出上腔静脉,沿离心方向约0.5 cm处剪断;沿着界沟行切口打开右心房进入腔静脉,由靠近并平行于界嵴的腔静脉区域分离出一条形组织,其中含有主要起搏细胞。
1.3.1.2 大鼠心脏窦房结总RNA提取
采用TRIzol法提取心脏窦房结总RNA。将收集管中的细胞或细胞团转移到含有1ml TRIzolReagent的EP管中,颠倒混匀,室温静置5~10 min,加入200 μl氯仿,手动剧烈震荡混匀15 s,室温静置2~3 min,4℃、12000转/min离心10 min,转上层水相(500~600 μl)于另一新1.5m l EP管中,加等体积异丙醇(500~ 600μl),混匀,室温放置30min。弃上清,加DEPC水溶液溶解,-80℃保存。
1.3.1.3 逆转录RNA合成为cDNA
根据样品数量按下列反应体系配制反应混合液,引物Oligo(dT),10 pmol/μl(2μl)、10 mM dNTP mix(4μl)、H2O(24μl)共30μl。将混合液分装到0.2 ml PCR管中,分别加入2μl RNA(约2μg左右),70℃变性5min,冰上速冷2min,离心将溶液收集至管底。按顺序根据下列反应体系配置混合反应液:5×PCR buffer(10μl)、DTT(6μl)、M-MLV RT(酶)(MMLV-Promega)(2μl),共18μl。将上述混合物分装到上述0.2 ml PCR管中,共计50μl体系。42℃延伸50min,95℃保温5min终止反应。cDNA保存于-20℃备用。
1.3.1.4 引物设计及合成
通过互联网搜索Genbank查找基因序列,应用Primer5软件进行引物设计,将设计好的引物用序列分析软件分析其二级结构并做BLAST分析其特异性,所有引物扩增目的基因片断长度均小于150 bp。设计的引物由Invitrigin公司合成。引物序列见表1。
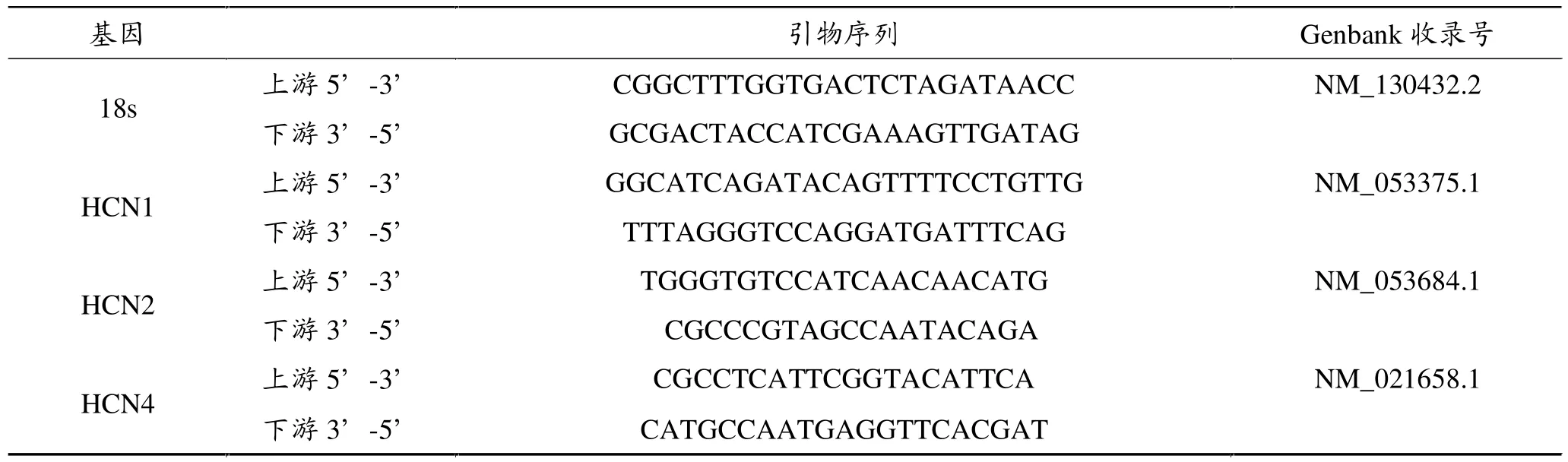
表1 Real-time PCR基因引物序列
1.3.1.5 SYBR GREEN荧光定量PCR
将cDNA和引物解冻,取定量PCR用的96孔板,按如下成分加入:RealqPCR Master Mix(12μl)、引物F/R (上下游引物终浓度均为10 pmol/μl)(0.5/ 0.5μl)、H2O (11μl)。最后加入相对应的cDNA(1 μl),共25μl,封膜。打开ABI7900HT定量PCR仪,进行实时定量PCR实验,反应条件如下:95℃10 min;95℃ 15 s,60℃ 1 min,(生成扩增曲线);95℃ 15 s,60℃60 s,95℃15 s(生成溶解曲线),上述反应共40个循环。
1.3.1.6 mRNA结果分析
观察溶解曲线,判断PCR特异性;以2-△△Ct作为计算公式,分析各组mRNA表达差异,每个反应重复3次,实验结果以均数±标准差(±s)表示,数据采用SPSS 13.0软件及EXCEL软件中单因素方差分析(ANOVA),各实验组与对照组之间的显著性差异采用SNK法,P<0.05为显著性差异,P<0.01为非常显著性差异。
1.3.2 大鼠窦房结细胞膜HCN通道电流密度测定
1.3.2.1 大鼠窦房结细胞急性分离
[11,12],将分离后的心脏行主动脉逆行插管,固定后悬挂于Langendorff灌流装置上,以普通Tyrode液灌流3~5 min,灌流速度7 ml/min,静水压70 cmH2O,温度37℃。待心腔内残血全部流出后,将普通Tyrode液换成无Ca2+-Tyrode液以消除自发节律。从灌流装置上取下心脏,在无Ca2+-Tyrode液中沿着界沟行切口打开右心房进入腔静脉,由靠近并平行于界嵴的腔静脉区域分离出一条形组织,其中含有主要起搏细胞。分离的窦房结组织置于2ml离心管中,管中充满2ml含有0.85mg/ml Collagenase II、0.4 mg/ ml Elastase type II-A和13.5μl/ml Protease(1 mg/ 100μl)的无Ca2+-Tyrode液,并置于37℃水浴20~23 min。最后,将条形组织转移至含有KB液的培养皿中,更新3次KB液以去除酶液。用尖端直径2mm的玻璃吸管轻柔吹打KB液7~9min,使用200目微孔不锈钢滤网过滤去除结缔组织和未消化细胞,滤液于室温下静置30min以备用。实验环境温度在18~28℃之间,实验中所有灌流液均用医用纯氧饱和并在灌流过程中持续通氧。
1.3.2.2 全细胞膜片钳记录大鼠窦房结HCN通道电流密度
取出完成贴壁的窦房结细胞培养皿,置于倒置显微镜下,用氧饱和的电极外液灌流,灌流速度约1 ml/min,冲去死亡细胞碎片。选取处于静息状态下的表面光滑、横纹清晰、折光好、立体感强的单个SAN细胞为研究对象。本研究采用硅酸盐硬质玻璃制作记录电极 (武汉华中科大仪博生命科学仪器有限公司),经P-97(Sutter美国)水平拉制仪两步拉制而成。电极充灌电极液后电阻为2.5~3.5MΩ。将玻璃微电极安置于膜片钳放大器(HEKA EPC10德国)前端探头夹持器上,然后缓慢调节微操仪推动电极尖端接触到细胞膜,当电阻值达到1~2GΩ时即形成高阻封接,此时补偿快电容,然后采用脉冲式负压吸引,将封接吸入电极尖端内的细胞膜片吸破,即“破膜”,使电极内液与细胞内液相沟通,形成全细胞记录状态,示波器上显示跨细胞膜电容电流,随后进行慢电容补偿(C-Slow Capacitance compensation),并记录细胞膜电容值。实验刺激信号由pulse+pulsefit8.6软件控制,通过Ag-AgCl电极丝和填充电极内液的微电极导入细胞,产生的电流信号经EPC10放大、滤波,将记录的原始数据图像存入计算机硬盘。在pulse8.6应用程序中打开原始数据文件,找出各道指令电压下的电流图,测定其电流值。实验温度为18~28℃。
1.3.2.3 溶液配制
正常台氏液(mmol/L):NaCl 140,KCl 5.4,HEPES 10,MgCl21,CaCl22,Glucose 10, (pH 7.4 NaOH);无钙台氏液 (mmol/L):NaCl 140,KCl 5.4,HEPES 10,MgCl21,Glucose 10,(pH 7.4 NaOH);KB液 (mmol/L):L-谷氨酸120,KOH 80,EGTA 0.3,KCl 20,HEPES 10,MgCl21,Glucose 10,(pH 7.4 KOH)。消化酶液(mmol/L):5m l无钙台氏液中加入0.85mg/ ml CollagenaseⅡ、0.4mg/ml Elastase type II-A和13.5 μl/m l Protease(1mg/100μl);HCN通道电极内液(mmol/ L):K-aspartate 110,KCl 20,MgCl21,Na2ATP 5,Na-GTP 0.1,HEPES 10,Na-phosphocreatine 5,EGTA 5,(pH 7.3 KOH),0.22μm微孔滤膜过滤后分装于1 mlEP管,-20℃冰箱储存;HCN通道电极外液(mmol/ L):NaCl 140;KCl 5.4;HEPES 10,MgCl21,CaCl21,Glucose 10,BaCl21(阻断内向整流K+通道),(pH 7.4 NaOH)。CollagenaseⅡ购于Worshington Biochemical公司,EGTA、HEPES、L-谷氨酸、Na2ATP、Na-GTP、Elastase type II-A及Protease均购于Sigma公司,其它试剂为化学分析纯。
1.4 统计学分析
全细胞膜片钳实验结果以通道电流密度数值表示,电流密度为电流强度与膜电容的比值(pA/pF),其中电流强度为实验所测量电流峰值,膜电容为实验中记录到的单个细胞电容值。实验结果中各通道电流密度以均数±标准差(±s)表示,数据采用SPSS 13.0软件及EXCEL软件中单因素方差分析(ANOVA),各实验组与对照组之间的显著性差异采用SNK法,P<0.05为显著性差异,P<0.01为非常显著性差异。
2 结果
2.1 大鼠窦房结HCN通道亚基mRNA表达
图1 琼脂糖凝胶电泳
如表2所示,与对照组相比,一次力竭组,O-0h组HCN1、HCN4显著升高(P<0.05,P<0.01),O-4h组HCN1、HCN4也出现显著升高 (P<0.01,P< 0.05),O-12h组和O-24h组无显著变化;反复力竭组R-0h与R-4h组HCN1 mRNA表达显著下降 (P< 0.01,P<0.01),随着取材时间的延长,HCN1呈上长升趋势,R-12h、R-24h组与对照组相比无显著差异;反复力竭各组HCN2、HCN4 mRNA表达显著下降,显著低于对照组及一次力竭组(P<0.01),分析数据趋势可见,随着运动结束后休息及取材时间的延长,HCN2与HCN4相对表达量逐渐增加,但仍未恢复至对照组水平。
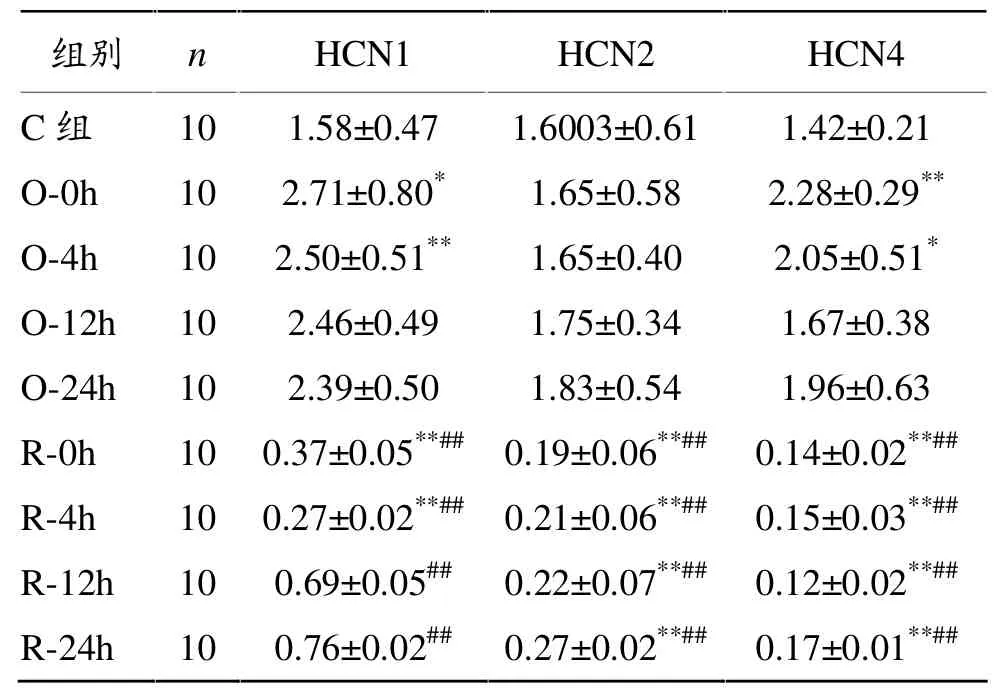
表2 各组大鼠窦房结HCN通道亚基HCN1、HCN2、HCN4m RNA相对表达量(2-△△Ct)
2.2 各组大鼠窦房结HCN通道电流密度
在电极外液中加入1 mmol/L BaCl2以阻断内向整流K+通道,当形成全细胞封接后,给予细胞保持电位-40 mV,以10 mV步阶,-50 mV~-110 mV、3000 ms的阶梯刺激方波,然后复极至-40mV,记录到If电流(如图2)。当SAN细胞经由含2mmol/LCsCl的正常台式液灌流5 min后,按照同一钳制方案无法记录到内向电流,表明这一超级化激活内向电流为If电流。如表3所示,与对照组相比,一次力竭运动对于大鼠窦房结HCN通道If电流密度无明显影响,反复力竭各时相组If电流密度显著下降(P<0.01)。
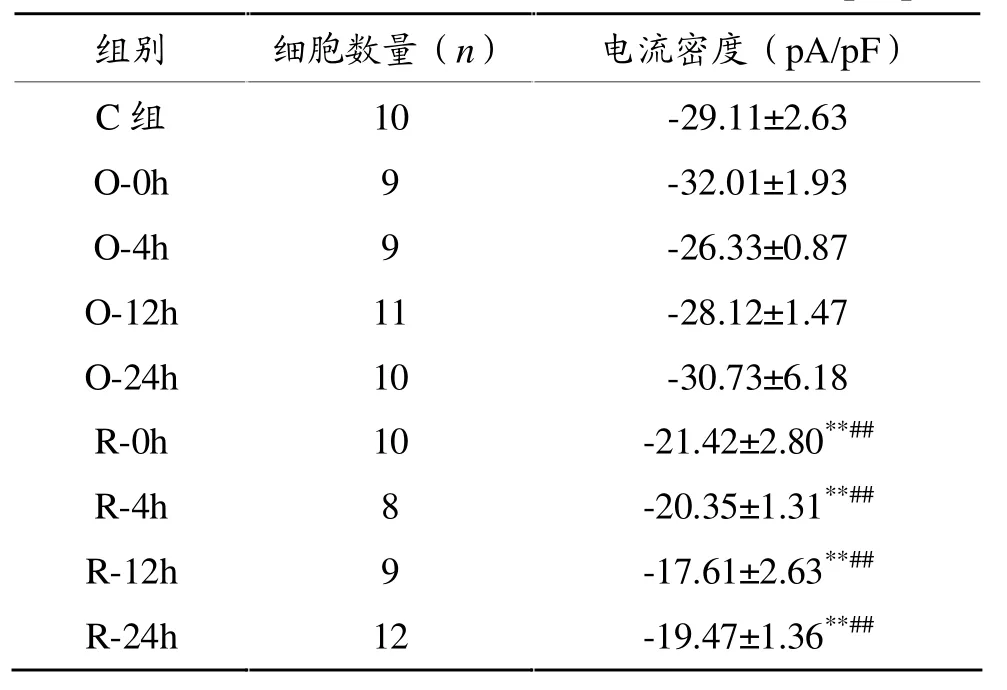
表3 各时相组大鼠窦房结细胞HCN通道电流密度(pA/pF)
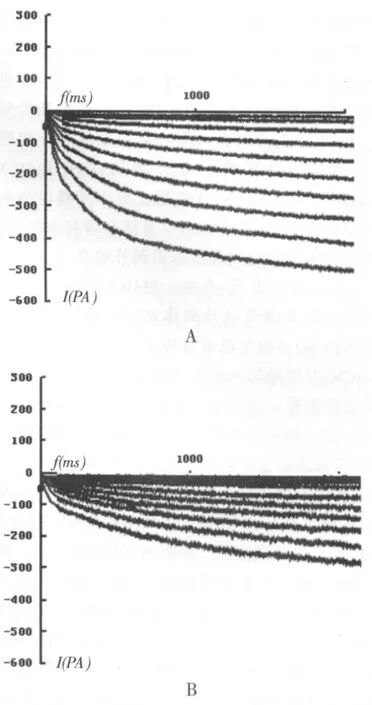
图2 对照组(A)和反复力竭即刻组(B)大鼠窦房结If电流原始图
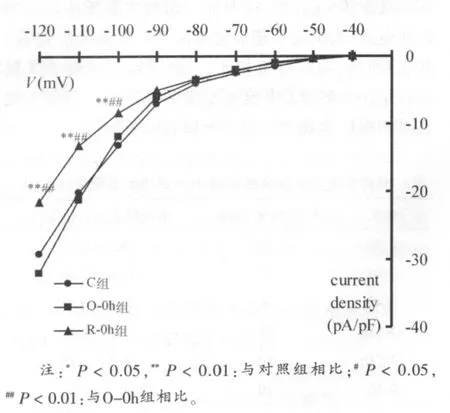
图3 对照组、一次力竭组即刻组和反复力竭即刻组I-V曲线
3 讨论
窦房结起搏细胞中,HCN通道是唯一在膜超级化电位被激活的电压依赖性通道,该通道可在复极化后期接近最大舒张电位时开放。根据电流学观点,HCN通道携带的起搏电流If可以启动舒张期去极化的第一部分直至达到T型和L型Ca2+通道的激活阈电位[13,14]。 Ludwig等[15]在人类心脏中发现两种起搏通道,If的快成分和慢成分分别是HCN2和HCN4。Stieber等[16]指出,HCN2能够阻止舒张期膜电位向更负的方向变化,而HCN4主要维持起搏频率的稳定,并随着机体不同的生理状态而调节频率。
Ludwig等[17]发现,小鼠心脏HCN2通道失活可导致窦房结节律障碍以及离体窦房结细胞中If减小,这提示HCN2基因失活可减慢HCN通道活化速率。然而,HCN2基因敲除小鼠心率并未下降,而表现出间隔很短的窦性心律失常,实验小鼠其它心脏节律参数均正常。该研究小组还观察到窦房结细胞中,由cAMP刺激的最大If电流也未发生变化。由此可见,HCN2基因敲除小鼠的窦房结节律障碍提示,该通道可能在稳定心率方面发挥作用。另有研究发现[18],HCN2离子孔道改变不仅抑制HCN2通道电流,而且减少HCN4通道电流,而HCN2变异孔道的过度表达会引起负性抑制或If“敲除”效应,导致初生大鼠心肌细胞自发节律活动消失。这进一步说明HCN通道是重组的,某一通道亚基基因表达变化会影响到其它亚基在通道组成中所占的合适比例,进而影响亚基所发挥的功能。本实验发现,一次力竭运动未引起HCN2mRNA表达变化,而反复力竭运动则导致大鼠窦房结HCN2基因表达下降,长时间大强度运动引起的HCN2基因下调并与其它亚基HCN1和HCN4基因表达下降协同作用,引起窦房结起搏细胞HCN通道的If电流变化,可能诱发与HCN2基因敲除小鼠类似的窦性心律失常发生。
HCN4作为HCN通道的主要亚基,其编码的通道参与形成了80%窦房结细胞If,这一超级化激活的电流参与窦房结细胞膜舒张期膜电位的自动除极。Chandler等[19]应用聚合酶链反应结合原位杂交和免疫荧光染色法对人窦房结、右心房组织相关离子通道mRNA表达进行分析,结果表明,与右心房相比,窦房结HCN4 mRNA表达更高。Xiao等[20]采用Realtime PCR技术检测窦房结和心房组织HCN通道基因表达,发现人窦房结组织HCN4表达水平高达75%,可见,HCN4通道在心脏搏动的形成中发挥至关重要的作用。动物模型研究发现,HCN4基因改变与遗传性窦性心动过缓相关[21,22],心脏全部或局部HCN4通道失活可引起小鼠胚胎致命性损害,小鼠胚胎缺失HCN4可导致发育停止[23,24],胚胎期HCN4基因缺陷小鼠在胚胎期第10天出现心率缓慢,心脏搏动频率减少了40%;HCN4基因敲除小鼠胚胎在受精后9~12天死亡[25]。此外,HCN4基因缺陷小鼠心脏不能被肾上腺素所激动,导致cAMP失去对心率的调节作用。这提示至少在胚胎时期前11.5天内的胚胎心脏中,HCN4通道基因并非形成心脏搏动的首要因素,而该通道也是心率自主调节所必须的重要因素。HCN4通道亚基在成年期小鼠中的作用与胚胎期不同。如,并未在缺少HCN4的成年小鼠身上观察到发育停止或死亡。Herrmann等[25]建立的HCN4基因敲除小鼠(H cn4Cmouse)模型表明,H cn4C成年小鼠发育正常,但窦房结细胞If电流减少80%,并表现出以反复窦性停搏为特征的心律失常,活动时这一症状减少,恢复基础心率后,窦性停搏再次出现。可见,成年H cn4C小鼠以反复发生窦性停搏为特征,Hermann等[25]等发现,H cn4C小鼠窦房结起搏细胞超级化电压约增加8 mV,且在基础状态下不会自发性除极,但这种功能损害可以通过应用肾上腺素刺激弥补。上述研究结果提示,在成熟的窦房结细胞中,HCN4通道可以提供一个稳定的起搏电位,但多数条件下,尤其是交感神经刺激下,HCN4似乎并不能提升起搏活动的稳定性。然而,随着复极电流的增加,例如迷走神经兴奋或心脏由兴奋期过渡到恢复期,HCN4通道激活并提供除极电流,从而保持系统的良好平衡。这种“除极储备”的缺失可以解释HCN4基因敲除小鼠发生窦性停搏的机制。这表明,HCN4是肾上腺素调节窦房结活动的重要机制之一。综合既往研究可见,HCN4基因表达变化与窦房结细胞HCN通道介导的If电流变化及神经系统对心率的调节密切相关。本研究发现,两周力竭游泳运动导致大鼠窦房结细胞HCN4 mRNA表达明显下降,提示反复大强度运动可导致HCN4基因表达下调,可能引起HCN4通道介导的If电流的改变,同时,离体窦房结细胞If电流密度减小,这与既往研究[25]一致。此外,HCN4结构中所包含的cAMP结合区域CNBD的缺失和突变与心率的稳定及神经系统对心率的调节密切相关,反复大强度运动引起的HCN4基因表达下调可能削弱训练比赛中交感神经张力增高所诱导的心率增加,而这种窦房结活动的减弱及交感神经反应性下降可能导致窦性停搏、异位起搏点等恶性心律失常出现,以及心输出量减少所导致的心、脑、肾等器官无法满足机体运动需求等猝死危险因素的增加。
结合力竭游泳运动对HCN通道亚基HCN1、HCN2、HCN4mRNA表达影响的研究结果,本实验进一步对HCN通道携带的If电流变化进行了测量。结果表明,两周反复力竭运动明显降低If电流密度,下降幅度达37%,随着时间延长,电流密度变化呈上升趋势,但在24 h内仍明显低于对照组。可见,高强度、长时间的运动训练可能导致If电流密度下降,而该通道电流减少可导致窦房结功能异常。研究发现,离体窦房结组织和起搏细胞中阻断HCN通道If可减慢起搏活动,在体实验也发现类似效应。If电流对Cs+的敏感性被用来推断If在窦房结起搏活动中的作用,2~5mmol Cs+可显著减慢起搏速率。Gao等[26]在2009年的研究进一步证实If在窦房结细胞起搏活动形成及调节中的作用。该研究小组对急性分离的狗窦房结细胞使用If阻断剂ZD7288 3μM后发现,窦房结细胞的自发活动速率下降幅度达27%并出现不规律,4期自动除极也受到影响。ZD7288还导致最大舒张电位负向增加3 mV,这一现象说明If在稳定膜舒张期电位中具有重要作用。舒张期去极化包含两个部分,早期的线性部分和后期的非线性部分,综合既往研究[27,28]发现,If可能与早期的线性部分有关。 阻断If后还可影响β-肾上腺素受体对窦房结细胞动作电位速率的增加效应。Gao等[26]使用异丙肾上腺素灌流窦房结细胞,发现与未使用阻断剂组相比,预先使用ZD7288的细胞自发活动明显下降,其它两种If阻断剂ivabradine和Cs+也可引起类似效应。可见,If在β-肾上腺素加速窦房结自发活动中具有重要的作用。
力竭运动对大鼠窦房结细胞HCN通道影响的原因可能与运动心脏在神经体液因素调节下,结构、功能及代谢诸方面的心脏重塑有关。窦房结内细胞具有能量代谢低的特点,这是窦房结在缺血缺氧、代谢抑制等非生理条件下维持心脏正常节律的重要结构基础。然而,长时间、高强度的反复训练仍会造成窦房结细胞和组织的损伤性改变。朱永泽等[29]通过组织学研究发现,一次力竭运动即可造成窦房结内的P细胞和T细胞发生损伤性改变,1周反复力竭运动则引起窦房结细胞内线粒体弥漫性增生、大量凋亡细胞散在分布、起搏细胞间连接混乱等超微结构改变。Moffat等[30]研究Langendorff灌流心脏发现,缺血可引起心率减慢。Gryshenko等[31]应用低pH(6.6)“缺血”Tyrode’s模拟缺血条件下的细胞外酸性环境,发现兔窦房结细胞的起搏活动周期也相应改变,如舒张期去极化减慢、动作电位幅度减少等,在代谢抑制兔窦房结细胞中观察到If减弱,结合运动训练后的窦房结组织学改变可以发现,反复大强度运动训练导致的窦房结缺血缺氧改变可能是窦房结细胞膜上HCN通道亚基及电流发生改变的原因之一。然而,与之前研究中模型的不同之处在于,两周力竭游泳运动对大鼠窦房结缺血缺氧的影响程度与直接进行“缺血”Tyrode’s液灌流有明显差异,对于窦房结细胞HCN通道电流的改变也不尽相同,因此,评估运动训练中不同强度、类型、持续时间造成窦房结组织缺血缺氧的程度及对HCN通道的影响还需深入探讨。此外,多种病理状态,如心房纤颤[32,33]、心肌肥厚、心肌梗死或心力衰竭等,均存在窦房结、心房和心室HCN2、HCN4通道基因的表达异常,导致心脏不同部位心肌细胞If电流升高或降低,而这可能与窦房结起搏活动效率下降及异位起搏点的产生有关,并可诱发致死性心律失常,这也是运动猝死的主要原因之一。
综上,HCN通道介导的If作为“起搏电流”,在窦房结起搏活动的生成和调节中具有重要作用,两周力竭游泳运动可导致大鼠窦房结HCN通道主要亚基HCN2和HCN4mRNA表达下降,以及If电流密度减小,可见,长时间高强度运动对HCN通道结构组成及电生理活动的影响可能成为长期运动引发窦房结功能障碍的主要离子通道机制之一。
4 总结
两周力竭运动可引起窦房结HCN通道亚基HCN2及HCN4mRNA表达下降,If电流密度减小,这可能成为运动引发窦房结功能障碍的离子通道机制之一。
5 参考文献
[1]DiFrancesco D.Pacemaker mechanisms in cardiac tissue.Annu Rev Physiol,1993,55:455-472.
[2]DiFrancesco D.The contribution of the ‘pacemaker’current(if)to generation of spontaneous activity in rabbit sinoatrial nodemyocytes.JPhysiol,1991,434:23-40.
[3]DiFrancesco D.Cardiac pacemaker:15 years of"new"interpretation.Acta Cardiol,1995,50(6):413-427.
[4]Noma A,Yanagihara K,Irisawa H.Inward current of the rabbit sinoatrial node cell.Pflugers Arch,1977,372(1):43-51.
[5]DiFrancesco D,Ferroni A,Mazzanti M,et al.Properties of the hyperpolarizing-activated current(if)in cells isolated from the rabbit sino-atrial node.JPhysiol,1986,377:61-88.
[6]Brown HF,DiFrancesco D,Noble SJ.How does adrenaline accelerate the heart?Nature,1979,280:235-236.
[7]Ludwig A,Zong X,Hofmann F,et al.Structure and function of cardiac pacemaker channels.Cell Physiol Biochem,1999,9:179-186.
[8]Ishii TM,Takano M,Xie LH,et al.Molecular characterization of the hyperpolarization-activated cation channel in rabbitheart sinoatrial node.JBio Chem,1999,274:12835-12839.
[9]Seifert R,Scholten A,Gauss R,et al.Molecular characterization of a slowly gating human hyperpolarization-activated channel predominantly expressed in thalamus,heart,and testis.Proc Natl Acad Sci USA,1999,96(16):9391-9396.
[10]Thomas DP,Marshall KI.Effects of repeated exhaustive exercise on myocardial subcellular membrane structures.Int JSportsMed,1988,9(4):257-260.
[11]Rose RA,Lomax AE,Kondo CS,et al.Effects of C-type natriuretic peptide on ionic currents in mouse sinoatrial node:a role for the NPR-C receptor.Am J Physiol,2004,286(5):H1970-H1977.
[12]Cho HS,Takano M,Noma A.The electrophysiological properties of spontaneously beating pacemaker cells isolated from mouse sinoatrial node.J Physiol,2003,550(1):169-180.
[13]Cohen IS,Robinson RB.Pacemaker current and automatic rhythms:toward a molecular understanding.Robert S,Basis and Treatment of Cardiac Arrhythmias,New York:Springer Verlag,2006:41-71.
[14]DiFrancesco D.Funny channels in the control of cardiac rhythm and mode of action of selective blockers.Pharmacol Res,2006,53(5):399-406.
[15]Ludwig A,Zong X,Stieber J,et al.Two pacemaker channels from human heart with profoundly different activation kinetics.EMBO J,1999,18(9):2323-2329.
[16]Stieber J,Hofmann F,Ludwig A.Pacemaker channels and sinus node arrhythmia.Trends Cardiovas Med,2004,14(1):23-28.
[17]Ludwig A,Budde T,Stieber J,et al.Absence epilepsy and sinus dysrhythmia in mice lacking the pacemaker channel HCN2.EMBO J,2003,22(2):216-224.
[18]Er F,Larbig R,Ludwig A,et al.Dominant-negative suppression of HCN channels markedly reduces the native pacemaker current If and undermines spontaneous beating of neonatal cardiomyocytes.Circulation,2003,107(3):485-489.
[19]Chandler NJ,Greener ID,Tellez JO,et al.Molecular architecture of the human sinus node:insights into the function of the cardiac pacemaker.Circulation,2009,119(12):1562-1575.
[20]Xiao YF,Chandler N,Dobrzynski H,et al.Hysteresis in human HCN4 channels:a crucial feature potentially affecting sinoatrial node pacemaking.Acta Physiologica Sinica,2010,62(1):1-13.
[21]Milanesi R,Baruscotti M,Gnecchi-Ruscone T,et al.Familial sinus bradycardia associated with amutation in the cardiac pacemaker channel.N Engl JMed,2006,354(2):151-157.
[22]Nof E,Luria D,Brass D,et al.Pointmutation in the HCN4 cardiac ion channel pore affecting synthesis,trafficking,and functional expression is associated with familial asymptomatic sinus bradycardia.Circulation,2007,116(5):463-470.
[23]Harzheim D,Pfeiffer KH,Fabritz L,et al.Cardiac pacemaker function of HCN4 channels in mice is confined to embryonic development and requires cyclic AMP.EMBO J,2008,27(4):692-703.
[24]Stieber J,Herrmann S,Feil S,etal.The hyperpolarizationactivated channel HCN4 is required for the generation of pacemaker action potentials in the embryonic heart.ProcNatl Acad Sci USA,2003,100(25):15235-15240.
[25]Herrmann S,Stieber J,Stockl G,et al.HCN4 provides a‘depolarization reserve’and is not required for heart rate acceleration inmice.EMBO J,2007,26(21):4423-4432.
[26]Gao Z,Chen B,Joiner ML,et al.Ifand SR Ca2+release both contribute to pacemaker activity in canine sinoatrial node cells.JMol Cell Cardiol,2010,49(1):33-40.
[27]Bogdanov KY,Maltsev VA,Vinogradova TM,et al.Membrane potential fluctuations resulting from submembrane Ca2+releases in rabbit sinoatrial nodal cells impart an exponential phase to the late diastolic depolarization that controls their chronotropic state.Circ Res,2006,99(9):979-987.
[28]Bucchi A,Baruscotti M,Robinson RB,et al.Modulation of rate by autonomic agonists in SAN cells involves changes in diastolic depolarization and the pacemaker current.J Mol Cell Cardiol,2007,43(1):39-48.
[29]朱永泽,吴庚华,王鑫,等.力竭游泳运动对大鼠心脏窦房结细胞超微结构的影响.中国运动医学杂志,2007,26(1):86-89.
[30]Moffat MP.Concentration-dependent effects of prostacyclin on the response of the isolated guinea pig heart to ischemia and reperfusion:possible involvement of the slow inward current.J Pharmacol Exp Ther,1987,242(1):292-299.
[31]Gryshchenko O,Qu J,Nathan RD.Ischemia alters the electrical activity of pacemaker cells isolated from the rabbit sinoatrial node.Am J Physiol,2002,282(6):H2284-H2295.
[32]Opthof T,Coronel R,Rademaker HM,et al.Changes in sinus node function in a rabbitmodel of heart failure with ventricular arrhythmias and sudden death.Circulation,2000,101(25):2975-2980.
[33]Zicha S,Fernandez-Velasco M,Lonardo G,et al.Sinus node dysfunction and hyperpolarization-activated(HCN)channel subunit remodeling in a canine heart failure model.Circ Res,2005,66(3):472-481.
Effects of Exhaustive Exercise on the Hyperpolarization-activated Cyclic Nucleotide-gated Channels in Sinoatrial Node of Rat
Bo Bing1,2,Chang Yun2
1 Shanghaiuniversity of Sport,Shanghai,China 200438
2 China Institute of Sport Science,Beijing,China 100061
Chang Yun,Email:changyun2518@vip.sina.com
ObjectiveThis paper discusses the subunitmRNA and current density of hyperpolarization-activated cyclic nucleotide-gated channels(HCN channel)in sinoatrial node(SAN)at different time phrases after exhaustive exercise.Methods180 healthy adultmale SD rats were equally assigned into following 9 groups:1 control groups(C),4 single bout of exhaustive swimming groups(O),and 4 2-week repeated exhaustive swimming groups(R).2-hour exhaustive swimming with 3%of body weight on their tails was carried out for groups R,6 days per week for a total of 2 weeks.After 2-week normal feeding,The same exhaustive swimming as for groups R was carried out for the groups O.The sampleswere drawn immediately,and at 4,12,and 24 hours after exhaustive swimming.ThemRNA expression of HCN channel subunits in SAN in groups R were analyzed by real-time fluorescent quantitative PCR,and the current density of HCN channel by SAN cells isolation and whole-cell patch clamp.Results(1)The HCN1 and HCN4 mRNA expressions in group O immediate(P<0.05,P<0.01),especially 4 hours after swimming(P<0.01,P<0.05)were significantly higher than that in group C,and HCN2 and HCN4 mRNA expressions in groups R immediate and 4 hours after swimming were significantly lower than that in group C(P<0.01,P<0.01).The HCN2 and HCN4 mRNA expressions in group R 4,12,and 24 hours after exhaustive swimming decreased significantly(P<0.01).(2)The current density of HCN channel in group R 4,12,and 24 hours after exhaustive swimming were significantly lower than that in group C and in group O 4,12,and 24 hours after exhaustive swimming(P<0.01).ConclusionExhaustive exercise downregulated the SAN HCN2 and HCN4 mRNA expressions,along with the corresponding current If,and induced remolding of HCN channel,which could be one of the most important factors of exercise-induced sinoatrial node dysfunction.
exhaustive swimming,sinoatrial node,hyperpolarization-activated cyclic nucleotidegated,channels
2012.07.10
国家体育总局体育科学研究所基本科研业务经费(10-01)
常芸,Email:changyun2518@vip.sina.com,Tel:010-87182526

