金银花多倍体诱变及早期形态鉴定
王惠利,赵晓明
(1.运城农业职业技术学院,山西运城044000;2.山西农业大学农学院,山西太谷030801)
金银花别名二花、忍冬花,为忍冬科攀缘灌木植物[1]。其具有清热解毒、凉风散热功效[2]。金银花为大宗名贵中药材,主产于我国[3-6],但目前以农家品种为多,人工培育的优良品种较少,且产量较低,生产不规范,质量差异较大,难以符合国际市场要求。而多倍体植株由于染色体的加倍,植株的细胞和器官表现出“巨型性”的显著特征[7],能增大植株的营养器官。药用金银花染色体加倍后,花巨型化,能较好地满足生产要求。
本试验采用改良L.D.Cua法对金银花进行多倍体诱变育种研究,以期获得多倍体金银花新品种,增加中草药的种质资源。
1 材料和方法
1.1 试验材料
供试材料为忍冬科(Carprifoliaceae)忍冬属(Lonicera L.)二倍体金银花(Lonicera japonica Thunb)。
1.2 试验方法
1.2.1 二倍体金银花多倍体的诱变
1.2.1.1 二倍体金银花的播种 采用温汤浸种法将二倍体金银花种子浸种24 h后播于营养钵中(每个营养钵播10粒左右),覆2 cm厚的土。播种后每隔一段时间浇一次水,以保持营养钵充分湿润,利于金银花种子的正常萌发。
1.2.1.2 秋水仙素溶液的配制 (1)0.4%秋水仙碱母液的配制。将1 g秋水仙碱倒入棕色小口瓶中,先用少量95%的分析纯酒精溶解,再加去离子水定容到250mL,然后放入冰箱4℃保存待用。(2)0.2%秋水仙碱溶胶+1%琼脂溶胶的配制。称取0.2 g琼脂,加去离子水10 mL,倒入60 mL烧杯中,标记刻度,加热到琼脂全部溶解为止,然后定容至刻度。待烧杯冷却后加10 mL已配好的0.4%秋水仙碱母液,混匀,水密保存待用。(3)将0.2%秋水仙碱与1%琼脂凝胶水浴加热到37℃充分搅拌后即可用于诱变。
1.2.1.3 改良L.D.Cua法处理金银花幼苗 营养钵中金银花出土后,待其子叶展开、顶端分生组织刚刚开始萌动时,每天早晨用牙签取少量0.2%秋水仙碱溶胶+1%琼脂溶胶滴于芽上,并充分包裹芽和子叶柄基部,分别处理24,48,72 h,诱变后盖上透明塑料杯,处理结束后去营养钵,待秋水仙碱凝胶充分干燥时用尖镊子撕去凝胶,停止诱变,以此来精确控制诱变时间。
1.2.2 M1变异植株的早期形态鉴定 在诱变处理后开始定期观察、记录幼苗生长发育状况,并测量叶长、叶宽、株高、叶形等,观察变异情况,并统计变异率。
1.2.2.1 M1变异株和对照株叶片形态的比较和测定 分别随机选取M1变异株和对照株植株上相同部位的20片叶片作为样本。每片叶选择不同部位做切片5张,在显微镜下观察,用显微测微尺测量切口横截面,得叶片的厚度,用直尺测量叶片的叶长和叶宽。用打孔测定法测定叶片面积。用叶片打孔器(1.5~2.0 cm)取下一定面积(A1)的叶片,将它与剩余部分的叶片分别烘干,求出打孔取样的干叶质量(W1)和其余部分的干叶质量(W2),即可求出该叶片的面积(A)[8]。
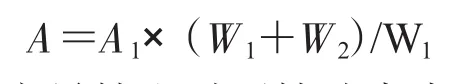
1.2.2.2 M1变异株和对照株叶表皮显微特征观察与测定 在M1变异株和对照株植株中各随机选择10株,取每株相同部位的叶片为样本,用尖嘴镊子轻轻撕取叶片下表皮,置于洁净的载玻片上,滴加一小滴1%的I-KI染液,静置10 min后,在显微镜下观察并用测微尺测量,测量时每个处理和对照随机选取10个气孔测量其长与宽;测得视野圆面积的直径后计算出气孔密度(气孔数 /cm2)。
1.2.2.3 M1变异株和对照株叶片叶绿素含量及保卫细胞中叶绿体数的测定 用SPAD-502叶绿素仪测量对照株和变异株相同部位(第4片真叶)的相对叶绿素含量。保卫细胞中叶绿体数直接在显微镜下计数。
1.2.3 数据处理 数据采用SARS软件进行统计,采用新复极差法进行差异显著性分析[9]。
2 结果与分析
2.1 幼苗早期形态鉴定结果
按照公认的多倍体形态与二倍体形态的差异,多倍体的判断标准为:(1)生长受阻;(2)叶色浓绿;(3)叶片皱缩;(4)植株畸形。可以此作为变异植株筛选的初步标准。
依据幼苗早期多倍体形态鉴定标准,用0.2%的秋水仙碱处理金银花的幼苗顶芽时,处理时间为72 h的诱变效果最佳。处理24 h,诱变率达32.5%;处理48 h,诱变率达51.3%;处理72 h,诱变率达72.5%,且死亡率较低,诱变效果较好(表 1)。

表1 秋水仙素对金银花幼苗的诱变效果
2.2 M1变异株和对照株形态学的比较
2.2.1 M1变异株和对照株叶片形态及叶形指数的比较 叶片皱缩、叶色浓绿、叶片大而厚且绒毛增多是M1变异株的一个显著表现。用手触摸可明显感觉M1变异株的叶片较对照株的叶片增厚、柔软。
从表2可以看出,M1变异株与对照株相比,叶色浓绿、叶片绒毛及叶柄绒毛变长。M1变异株比对照株叶片宽,且明显增大,对照株叶片为长卵圆形,而M1变异株叶片为卵圆形,而且厚度增加。

表2 M1变异株与对照株叶部形态比较
从表3可以看出,M1变异株叶片的长宽都有所增加,厚度增加近1倍,叶面积增加,叶形指数变小。对变异株和对照株的叶面积进行显著性测定,得到其在0.01水平上差异极显著。M1变异株的叶部形态性状有利于形成较大的光合作用面积,从而增加光合产物与干物质的积累,这是多倍体金银花高产的形态生理基础。

表3 M1变异株与对照株叶片大小比较及差异显著性分析
2.2.2 M1变异株和对照株叶表皮特征比较 对M1变异株和对照株的叶表皮各项特征进行测验,结果表明,M1变异株较对照株的气孔增大,密度减小。采用新复极差法[9],对变异株与对照株的气孔直径的变化进行显著性测定,得到其在0.01水平上差异极显著(表4)。

表4 M1变异株与对照株气孔的比较
2.2.3 M1变异株和对照株叶片叶绿素含量及保卫细胞中叶绿体数的比较 对M1变异株和对照株叶片的叶绿素含量和保卫细胞中的叶绿体数进行测定,结果表明,M1变异株较对照株的叶片叶绿素含量增加,保卫细胞中的叶绿体数也增多。显著性测定表明,变异株与对照株的叶绿素含量在0.01水平上差异极显著(表5)。

表5 M1变异株与对照株叶绿素及叶绿体数的比较
3 讨论与结论
3.1 秋水仙素处理的最佳时期
因为秋水仙素只作用于分裂中期细胞,因此,处理的苗期越小,则多倍体细胞与二倍体细胞比值就越大,诱变的成功率就越高。改良L.D.Cua法对金银花进行多倍体诱变选择在苗期,即子叶刚刚长出来的时期为最佳。
3.2 M1诱变成功植株早期形态特征的判定标准
3.2.1 生长受阻 由于秋水仙碱是一个重要的细胞毒物,会严重阻碍细胞正常的生理代谢。细胞为了消除这种毒害,不得不消耗大量的能量。因此,无论该细胞是否会加倍成多倍体,只要吸收了秋水仙碱就会发生生长受阻现象。但是,多倍体细胞由于核染色体加倍,其90%以上的DNA加倍,这种DNA的合成和染色体的增加是非常消耗能量的。因此,多倍体细胞的分裂速率显著慢于二倍体细胞[10-11]。
3.2.2 叶色浓绿 金银花加倍以后多倍体的叶绿体要比二倍体细胞增加1倍左右[12]。虽然叶绿体有自己独立的DNA遗传系统,但它的遗传受到核基因的控制,所以当核染色体加倍后,由于染色体增加产生的基因剂量效应,会使叶绿体的数目增加。这样就会造成多倍体较二倍体的叶色浓绿。
3.2.3 叶片皱缩 因为在一个相对短的诱变时间内,只有部分中期细胞会转化为多倍体,其他细胞还是二倍体,这样造成二倍体细胞和多倍体细胞的嵌合;又由于多倍体细胞与二倍体细胞生长速率与细胞体积不同,因此,2种细胞的后代细胞体积是不一样的,就造成了叶片的皱缩。
3.2.4 植株畸形 在化学诱变中,由于秋水仙碱破坏了纺锤体的形成,造成了纺锤体的动物极和植物极的紊乱[13]。因此,在它的后代中会出现单极、三极和四极畸形现象。因此,我们在形态学上经常看到多倍体植株当代发生叶片的扭曲、残缺、顶端优势丧失和改变;有性繁殖器官(花包括花萼、花瓣、子房和花药)发生畸形,出现花粉的败育、不受精现象、多花粉受精现象。在后代中,胚发育不正常;胚乳不发育;单子叶现象,三子叶现象,四子叶现象等等。
本试验结果显示,诱变后的多倍体金银花植株在早期形态上与二倍体植株有明显差异,所以,根据以上的判断依据可以比较迅速而准确地辨别出多倍体。
[1]王琳,王宁夏.金银花标准化种植技术[J].内蒙古农业科技,2011(6):117-119.
[2]黄宣模,郭晓云,王祥福.金银花种收质量的控制[J].内蒙古农业科技,2011(6):129-130.
[3]王惠清.中药材产销[M].成都:四川科学技术出版社,2004:484-490.
[4]安德鲁·薛瓦利埃.药用植物百科全书[M].南宁:广西科学技术出版社,2003:4.
[5]黄霞,樊骏,樊军龙,等.金银花的经济价值与栽培技术[J].陕西林业科技,2004(4):103-105.
[6]沈瑞.建造金银花密植园六要点[J].天津农业科学,2006,12(4):12.
[7]张兴翠.花叶绿萝的多倍体诱导及快速繁殖[J].西南农业大学学报,2004,26(1):58-60.
[8]乔富廉.植物生理学试验分析测定技术[M].北京:中国农业科学技术出版社,2002.
[9]盖均镒.试验统计方法 [M].北京:中国农业出版社,2006:105-106.
[10]李政,黄静洁,李凌.秋水仙碱诱变绿玉树多倍体研究[J].西南大学学报,2007,29(2):107-109.
[11]夏英武.作物诱变育种[M].北京:中国农业出版社,1997:92-93.
[12]戴思兰.园林植物遗传学 [M].北京:中国农业出版社,2005:100.
[13]王鸿鹤.秋水仙碱诱导重瓣大烟筒多倍体研究 [J].热带亚热带植物学报,1999,7(3):237-242.

