多不饱和脂肪酸的研究进展
孙翔宇,高贵田,段爱莉,顾浩峰,李 冰,薛 骞
(陕西师范大学食品工程与营养科学学院,陕西西安710062)
多不饱和脂肪酸的研究进展
孙翔宇,高贵田*,段爱莉,顾浩峰,李 冰,薛 骞
(陕西师范大学食品工程与营养科学学院,陕西西安710062)
多不饱和脂肪酸(PUFAs)作为一种独特的生物活性物质,对人体有重要的生理功能,ω-3和ω-6多不饱和脂肪酸都是合成类二十烷酸化合物的前体,它们在体内的平衡对于稳定细胞膜功能、调控基因表达、维持细胞因子和脂蛋白平衡、抗心血管病、促进生长发育等方面起着重要作用,是目前营养生化研究热点之一。随着PUFAs开发应用领域的扩大,纯PUFAs脂质的需求量越来越多,近年来人们一直在探索利用PUFAs的新来源——即利用微生物技术来生产PUFAs。介绍了PUFAs的生理作用和来源的研究进展,着重阐述了ω-3和ω-6多不饱和脂肪酸体内代谢、生理功能、ω-3和ω-6多不饱和脂肪酸比例、生物发酵等方面的研究情况。
多不饱和脂肪酸,生物活性,体内平衡,生物发酵,营养
1 多不饱和脂肪酸研究概况
PUFAs对人体生理作用的研究源于1929年LA被确认为EFA[3],其后必需脂肪酸缺乏症的研究沉寂了多年。五六十年代,Hansen[4]和Adam[5]等证明人体需要膳食脂肪。七十到八十年代,随着前列腺素、白细胞三烯、血栓烷素等一系列PUFAs代谢产物的研究取得极大的进展,PUFAs得到了更为深入的研究,其作用和功能也日益受到人们的重视。80年代中期Bang和Dyerberg提出爱斯基摩人较低的心血管病死亡率可能与他们食用含高浓度的PUFAs的海生食物有关[6],随后的研究发现鱼油中的ω-3 PUFAs具有抗炎、抗血栓形成和增加出血时间,预防和减少动脉粥样硬化形成等生理生化作用,补充ω-3 PUFAs可取代细胞膜中的部分ω-6 PUFAs。尤其是九十年代以后,发现AA、EPA和DHA等长链PUFAs在脑发育、婴幼儿智力及视力发育等方面的重要作用,PUFAs开始成为以功能性食品为首的许多领域的热点。目前,PUFAs在食品、医药、精细化工、饲料等许多行业和领域都得到了广泛的应用,发展极为迅速,已受到越来越多行业人士的关注。由于哺乳动物不能在离甲基端7个碳原子之内形成双键,所以,动物体内所有的代谢转化不能改变ω-3和ω-6 PUFAs双键的甲基末端的分子数。因此,一旦被消化,ω-3和ω-6 PUFAs之间是不能相互转化的,但它们由于可在体内竞争相同的酶系而能相互影响。PUFAs在机体内具有稳定细胞膜功能、调控基因表达、维持细胞因子和脂蛋白平衡、减肥、抗心血管病、促进生长发育、抗炎、抗癌、增加动物的产仔率和成活率等生理功能。而且双键愈多,不饱和程度愈高,营养价值也愈高。
目前,LA、GLA和ALA主要通过筛选过的植物种子来提取,而AA、EPA和DHA从海洋鱼油中提取,一些哺乳动物也能提取AA。但是PUFAs的植物来源受气候和地域的限制,并且植物资源受农药污染的威胁。而鱼油有特殊气味,在提炼过程中易氧化,工艺复杂,尚不能满足市场需求。并且,由于各国老年人口比例的逐渐增加,心脑血管疾病的肆虐,以及人们日益重视健康的态度,作为药品和保健食品材料的PUFAs的需求量会愈来愈多。因此,除LA以外,目前的PUFAs资源远远不能满足市场需求。为此近年来人们积极寻求替代的生物资源,如油料作物的遗传改性及低等动植物的综合利用,尤其寻找微生物中的高产油脂菌来生产PUFAs。
2 ω-3和ω-6多不饱和脂肪酸体内代谢
PUFAs在生物体内的代谢是一个复杂的过程,见图1;在不同生物中,代谢途径不同,见图2。环氧合酶(cyclooxygenase,OX)能够促进AA和EPA转化为前列腺素(prostag landin,PG)、血栓素(thromboxane A,TXA)和前列环素(prostacyclin,PGI)。脂氧合酶(1ipoxy genase)则促进AA和EPA转化为白三烯(LT)等产物。由图1可见,ω-6系和ω-3系两大系列PUFAs在体内有各自的代谢途径,但在相同的代谢步骤中所需的酶为同一酶系,存在着竞争性抑制作用:ω-3和ω-6 PUFAs共用相同的去饱和酶(Acyl-CoA desaturase)、链延长酶和乙酰转移酶,生成类二十烷酸系列脂肪酸均需环氧合酶和脂氧合酶,两者之间存在代谢竞争抑制,且各种酶对ω-3 PUFAs的亲合力更高。ω-3和ω-6 PUFAs相互影响合成类廿碳烷酸化合物的速度,以维持其体内平衡。当人体摄入ω-3 PUFAs多时,其通过与ω-6 PUFAs竞争Δ-6去饱和酶来抑制AA的生成以减少ω-6 PUFAs的总量。当ω-3 PUFAs的摄入量相对不足时,由ω-6 PUFAs衍生的类二十烷酸增多,2系前列腺素(PGI2)生成增多会出现炎性反应,而血栓素TAX2生成增多易出现血栓。ω-3 PUFAs缓解心脑血管疾病的作用机制也就在于其参与脂肪代谢,调节ω-6系类二十烷酸的生成量。
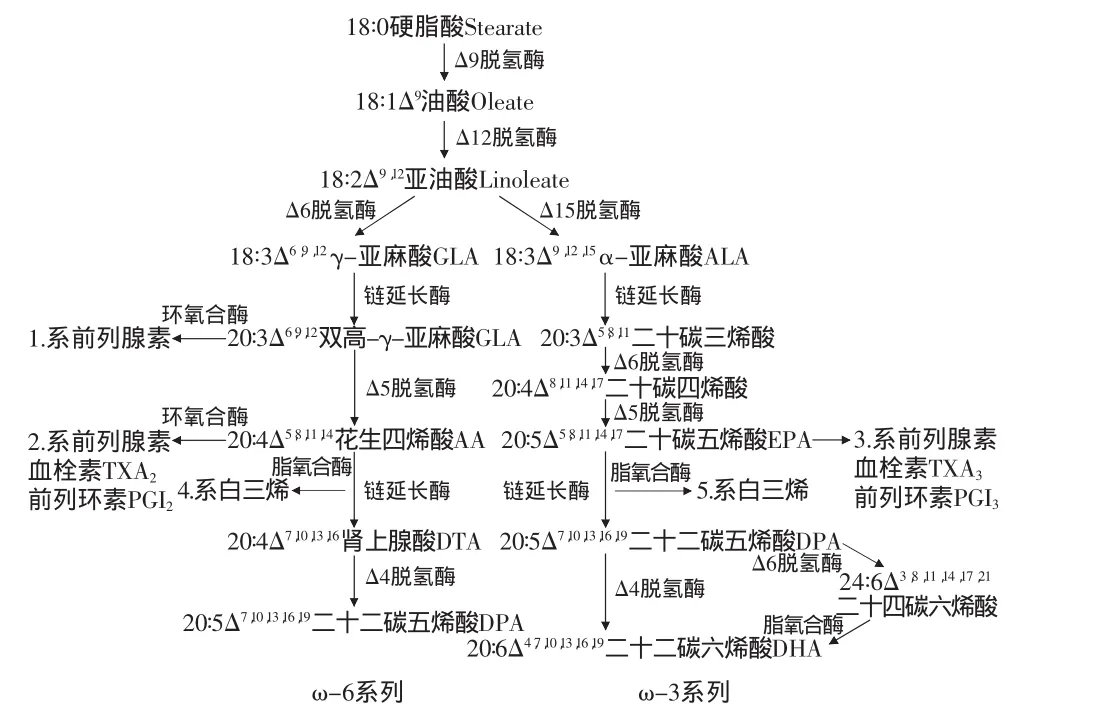
图1 ω-6和ω-3 PUFAs在生物体中的合成转化Fig.1 The synthesis transformation in the living things of ω-6 and ω-3 PUFAs

图2 脂肪酸在不同生物体中合成转化的区别Fig.2 Difference of fatty acids transformation in different organisms
3 生理功能
膳食中的PUFAs对维持身体健康和防治一些慢性疾病有多种生理作用,与维生素、矿物质一样,是人体的必需品,不足、过量或比例失调可能会导致心脏和大脑等重要器官障碍。
3.1 PUFAs与肥胖
肥胖已成为威胁人类健康的全球性问题,其发病率在我国逐年上升。近年来研究显示,肥胖的发生不仅取决于膳食脂肪量,也取决于脂肪酸种类和构成,特别是PUFAs的种类和构成,膳食脂肪酸的构成变化即ω-6 PUFAs摄入增加,而ω-3 PUFAs摄入减少从而使ω-6/ω-3 PUFAs的比值升高可能是重要原因[7]。同时生命早期机体脂肪酸水平及构成状况也可能一定程度上决定了后期(儿童、成年期)肥胖发生的易感性[8]。
3.1.1 肥胖状态下的脂肪酸代谢紊乱 研究表明,肥胖状态下存在脂肪酸代谢紊乱,各文献报道之间的分歧也体现了这一点:Decsi等[9]发现匈牙利肥胖儿童血浆AA水平升高,这可能是由于Δ-6去饱和酶活性增加所致;但Scaglioni等[10]对意大利学龄期儿童的研究发现,肥胖儿童血浆总PUFAs及ω-6脂肪酸水平降低,而单不饱和脂肪酸及ω-3 PUFAs(LNA、EPA)水平升高。对北京学龄前肥胖儿童血浆脂肪酸的研究显示,学龄前肥胖儿童血浆各脂肪酸含量单不饱和及ω-3 PUFAs水平升高,ω-6 PUFAs水平降低,16∶1ω-7/16∶0和18∶1ω-9/18∶0比值的升高,提示Δ-9去饱和酶活性增加[11]。Warensjo等[12]在瑞典对成人的研究也显示,随着Δ-9去饱和酶活性的增加,超重的危险性明显上升。
肥胖状态下脂肪酸代谢紊乱可能是对肥胖的适应性反应。大量研究表明,ω-3和ω-6 PUFAs存在相互拮抗作用。比如,AA代谢生成的4系LT、2系前列腺素和血栓素具有很强的致炎作用,而EPA的代谢产物5系LT、3系前列腺素和血栓素的致炎作用很弱,在一定程度上EPA起到了对AA的拮抗作用。另外,生命早期ω-3 PUFAs状况与长大后肥胖的发生相关;膳食ω-6 PUFAs比例提高可使机体脂肪聚集、促进肥胖发生,而ω-3 PUFAs比例提高具有抑制脂肪聚集的作用[7]。肥胖时脂肪组织会合成释放出大量的肿瘤坏死因子、白介素、C-反应蛋白等炎性介质,参与生理病理过程,在一定程度上会促使ω-3系PUFAs反应性升高,以拮抗这些致炎因子的炎性作用。
3.1.2 多不饱和脂肪酸与细胞因子 肥胖的发生和发展与多种细胞因子有关。增食因子A又称为下丘脑分泌素1(hypocretin-1),由下丘脑分泌素细胞分泌。下丘脑分泌细胞的分泌作用可被瘦素(leptin)和高血糖状态抑制,而被饥饿素(ghrelin)和低血糖状态激活,据此发现增食因子A有增强食欲、增加进食量和加速分解代谢的作用[13]。近年来特别是肥胖基因(ob)被克隆后,人们对肥胖发生的机制研究更深入,特别是ob基因及其表达产物瘦素(leptin)的研究。瘦素最主要的功能就是调节能量代谢,瘦素的表达与分泌受饮食、激素、疾病等多种因素的影响。血浆瘦素水平升高、瘦素抵抗是肥胖的主要病理特征之一,但机制尚不清楚。大量研究表明,除极个别由于瘦素本身缺乏导致肥胖以外,绝大部分肥胖患者血浆瘦素水平升高,但过量表达的瘦素不能发挥生物学作用,存在瘦素抵抗现象。ω-3和ω-6 PUFAs可能与瘦素抵抗的发生相关,但尚不能确定这二类脂肪酸对瘦素表达的直接调节作用。Chen X等人观察了脂肪含量和脂肪种类变化对幼猪脂肪组织中瘦素及其受体表达的影响,发现ω-3 PUFAs可以通过非胰岛素依赖途径对瘦素及其受体表达进行调控,并且调控可能在转录后水平上[14]。还有报道称ω-3 PUFAs可以促进下丘脑部位的紧密连接蛋白表达来阻滞瘦素转运,从而诱导瘦素抵抗的发生[15],表明ω-3 PUFAs可能在一定程度上参与了瘦素抵抗的发生。因此,ω-3 PUFAs与瘦素和肥胖之间的关系尚待进一步探讨。
3.2 PUFAs与心脑血管疾病

表1 从EPA和AA生成的PGI和TXA对血小板凝集能的影响Table 1 Effect of PGI and TXA from EPA and AA on platelet coagulation
膳食脂肪酸与血脂代谢、冠心病(coronary heart disease,CHD)及动脉粥样硬化(atherosclerosis,AS)的发生相关。血小板膜磷脂释放的PUFAs经环氧合酶作用可合成血栓素-凝血恶烷A(thromboxane A,TXA),TXA具有促进血小板凝集和收缩血管的作用,而血管壁膜磷脂释放的PUFAs经酶促作用可合成前列环素I(prostacyclin I,PGI),PGI具有抑制血小板凝集和舒张血管的作用,二者共同调节血小板和血管功能及血栓的形成。ω-6 PUFAs导致血小板凝集和血栓形成,而ω-3 PUFAs具有相反的作用。AA从细胞膜磷脂中释放出来合成TXA2和PGI2,而EPA生成TXA3和PGI3。EPA与AA在同一水平上竞争环氧合酶,从而竞争性抑制AA向TXA2和PGI2转化。TXA3促血小板聚集作用远不如TXA2,而PGI3与PGI2抑制血小板聚集作用效果类似,其结果降低了血小板聚集性并增加了血管舒张作用,使血栓形成减少,如表1所示。ALA通过与LA竞争Δ-6脱氢酶、Δ-5脱氢酶和链延长酶抑制LA合成AA,EPA通过与AA竞争环氧合酶抑制AA合成TXA2,从而共同减少TXA2的生成,抑制血栓形成。来自AA的类二十碳烷小剂量就能满足功能需要,很容易过量。AA过多会形成凝血酶,导致动脉粥样化,机体过敏性和炎性紊乱。所以膳食中ω-6 PUFAs过量会使血液粘度、血管痉挛度和血管收缩度升高,增加膳食中ω-3 PUFAs比例能缓解这些症状。但ω-3 PUFAs过量也有加重出血的危险,EPA、DHA摄取过剩使TXA2形成受到过度抑制,造成出血时间延长,出血现象加重,甚至可能增加脑出血的危险,在外科手术或其他外伤时还可引起过量出血,有出血倾向的人不应过多摄入EPA和DHA。ω-3 PUFAs有抗心律失常的作用[16]。主要机制是其对钠通道和钙通道的抑制作用及稳定心肌细胞的电活动。而ω-6 PUFAs则没有相关功能的报道。
3.3 PUFAs与抗炎
炎症是对于创伤、微生物侵染等非特异性的反应,产生红肿,疼痛等现象。细胞培养、动物实验、临床实验都有证据表明:ω-3 PUFAs或鱼油的补充可以改善一些免疫性疾病,抑制炎症反应。其主要机制包括:ω-3 PUFAs(EPA、DHA)能够置换细胞膜磷脂中的AA,竞争环氧合酶和脂氧合酶从而减少AA产生的各类炎性介质,减轻炎症反应;ω-3 PUFAs也能通过改变细胞膜磷脂的脂肪酸构成来改变细胞膜流动性,膜上相关信号分子、酶、受体的功能,来改变信号传导过程。此外,通过影响酶或细胞因子的基因表达、抑制促炎症因子产生、调节黏附分子表达来调节免疫功能,这种机制可以不依赖类二十烷酸(eicosanoids)的产生。鱼油中富含的EPA和DHA抑制炎症和免疫的作用最为显著[17-19]。
3.4 PUFAs与细胞膜功能及机体免疫
PUFAs是细胞膜磷脂的重要成分,细胞膜磷脂成分是决定细胞膜功能的重要因素,在细胞表面信号传导中起重要作用。ω-3和ω-6 PUFAs虽然不能相互转化,但能互相抑制对方的合成或置换对方。PUFAs可以通过改变膜的流变性[15],影响膜表面酶和受体、免疫细胞膜表面的抗原、抗体数量和分布以及淋巴因子和抗体分泌等功能。PUFAs可以从营养代谢、免疫抑制和基因表达等方面调控细胞膜的功能。PUFAs缺乏或过量都会使细胞膜受到影响,包括膜组分的改变、抗氧化性的改变、膜通透性的改变。由于细胞膜是细胞损害的最敏感部位,故从细胞膜的损害方面来研究预防机体发病的机理是营养代谢病研究的一个热点。
在机体受到外界抗原刺激时,淋巴因子和抗体的分泌以及产生新免疫细胞等都依赖于脂肪的参与。细胞膜磷脂中脂肪酸组成的变化将对免疫功能产生影响。PUFAs对免疫器官生长有促进作用。过量的PUFAs抑制T细胞、脾脏细胞对有丝分裂原的反应,从而降低机体免疫力。ω-3 PUFAs抑制抗原递呈细胞发挥抗原递呈作用从而抑制细胞免疫。ω-6 PUFAs则使细胞介导免疫功能受抑制。ω-3 PUFAs具有改变补体和免疫细胞的功能,注入ω-6 PUFAs脂肪乳剂也能够抑制人的自然杀伤细胞(natural killer cell,NK cell)的功能。Merzouk等[20]通过离体和在体实验发现,EPA和DHA可以明显抑制T细胞分泌白细胞介素-2。El-Badry等[17]的大鼠研究结果显示:术前饲喂大鼠ω-3 PUFAs,可减轻供肝的缺血再灌注损伤,并可因此拓宽供肝的选择范围。
3.5 PUFAs与视力
近年来关于婴幼儿奶中添加长链多不饱和脂肪酸(long-chain polyunsat urated fatty acids,LCPUFAs)的临床实验和研究大多显示其可促进视力发育[21],但结果有争议,特别是一些最新报道。多项研究证明LCPUFAs尤其是DHA对光感受器有显著效应,能抑制细胞凋亡,保护光感受器免受氧化应激损伤[22-23]。总体来说,早产儿配方喂养添加DHA提高视敏度效果已得到公认,但足月儿的研究结果差异较大。LCPUFAs对视力发育的促进作用是暂时性或是永久性的也是关注的热点之一。
3.6 PUFAs与生长发育
ω-6 PUFAs促进生长发育,除AA能增加生长的早期反应基因c-fos和Egr-1的表达来诱导细胞生长外,还有AA衍生的PG2系列调节下丘脑功能。儿童缺乏LA会出现发育迟缓和湿疹皮炎等,成人缺乏LA会出现磷状皮屑、脱发和伤口难以愈合等症状。但是除严重营养不良的人群和吸收障碍的病人和早产儿外,人体尚未发现过亚油酸缺乏症的全部症侯群,相反摄入过量症状却普遍发生。
尽管ω-3 PUFAs的促生长作用很弱,但对脑和视网膜、皮肤和肾功能的健全十分重要。对于胎儿和婴幼儿而言,脑是身体尺寸和重量的主要部分,脑中两种主要的脂肪酸AA和DHA,对正常胎儿的形成和婴幼儿的发育至关重要。灵长类动物实验表明,如果母亲膳食缺乏ω-3脂肪酸,后代将智力发育不健全,视力受损。母乳喂养的婴儿到7~8岁时,智商高于非母乳喂养的儿童。这与人工乳中缺乏DHA有关。因为DHA能够促进智力的发育,并影响学习记忆[24-25]。然而长期过量食用DHA会引起精神过度兴奋,不易入睡。对于EPA,一些婴幼儿研究显示,EPA对婴幼儿的生长与智力发育有不利影响,EPA过高会竞争性抑制AA合成2系PG,并抑制亚油酸转化成AA,影响生长发育。
3.7 PUFAs与猝死
Abert等对两万多名男性健康医生长达17年的前瞻性对照分析表明,膳食中富含食用鱼油制品者,以猝死为首发事件的心血管病发病明显减少,其血脂中ω-3 PUFAs的基线水平与猝死的危险性呈负相关[26]。但是Hooper等通过48项随机对照研究和41项群组研究的资料,对ω-3 PUFAs的有效性进行系统评价,得出了ω-3 PUFAs对心血管病等无效的结论[27]。虽然仍有争议,但多数倾向预防有效的看法,并对ω-3 PUFAs抗猝死的机制进行了深入的研究。Siddiqui等[28]研究证实ω-3 PUFAs可以直接作用于Na+-Ca2+交换体,使[Ca2+]i降低而减少钙超载引发的心律失常。猝死诱因复杂,ω-3 PUFAs又有多方面作用,如调血脂、抗血栓、抗炎等,目前认为抗心律失常、阻滞心律失常恶化、保护心脏功能,是ω-3 PUFAs预防猝死的主要机制。随着研究的深入,ω-3 PUFAs可能会作为抗心律失常药物应用于临床。
3.8 其它
大量研究表明ω-3 PUFAs在儿童注意力缺陷多动症[29]和老年性痴呆[30-31]等疾病的发生中亦起着积极的作用,有研究表明对抑郁症也有积极作用[32],但最新研究研究指出DHA无助减少产后抑郁症[33]。然而这些研究在深度和广度上,特别是在ω-3 PUFAs影响这些疾病发生的机制上,仍然不够明确。
4 ω-3和ω-6 PUFAs膳食平衡
不同ω-6/ω-3 PUFAs比例对体内脂代谢和免疫功能以及类二十烷酸有影响,早在上世纪九十年代,国外学者就进行了初步的研究,但分子机制尚不清楚。2005年日本学者通过模拟世界四个地区人群不同ω-6/ω-3脂肪酸比率膳食,以apoE和LDLR双缺失小鼠作为AS模型,探讨了不同ω-6/ω-3 PUFAs比例对血栓的影响趋势[34]。膳食脂肪酸结构不当也是当前心血管疾病发病率越来越高的重要原因之一。由于ω-6/ω-3 PUFAs在机体内生理功能的不同甚至拮抗,在当今的饮食条件下,ω-3和ω-6 PUFAs在体内的平衡非常重要,绝对摄入量不足就不能满足功能需要,但也不是越多越好。PUFAs在体内沉积会引起维生素E水平下降。膳食中ω-6 PUFAs一般是过量的,而ω-3 PUFAs则严重不足,ω-6 PUFAs/ω-3 PUFAs比例的平衡成为最受关注的问题,然而至今对二者合理的比值学术界仍有争论,目前各国关于膳食脂肪酸构成比的推荐值不尽相同。爱斯基摩人摄取ω-6 PUFAs/ω-3 PUFAs的比例为0.4左右,虽然心肌梗死等疾病较少发生,但是出血时间延长,脑出血患者增加。1987年美国的膳食结构分析表明,欧美区域人群膳食中的ω-6 PUFAs/ω-3 PUFAs比值为10∶1~20∶1,欧美人心血管疾病的发病率很高。母乳、原始人或野生动物的食物中ω-6 PUFAs/ω-3 PUFAs的比值大约为3∶1~10∶1。一些国家及相关组织提出了人类膳食中ω-6 PUFAs/ω-3 PUFAs比例的推荐值,见表2。中国营养学会在2000年提出的人体内最佳的ω-6∶ω-3 PUFAs比值为4∶1~6∶1。

表2 部分国家或组织提出的ω-6 PUFAs/ω-3 PUFAs的推荐值Table 2 Recommended value of ω-6 PUFAs/ω-3 PUFAs of partial countries or groups
5 多不饱和脂肪酸来源
5.1 生物资源
PUFAs通常来源于高等植物种子、动物内脏和鱼油。植物油中都含有LA与ALA,只是不同种类油中两者相对比例和含量差别很大。大多数植物油富含LA,如玉米胚芽油、棉籽油、燕麦油、芝麻油、大豆油、红花籽油和葵花籽油等。部分植物油富含多不饱和脂肪酸,如大豆油、亚麻籽油和低芥酸菜籽油等,ALA含量较高。某些特殊油种,如月见草油、琉璃苣油和黑加仑籽油中GLA含量较高。动物性食物,尤其是蛋黄、内脏中富含AA、EPA。AA广泛分布于动物中性脂肪中,牛乳脂、猪脂肪、牛脂肪、血液磷脂、肝磷脂和脑磷脂中含量约为1%。鱼油中EPA、DHA的含量最高。如鲱鱼(menhaden)鱼油中EPA占总脂肪酸的16.03%,DHA占10.83%。不过PUFAs的植物来源受到气候、地域的限制,并且植物资源受农药污染的威胁。而鱼油有特殊气味,而且在提炼过程中易氧化,工艺复杂尚不能满足市场需求。为此,人们积极研究寻求替代的生物资源,如油料作物的遗传改性及低等动植物的综合利用,尤其从微生物菌群中寻找高产油脂菌等。
5.2 生物发酵
自20世纪80年代以来,随着人们对PUFAs生理功能的认识,微生物发酵法生产含PUFAs油脂引起了人们的极大兴趣,以美、日、英、加等国的研究最为活跃。PUFAs在微生物体内的合成是以饱和脂肪酸硬脂酸为底物,通过脱饱和酶的作用,在特定的碳原子处插入双键,然后再由碳链延长系统合成所需的PUFAs。与动植物油生产PUFAs相比,微生物法有很多优点,如生产周期短,集约化大规模生产,不受场地、气候、季节的影响,利用不同的菌种和培养基富含特定油脂的PUFAs等。微生物发酵生产PUFAs的基础研究主要集中在高产菌株的筛选、工程菌株的构建和发酵工艺的改进上。汤世华用丝状真菌深黄被孢霉突变株发酵生产多不饱和脂肪酸,发酵生物量为51.308g/L,含油率为39.547%,产油量为20.291g/L,其油脂脂肪酸组成中不饱和脂肪酸含量为85.71%,其中γ-亚麻酸6.68%[35]。Jang HD等用高山被孢霉M.alpina ATCC32222发酵生产PUFAs时认为,当硝酸钾和酵母膏以2∶1(w/w)混合使用时其PUFAs的产量最高[36]。
5.3 利用基因工程技术改造生物
近年来,在植物油基因工程、微生物发酵工程中脂肪酸脱饱和遗传操作取得了相当大的进展。2005年,Seiki Takeno在高山被孢霉IS-4(Mortierellaa lpina 1S-4)中转入Zeocin抗性基因,通过抗性筛选得到菌株pDZeoGLELO transformant#63,AA产量较原始菌株有很大提高[37]。2007年,Maali Amiri等将藻青菌(Cyanobacterium)的Δ12去饱和酶基因转入马铃薯中,发现马铃薯脂肪酸成分发生了明显变化[38]。2008年,Hao等人将卷枝毛霉的Δ6去饱和酶基因转入烟草中,成功获得了γ-亚麻酸的高产菌株[39]。此外,还有许多脂肪酸去饱和酶相关的基因被克隆并转化应用。
6 展望
综上所述,PUFAs有重要的生理作用和经济价值,ω-3和ω-6 PUFAs在体内的平衡是维持人体健康的重要因素,但是涉及到的许多生理功能作用机制研究尚不清楚。从目前的研究情况来看,对PUFAs的研究,主要集中在其生理生化和来源方面。尽管对PUFAs的生物性质和许多医学上、营养上的作用机理理解有限,但PUFAs在食品、健康辅料、化妆品和制药中的潜在市场是不言而喻的。相信随着对PUFAs研究的深入,一些新兴技术,如生物工程技术等使PUFAs得以工业化生产,用来治疗特殊疾病的由PUFAs衍生而来的高档类二十烷酸等将会在医疗产品市场占有一席之地。
[1]马立红,王晓梅.多不饱和脂肪酸药理作用研究[J].吉林中医药,2006,26(12):69-70.
[2]李殿鑫,陈银基,周光宏,等.n-3多不饱和脂肪酸分类,来源与疾病防治功能[J].中国食物与营养,2006(6):52-54.
[3]George O Burr,Mildred M Burr.A new deficiency disease produced by the rigid exclusion of fat from the diet[J].Bio Chem,1929,82(2):345-367.
[4]Hansen AE,Wiese HF,Boelsche AN,et al.Role of linoleic acid in infant nutrition[J].Pediatrics,1963,31(s1):171-192.
[5]Adam D J D,Hansen A E,Wiese H F.Essential fatty acids in infant nutrition[J].J Nutr,1958,66:555-564.
[6]H O Bang,J Dyerberg.Plasma lipid and lipoprotein pattern in greenlandic west-coast eskimos[J].Nutrition Reviews,1986,44(4):143-146.
[7]Ailhaud G,Massiera F,Weill P,et al.Temporal changes in dietary fats Role of n-6 polyunsaturated fatty acids in excessive adipose tissue development and relationship to obesity[J].Prog Lipid Res,2006,4(3):203-236.
[8]Ailhaud G,Massiera F,Alessandri JM,et al.Fatty acid composition as an early determinant of childhood obesity[J]. Genes Nutr,2007,2(1):39-40.
[9]Decsi T,Molnar D,Koletzko B.Long-chain polyunsaturated fatty acids in plasma lipids of obese children[J].Lipids,1996,31(3):305-311.
[10]Scaglioni S,Verduci E,Salvioni M,et al.Plasma long-chain fatty acids and the degree of obesity in Italian children[J].Acta Paediatrica,2006,95(8):964-969.
[11]郑东旖,樊超男,朱海燕,等.肥胖儿童血浆长链脂肪酸的变化[J].中国儿童保健杂志,2007,15(6):224-226.
[12]Warensjo E,Ohrvall M,Vessby B.Fatty acid composition and estimated desaturase activities are associated with obesity and lifestyle variables in men and women[J].Nutr Metab Cardiovasc Dism,2006,16(2):128-136.
[13]Willilams K W,Scott M M,Elmqyist J K.From observation to experimentation:leptin action in the mediobasal hypothalamus [J].Am J Clin Nutr,2009,89(S3):985-990.
[14]Chen X,Li D,Yin J,et al.Regulation of dietary energy level and oil source on leptin and its long formreceptor mRNA expression of the adi-pose tissues in growing pigs[J].Domest Anim Endocrinol,2006,31(3):269-283.
[15]Oh-I S,Shimizu H,Sato T,et al.Molecular mechanisms associated with leptin resistance:n-3 polyunsaturated fatty acids induce alterations in the tight junction of the brain[J].Cell Metabolism,2005,1(5):331-341.
[16]Den Ruijter HM,Berecki G,Verkerk AO,et al.Acute administration of fishoil inhibits triggered activity in isolated myocytes from rabbits and patients with heart failure[J]. Circulation,2008,117(4):536-544.
[17]El-Badry AM,Moritz W,Contaldo C,et al.Prevention of reperfusion injury and microcirculatory failure in macrosteatotic mouse liver by omega-3 fatty acids[J].Hepatology,2007,45(4):855-863.
[18]Kim YJ,Chung HY.Antioxidative and anti-inflammatory actions of docosahexaenoic acid and eicosapentaenoic acid in renal epithelial cells and macrophages[J].Journal of Medicinal Food,2007,10(2):225-231.
[19]Berger MM,Chioléro RL.Antioxidant supplementation in sepsis and systemic inflammatory response syndrome[J].Critical Care Medicine,2007,35(9):S584-S590.
[20]Merzouk SA,Saker M,Repuip KB,et al.N-3 polyunsaturated fatty acidsmodulate in-vitro Tcell function in TypeⅠdiabetic patients[J].Lipids,2008,43(6):485-497.
[21]Park EJ,Suh M,Clandinin MT.Dietary ganglioside and long-chain polyunsaturated fatty acids increase ganglioside GD3content and alter the phospholipid profile in neonatal rat retina [J].Invest Ophthal-mol Vis Sci,2005,46(7):2571-2575.
[22]Politi LE,German L,Rotstein NP,et al.Pigmented epithelial cells ARPE-19 and Docosahexaenoic Acid promote celldifferentiation and spatial organization of retina photoreceptors in vitro[J].Invest Ophthal-mol Vis Sci,2007,48(5):6028-6033.
[23]Knott EJ,Sheets KG,Bergsma DR,et al.NeuroprotectinD1 attenuates photoreceptor apoptosis in retinal explantsafter light damage in vivo[J].Invest Ophthal-mol Vis Sci,2008,49(5):2991-2995.
[24]Innis SM.Dietary omega-3 fatty acids and the developing brain[J].Brain Res,2008,1237:35-43.
[25]Tziomalos K,Athyros VG,Karagiannis A,et al.Omega-3 fatty acids:how can they be used in secondary prevention?[J]. Curr Atheroscler Rep,2008,10(6):510-517.
[26]Abert CM,Campos H,Stamper NJ,et al.Blood levels of long-chain n-3 fatty acids and the risk of sudden death[J]. Nengl J Med,2002,346:1113-1118.
[27]Hooper L,Thompson R L,Harrison R A,et al.Risks and benefits of omega-3 fats for mortality,cardiovascular disease,and cancer:systematic review[J].BMJ,2006,332(7544):752-760.
[28]Siddiquia R A,Harveya K A.Modulation of enzymatic activitiesby n-3 polyunsaturated fatty acidsto support cardiovascular health[J].J Nutr B iochem,2008,19(7):417-437.
[29]Antalis CJ,Stevens LJ,Campbell M,et al.Omega-3 fatty acid status in attention-deficit/hyperactivity disorder[J].Prostaqlandins Leukot Essent Fatty Acids,2006,75(4):299-308.
[30]Connor WE,Connor SL.The importance of fish and docosahexaenoic acid in Alzheimer disease[J].Am J Clin Nutr,2007,85(4):929-930.
[31]Lukiw WJ,Bazan NG.Docosahexaenoic acid and the aging brain[J].J Nutr,2008,138(12):2510-2514.
[32]Hibbeln JR.Depression,suicide and deficiencies of omega-3 essential fatty acids in modern diets[J].World Rev Nutr Diet,2009,99(1):17-30.
[33]Suzuki Takefumi,Assies Johanna,MockingRoel J,et al. Maternal depression and child development after prenatal DHA supplementation[J].Journal of the American Medical Association,2011,305(4):359-361.
[34]Yamashita T,Oda E,Sano T,et al.Varying the ratio of dietary n-6/n-3 polyunsaturated fatty acid alters the tendency to thrombosis and progress of atherosclerosis in apoE-/-LDLR-/-double knockout mouse[J].Thromb Res,2005,116(5):393-401.
[35]汤世华,陈明锴,杨建斌,等.深黄被孢霉高产多不饱和脂肪酸优化培养的研究[J].中国油脂,2008,33(5):37-39.
[36]Jang HD,Lin YY,Yang SS.Effect of culture media and conditions on polyunsaturated fatty acids production by Mortierella alpina[J].Bioresource Technology,2005,96(15):1633-1644.
[37]Takeno S,Sakuradani E,Tomi A,et al.Transformation of oil-producing fungus,Mortierella alpina 1S-4,using Zeocin,and application to arachidonic acid production[J].J Bio Bio,2005,100(6):617-622.
[38]Maali-AmiriR,Gddenkova-Pavlva IV,Yur’eva NO,et al.Lipid fatty acid composition of potato plants transformed with the Δ12-desaturase gene from cyanobacterium[J].Russian J of Plant Physiology,2007,54(5):600-606.
[39]Hao L,Mei XH,Zhao F,et al.Expression of Mucor circinelloides gene for Δ6 desaturase results in the accumulation of high levels of γ-linolenic acid in transgenic tobacco[J]. Russian J of Plant Physiology,2008,55(1):77-81.
Research progress in polyunsaturated fatty acids
SUN Xiang-yu,GAO Gui-tian*,DUAN Ai-li,GU Hao-feng,LI Bing,XUE Qian
(College of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi’an 710062,China)
Polyunsaturated fatty acids(PUFAs)is a unique bioactive substances,it has important physiological function to human body.ω-3 and ω-6 polyunsaturated fatty acids are precursor of eicosanoids synthesis. Their homeostasis plays an important role in stable membrane function,regulation of gene expression,maintaining cell factors and lipoprotein balance,fighting cardiovascular diseases,and promotion of growth.And now it is one of the hotspots of nutrition biochemical.As the expansion of PUFAs application fields,more and more pure PUFAs lipids are needed.In recent years,people have been exploring new sources of PUFAs,namely using microorganism techniques to produce PUFAs.The research progress of PUFAs physiological functions and sources,and emphatically expounds ω-3 and ω-6 polyunsaturated fatty acid metabolism,physiological functions,the scale of ω-3 and ω-6 polyunsaturated fatty acids,fermentation,etc were introduced.
polyunsaturated fatty acids;biological activity;homeostasis;biology fermentation;nutrition
Q547
A
1002-0306(2012)07-0418-06
多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)是指含有两个或更多个不饱和双键结构的脂肪酸,又称多烯脂肪酸。根据第一个不饱和键位置不同,PUFAs可分为ω-3、ω-6、ω-7、ω-9等系列(即ω编号系统,也叫n编号系统)[1]。距羧基最远端的双键在倒数第3个碳原子上的称为ω-3系列PUFAs,主要有:α-亚麻酸(ALA)、二十碳五烯酸(EPA)、二十二碳五烯酸(DPA)和二十二碳六烯酸(DHA)等;在第6个碳原子上的称为ω-6系列PUFAs,主要有:亚油酸(LA)、二高-γ-亚麻酸(DHGLA)、γ-亚麻酸(GLA)和花生四烯酸(AA)等[2];此外还有ω-7系列、ω-9系列:二十碳三烯酸(Mead acid)等。ω-3和ω-6系列PUFAs具有重要生物学意义并与人类健康密切相关,很多情况下,这两族PUFAs在功能上相互协调制约,共同调节生物体的生命活动。AA、ALA、EPA和DHA人体内不能合成,需要从食物中摄取,称为人类的必需脂肪酸(EFA)。本文主要介绍ω-3和ω-6多不饱和脂肪酸体内代谢、生理功能、ω-3和ω-6多不饱和脂肪酸比例、来源及生物发酵等方面的研究情况。
2011-05-25 *通讯联系人
孙翔宇(1988-),男,硕士研究生,主要从事食品生物技术研究。
陕西省“13115”科技创新工程重大科技专项(2009ZDKG-05);教育部大学生创新实验计划资助项目(091071801);大学生创新性实验(CX11097)。

