硫酸熟化−焙烧法从镍红土矿中回收镍和钴动力学研究
郭学益,李栋,田庆华,石文堂
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
镍红土矿是一种含镍的氧化矿,其镍储量约占全球陆地镍资源储量的 60%[1],主要分布在新喀里多尼亚、澳大利亚、菲律宾、印度尼西亚以及中、南美洲等国家和地区。2003年全球镍产量约有40%来源于红土矿,近年来,随着镍红土矿项目开发步伐的加快,预计到2012年该比例将达到50%以上[2]。目前世界上镍红土矿的处理工艺主要分为火法工艺和湿法工艺。火法工艺包括还原焙烧生产镍铁[3]和还原硫化熔炼生产镍锍[4],适合处理高镁低铁型的腐殖土层红土矿;湿法工艺包括还原焙烧−氨浸法[5]、高压酸浸法[6]、常压酸浸法[7]和硫酸化−焙烧−水浸法[8−9]。还原焙烧−氨浸法最早用于工业化处理红土矿,具有工艺成熟、镍回收率高等优点,缺点是流程复杂、钴回收率低;高压酸浸法镍、钴回收率高,但操作条件苛刻且维护费用高;常压酸浸法工艺流程短、操作简单,但酸耗量大,铁浸出率高,影响后续浸出液处理。硫酸化−焙烧−水浸法的原理是利用浓硫酸与矿中镍和钴的氧化物反应生成相应的硫酸盐,并水浸分离,达到提取镍和钴的目的。该方法具有工艺简单、酸耗少、镍钴回收率高、铁浸出率低等优点。本文作者在硫酸熟化−焙烧−水浸法处理镍红土矿的基础上,对镍和钴的硫酸化动力学进行了研究,为硫酸化−焙烧−水浸法的工业化应用提供了理论指导。
1 实验
1.1 原料及表征
镍红土矿取自菲律宾棉兰老岛图拜矿区,经球磨过孔径为180 μm筛和110 ℃干燥后,用于本实验研究。采用 PW−l660型 X 线荧光分析仪(XRF,荷兰PHILIPS)测定镍红土矿的化学成分;采用D/Max−2550型 X线衍射仪(XRD,日本 JEOL)分析镍红土矿物相组成;采用JSM−6360LV型扫描电镜(SEM,日本电子)检测镍红土矿显微结构;采用WFX−130B型原子吸收光谱仪(AAS,北京瑞利)分析及浸出液中Ni和Co的含量。
1.2 实验方法
取10 g镍红土矿置于100 mL碗状瓷坩埚中,加2 mL水润湿,然后加入 2.2 mL浓硫酸(质量分数为98%),混合熟化5 min,然后置入箱式电阻炉中进行焙烧;焙烧产物在常温下浸出10 min,分析浸出液中Ni和Co的含量,分别计算Ni和Co的浸出率。
1.3 反应原理
采用浓硫酸为反应试剂,使镍红土矿中镍和钴的氧化物转化为水溶性的硫酸盐,然后用热水浸出。镍和钴的硫酸化反应如下:

2 结果与讨论
2.1 镍红土矿的矿物学分析
镍红土矿主要化学组成(质量分数)见表1,物相组成和显微结构分别见图1和图2。由表1可知:该镍红土矿中Ni,Mg和Si含量较低,同时Fe含量接近50%,属典型的高铁低镁褐铁矿型低品位镍红土矿。由图1可知:镍红土矿中的Fe基本以针铁矿(FeOOH)的形式存在。从图2可见:镍红土矿颗粒粒径不均匀,基本呈椭圆形。
对镍红土矿中Ni,Co以及相关元素Fe和Mn的赋存状态进行分析[10](表2)。结果表明:Ni和Co的赋存状态是不一致的:Ni的存在形式与Fe密切相关,主要以晶格取代的方式存在于针铁矿中,比例接近90%,少量以吸附形式存在;Co一般与Mn共生,主要以物理吸附的形式存在于针铁矿颗粒的缝隙之间[11],比例超过75%,同时部分以化学吸附的形式存在,少量以晶格取代形式存在。
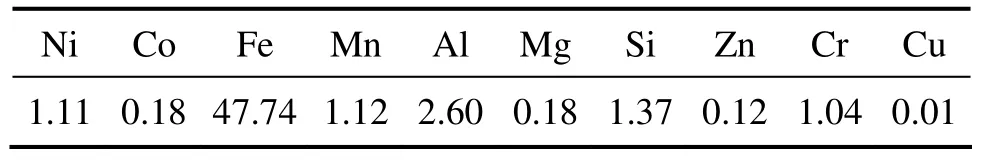
表1 镍红土矿主要元素组成Table 1 Composition of nickel laterite material %

图1 镍红土矿的XRD谱Fig.1 XRD patterns of nickel laterite material

图2 镍红土矿的SEM照片Fig.2 SEM image of nickel laterite material
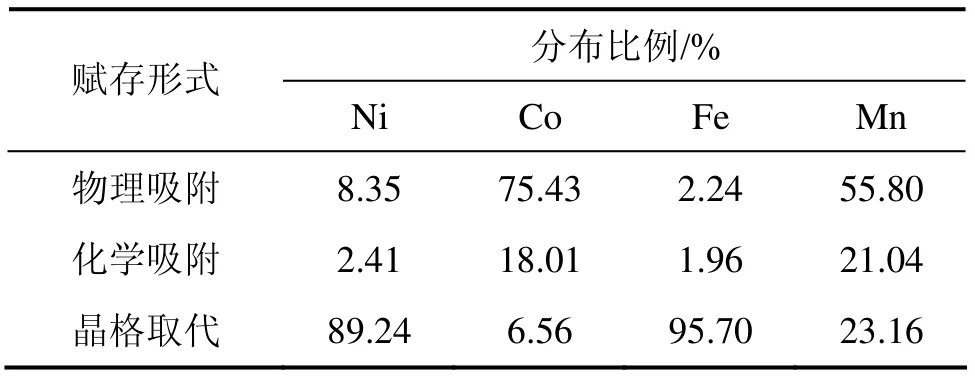
表2 镍红土矿中Ni和Co的赋存状态Table 2 Present modes of nickel and cobalt in nickel laterite
2.2 镍和钴的硫酸化动力学曲线
图3所示为红土矿中镍在300~750 ℃温度区间的硫酸化动力学曲线。在300~600 ℃的低温区,镍的硫酸化程度随着焙烧时间的延长而增大,并在30 min左右接近于完成。这种动力学曲线符合典型的多相液固区域反应动力学曲线特征[12],包含加速段和完成段。加速段曲线表示反应的速率随时间迅速增大,也称为自动催化段,因为硫酸化反应界面随反应时间的延长而不断扩大,起到了催化作用。完成段曲线表示反应的速率随时间的延长而趋于平缓,反应速率减小。这是因为硫酸化反应界面的前沿达到最大,反应界面不断缩小,反应受到阻碍,并接近完成,也称反应界面缩小段。同时焙烧温度越高,硫酸化速率越快,镍的硫酸化程度越高。这是因为温度的升高有利于硫酸向固体颗粒内部扩散,同时缩短了硫酸化反应到达最大界面的时间。

图3 镍的硫酸化动力学曲线Fig.3 Dynamic curves of nickel sulfation
在600 ℃以上的高温区,镍的硫酸化反应速率在短时间内随时间的延长而迅速增加,但反应速率很快随着温度的升高和时间的延长而降低,同时最大硫酸化程度下降。这是因为随着温度的升高和时间的延长,一方面,镍的硫酸化反应速率因反应界面的缩小而减缓,另一方面,在高温下镍的硫酸化和硫酸镍的分解成为一对竞争反应,硫酸镍在640~670 ℃开始被分解成氧化镍[13],即:

图4所示为红土矿中钴在300~750 ℃温度区间的硫酸化动力学曲线。钴的动力学曲线与镍的相似,在300~600 ℃的低温区同样符合典型的多相液固区域反应动力学曲线特征,在600 ℃以上的高温区也存在钴的硫酸化和硫酸钴分解(初始分解温度在 640~690 ℃之间[13])的竞争反应。不同的是,焙烧温度对钴的硫酸化影响更为明显:随着温度的升高,镍的最大硫酸化程度约从45%增加到75%,而钴的最大硫酸化程度约从35%增加到了90%。

图4 钴的硫酸化动力学曲线Fig.4 Dynamic curves of cobalt sulfation
2.3 镍和钴的硫酸化动力学类型
镍和钴在300~600 ℃内的硫酸化动力学曲线是典型的多相液固区域反应动力学曲线(600 ℃以上的高温区曲线变化规律性差,因此没有采用该组数据进行分析),它符合Bagdasarym于1945年提出的关于多相液固反应的核长大过程速率由小变大的模型,其反应进行的程度α可用Erofeev方程表示:

式中:α为反应进行的程度,即镍和钴的硫酸化程度;k为反应速率常数;t为反应时间;n为矿物中晶粒性质和几何形状的函数,不随浸出条件而变。当n<1时,对应初始反应速率极大但反应速度随时间增长不断减小的反应类型[14]。
将式(4)两边同时取自然对数得:

将各温度下不同时间的镍、钴硫酸化程度代入函数ln(−ln(1−α)),并分别对相应lnt作图,可得图5和图6。由图5和6可知,在300~600 ℃,镍和钴硫酸化过程中的ln(−ln(1−α))与lnt符合线性关系,说明红土矿中镍和钴的硫酸化动力学过程符合 Bagdasarym提出的模型,硫酸化速率可用Erofeev方程表示。图5中各直线斜率在0.27~0.44之间,平均值为0.37;图6中各直线斜率在0.39~0.53,平均值为0.48。

图5 镍的硫酸化 ln(−ln(1−α))与 ln t关系图Fig.5 Curves of ln(−ln(1−α))to ln t for nickel sulfation

图6 钴的硫酸化 ln(−ln(1−α))与 ln t关系曲线Fig.6 Curves of ln(−ln(1−α))to ln t for cobalt sulfation
2.4 反应表观活化能及控制步骤
反应速率常数是温度的函数,热力学温度T对反应速率常数的影响可用Arrhenius公式表示:

式中:A0为频率因子;E0为反应的表观活化能。
由式(5)可知,图5和图6中直线的截距代表lnk。根据式(7)以lnk对1/T作图,通过直线斜率即可求得硫酸化反应的表观活化能。图7所示为镍和钴硫酸化反应的lnk与1/T的关系图,可计算镍和钴的硫酸化反应的表观活化能E0分别为 21.45 kJ/mol和 34.81 kJ/mol。同时,根据图7中直线在纵坐标上的截距可分别求得A0,即可获得镍和钴硫酸化速率常数k(Ni)和k(Co)与T的函数关系式:

反应速率常数的温度系数是指温度每升高10℃,反应速率常数增加的倍数[15]。反应速率常数的温度系数可以判别化学反应的动力学控制过程。对于扩散控制过程,反应速率常数的温度系数一般为1.0~1.6;对于化学反应控制过程,反应速率常数的温度系数一般为2;由式(8)和(9)可分别计算镍和钴硫酸化反应的速率常数分别为1.05和1.09,故其动力学速率控制过程都属于内扩散控制。

图7 镍和钴硫酸化反应的ln k与1/T的关系曲线Fig.7 Curves of ln k to 1/T for nickel and cobalt sulfation
3 结论
(1)以浓硫酸为反应试剂,采用硫酸熟化−焙烧法从低品位镍红土矿中提取了镍和钴,其硫酸化程度分别达到75%和90%。
(2)红土矿中的镍和钴在300~600 ℃内的硫酸化动力学曲线属于典型的多相液−固区域反应动力学曲线。升高焙烧温度可以提高镍和钴的硫酸化速率和硫酸化程度。硫酸化反应动力学过程符合Bagdasarym提出的模型,可以采用ln(−ln(1−α))=lnk+nlnt方程对数据进行拟合。镍和钴的硫酸化反应表观活化能分别为21.45 kJ/mol和34.81 kJ/mol,且其硫酸化反应过程受内扩散控制。
[1]Kempthorne D,Myers D M.Mineral commodity summaries 2010[R].Washington: US Geological Survey,2010: 108−109.
[2]Ashok D D,Bacon W G,Robert C O.The past and the future of nickel laterites[C]//PDAC (Prospectors and Developers Association of Canada)2004 International Convention,Trade Show & Investors Exchange.Toronto,2004: 1−27.
[3]刘志宏,杨慧兰,李启厚,等.红土镍矿电炉熔炼提取镍铁合金的研究[J].有色金属(冶炼部分),2010(2): 2−5.LIU Zhi-hong,YANG Hui-lan,LI Qi-hou,et al.Study on the process of extraction ferronickel from laterite by electric smelting[J].Nonferrous Metals: Extractive Metallurgy,2010(2):2−5.
[4]Georgiou D,Papangelakis V G.Sulfuric acid pressure leaching of a limonitic laterite: Chemistry and kinetics[J].Hydrometallurgy,1998,49(1/2): 23−46.
[5]Zuniga M,Parada F,Asselin E.Leaching of a limonitic laterite in ammoniacal solutions with metallic iron[J].Hydrometallurgy,2010,104(2): 260−267.
[6]Loverday B K.The use of oxygen in high pressure acid leaching of nickel laterites [J].Minerals Engineering,2008,21(7):533−538.
[7]LUO Wei,FENG Qi-ming,OU Le-ming,et al.Fast dissolution of nickel from a lizardite-rich saprolitic laterite by sulphuric acid at atmospheric pressure[J].Hydrometallurgy,2009,9(1/2):171−175.
[8]GUO Xue-yi,LI Dong,Park K H,et al.Leaching behavior of metals from a limonitic nickel laterite using a sulfation-roasting-leaching process[J].Hydrometallurgy,2009,99(3/4): 144−150.
[9]LI Dong,Park K H,WU Zhan,et al.Response surface design for nickel recovery from laterite by sulfation-roasting-leaching process[J].Transactions of Nonferrous Metals Society of China,2010,20(S1): s92−s96.
[10]Swamy Y V,Kar B B,Mohanty J K.Physico-chemical characterization and sulphatization roasting of low-grade nickeliferous laterites[J].Hydrometallurgy,2003,69(1/2/3):89−98.
[11]Mcdonald R G,Whittington B I.Atmospheric acid leaching of nickel laterites review Part I: Sulfuric acid technologies[J].Hydrometallurgy,2008,91(1/2/3/4): 35−55.
[12]韩其勇.冶金过程动力学[M].北京: 冶金工业出版社,1983:49−54.HAN Qi-yong.Dynamics in the process of metallurgy[M].Beijing: Metallurgy Industry Press,1983: 49−54.
[13]Hiroaka T.Thermal decomposition temperatures of metal sulfates[J].Thermochimica Acta,1984,80(1): 23−33.
[14]畅永锋,翟秀静,符岩,等.还原焙烧红土矿的硫酸浸出动力学[J].分子科学学报,2008,24(4): 241−245.CHANG Yong-feng,ZHAI Xiu-jing,FU Yan,et al.Sulphuric acid leaching kinetics of pre-reduced laterite ores[J].Journal of Molecular Science,2008,24(4): 241−245.
[15]涂敏瑞,周进.硫磷混酸分解磷矿动力学研究[J].化学工程,1995,23(1): 62−67.TU Min-rui,ZHOU Jin.Kinetics of acidulation of phosphate rock with a mixture of phosphoric and sulfuric acids[J].Chemical Engineering,1995,23(1): 62−67.

