南瓜叶中γ-氨基丁酸的提取及薄层扫描测定
黄美娥,彭 胜,陈阳波,袁洪昆
1吉首大学林产化工工程湖南省重点实验室;2吉首大学城乡资源与规划学院,张家界427000
南瓜(Cucurbita moschata Duch.)系葫芦科南瓜属一年生蔓生草本植物,种植历史悠久,世界各地均有栽培[1]。南瓜性味甘温,入脾胃二经,具有补中益气、消炎止痛、解毒杀虫等功效。对其功能成分如γ-氨基丁酸、葫芦巴碱等的研究报道很多[2]。南瓜叶作为保健食品资源之一,资源丰富,天然无公害,但国内外关于从南瓜叶中提取γ-氨基丁酸的研究鲜有报道。
γ-氨基丁酸(γ-aminobutyric acid,简称GABA),是一种重要的功能性非蛋白质氨基酸,参与体内的多种代谢活动,具有很高的生理活性。GABA在医药、食品、饲料中具有广阔的应用前景,2009年9月 29日,GABA已被中华人民共和国卫生部批准为可用于食品生产加工的新资源,开发GABA产品及其功能性食品、保健品是当前食品及医药领域的研究热点之一[3]。因此利用南瓜叶提取GABA,对充分利用南瓜资源具有重要的经济意义和现实意义。本实验通过对南瓜叶中GABA的提取测定进行研究,旨在为南瓜叶的进一步开发利用奠定基础。
1 材料与方法[4-7]
1.1 材料、试剂与仪器
南瓜叶:于7月采集吉首大学张家界校区后山菜园鲜南瓜叶,置恒温干燥箱中50℃干燥至恒重,粉碎过40目筛,保存,备用。
γ-氨基丁酸标准品:中国药品生物制品检定研究所,纯度≥99%;薄层层析硅胶G、茚三酮、正丁醇、冰醋酸、无水乙醇等均为分析纯。
日本岛津CS-9000型薄层扫描仪、RE-540旋转蒸发仪、WT-150粉碎机、CS101-3D电热鼓风干燥箱、DSY-2-4孔电热恒温水浴锅(北京国华医疗器械厂)、AEG-200十万分之一天平。
1.2 方法
1.2.1 对照品溶液的配制
精密称取γ-氨基丁酸对照品25 mg置于25 mL容量瓶中,用20%乙醇溶解并定容至刻度,摇匀,制成1 mg/mL的对照品溶液,备用。
1.2.2 供试品溶液的制备
称取南瓜叶样品粉末10.00 g,加入20%的乙醇溶液100 mL,浸提1 h,过滤,定容至100 mL,摇匀,制得南瓜叶供试品溶液,备用。
1.2.3 薄层色谱条件与薄层扫描条件[3]
称取硅胶G 30 g放入研钵中,加入0.5%CMCNa和60 mL水调成糊状后涂布于玻璃板(10 cm× 20 cm)上,厚度为0.5 mm,置室温风干后于105℃活化1 h,置干燥器中备用。分别吸取5 uL的对照品溶液和供试品溶液点样,用正丁醇、醋酸、水按4∶1∶1的比例配成展开剂,饱和后按上行方式展开。用0.2%茚三酮乙醇溶液喷雾显色,105℃烘数分钟,直至获最大斑点,薄层扫描,根据薄层扫描结果确定南瓜叶中γ-氨基丁酸的薄层扫描条件为:反射式双波长线式扫描,λs=515 nm,λr=680 nm,狭缝为1.0*10.0 mm,SX=1。
1.2.4 标准曲线的制备
称取γ-氨基丁酸对照品100 mg用蒸馏水定容至100 mL,得1 mg/mL的γ-氨基丁酸对照品溶液。分别吸取1 mg/mL的γ-氨基丁酸对照品溶液,配成0.125、0.25、0.50、1.00、2.00 mg/mL的系列对照溶液。于硅胶板上点样,层析展开、显色、薄层扫描,以对照溶液浓度为横坐标(x),峰面积积为纵坐标(y),建立标准曲线,得回归方程为y=77747x+ 4948.7,相关系数R2=0.9991。表明γ-氨基丁酸薄层扫描时浓度在0.125~2.0 mg/mL范围内有较好的线性关系。
1.2.5 稳定性试验
用毛细点样管吸取对照品溶液5 μL点于薄层板上,按上述条件展开、显色、薄层扫描,每隔30 min扫描1次,共测定5次,计算峰面积的RSD(n=5)为5.34%,RSD(n=4)为2.50%,表明显色后在2 h内较稳定。
1.2.6 重复性试验
用毛细点样管吸取同一南瓜叶供试品溶液5 μL点样,按上述条件展开、显色、薄层扫描,重复扫描6次,结果RSD为0.98%。
1.2.7 精密度实验
同板精密度试验:用毛细点样管吸取对照品溶液5 μL点样(重复点6个点),按上述条件展开、显色、薄层扫描,结果RSD为1.99%。异板精密度试验:用毛细点样管吸取对照品溶液5 μL点于6块薄层板上,按上述条件展开、显色、依次扫描测定,结果RSD为2.13%。
1.2.8 加样回收试验
将对照品溶液5 μL,供试品溶液6 μL和对照品溶液5 μL,与供试品溶液3 μL的混合液分别点于同一薄层板上,按上述条件展开、显色、扫描,测得平均回收率(n=4)为99.61%,RSD(n=4)为2.04%。
1.2.9 提取条件的确定
1.2.9.1 提取溶剂的选择
称取10.00 g南瓜叶粉末10份于三角瓶中,分别加入蒸馏水、20%乙醇、40%乙醇、60%乙醇、80%乙醇各100 mL,于常温浸提1 h,过滤,滤渣重提1次,合并滤液;分别进行减压浓缩、醇沉、过滤、浓缩,扫描测定。
1.2.9.2 提取时间的选择
称取10.00 g南瓜叶粉末10份于三角瓶中,加入20%乙醇100 mL,于常温下分别浸提1、2、3、4、5 h,过滤,滤渣重提1次,合并滤液;减压浓缩、醇沉、过滤、浓缩,扫描测定。
1.2.9.3 提取料液比的选择
称取10.00 g南瓜叶样品10份于三角瓶中,分别加入20%乙醇80、100、120、140、160 mL,于常温下浸提1 h,过滤,滤渣重提1次,合并滤液;减压浓缩、醇沉、过滤、浓缩,扫描测定。
1.2.10 正交试验
由单因素试验确定的范围,选择乙醇浓度、固液比、提取时间三因素作为考察对象,每因素确定三个水平,进行正交试验,因表水平见表1。
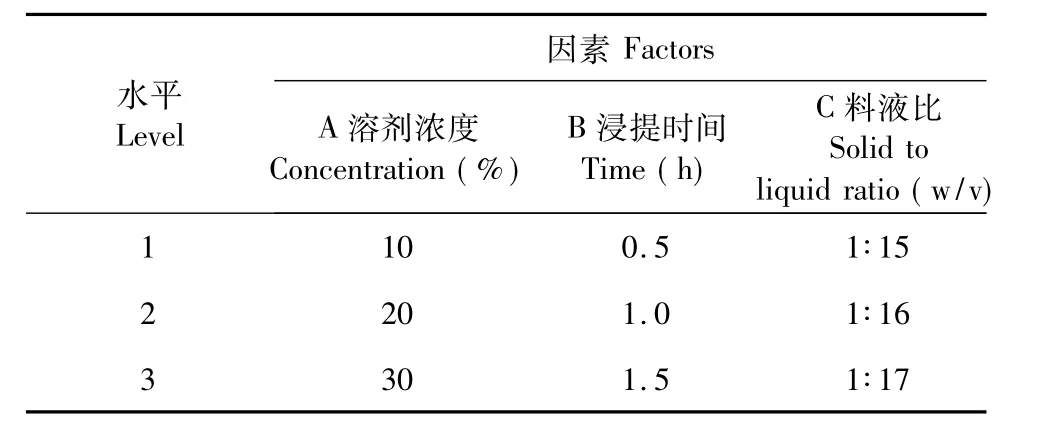
表1 正交试验因素表Table 1 Orthogonal experiment facts
2 结果与分析
2.1 提取条件的单因素实验确定
2.1.1 提取溶剂的选择结果
按1.2.9.1进行提取测定,提取溶剂对南瓜叶中γ-氨基丁酸提取效果的影响结果为:以水和高浓度乙醇为提取溶剂比稀乙醇的提取效果差,以20%乙醇为提取溶剂进行提取实验得γ-氨基丁酸含量值最高为156 mg/100 g,故选择提取溶剂浓度的优化区为10%~30%。
2.1.2 提取时间的确定
按1.2.9.2进行提取测定,提取时间对南瓜叶中γ-氨基丁酸提取效果的影响结果为:随着提取时间的延长,提取得到的γ-氨基丁酸的含量反而逐渐降低,提取时间为1 h进行提取实验得γ-氨基丁酸含量值最高为148 mg/100 g,故选择提取时间的优化区为0.5 h~1.5 h。
2.1.3 固液比的选择
按1.2.9.3进行提取测定,提取料液比对南瓜叶中γ-氨基丁酸提取效果的影响结果为:随料液比的增大,南瓜叶中γ-氨基丁酸的含量不断提高,但料液比为1∶14~16时,增大料液比,含量增加放缓。所以,选择料液比的优化区为1∶15~17。
2.2 正交实验结果与分析
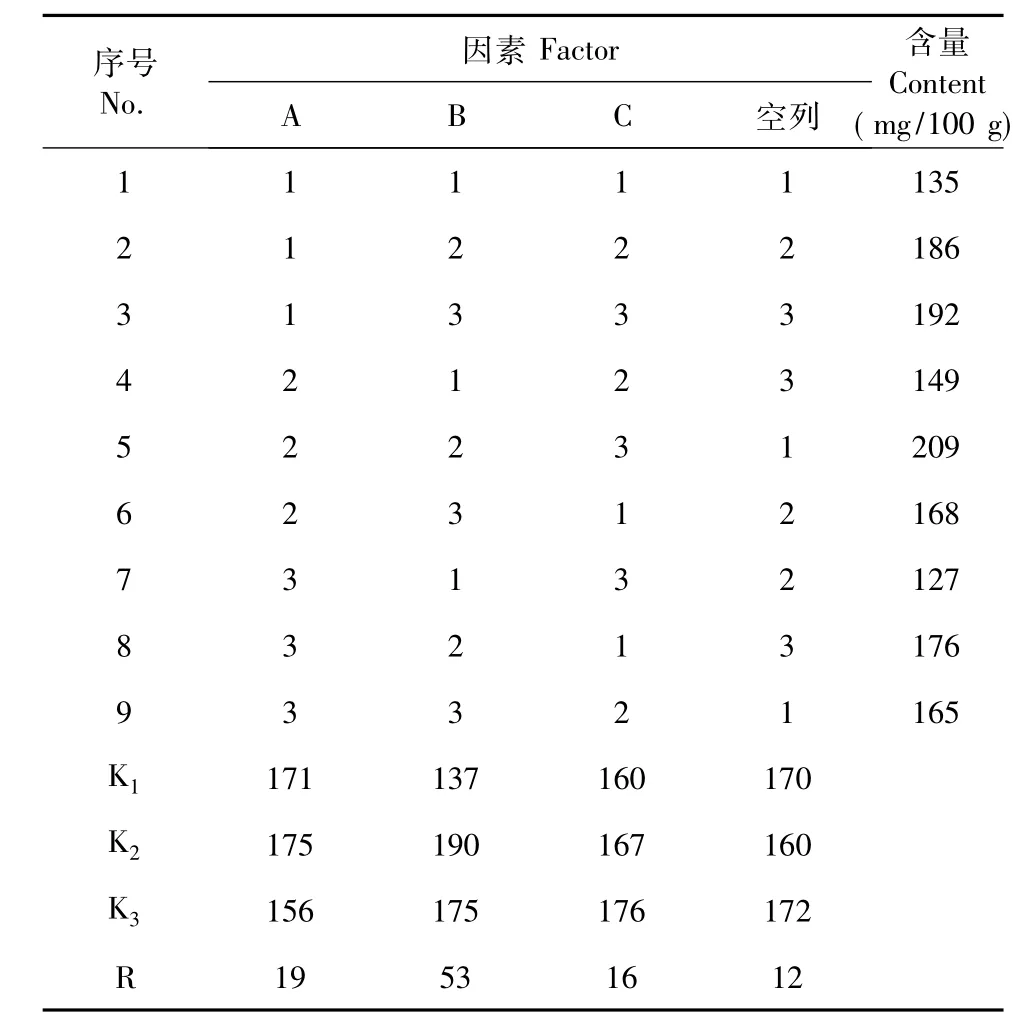
表2 正交试验结果表(n=3)Table 2 The effects of orthogonal experiment(n=3)

表3 方差分析表Table 3 The variance analysis
对表2中数据进行方差分析,结果由表3可见,因素B显著,因素A和C不显著,因素作用的主次顺序是B>A>C,即浸提时间>溶剂浓度>料液比,与极差分析得出的结果一致。对表2数据进行分析得出南瓜叶中γ-氨基丁酸提取条件最优水平组合为A2B2C3,即以20%乙醇为溶剂、浸提1 h、料液比1∶17,其γ-氨基丁酸的含量为209 mg/100 g。
2.3 验证实验
按上述最佳条件A2B2C3进行3次验证提取试验,测得南瓜叶中γ-氨基丁酸的含量分别为210、205、212 mg/100 g,平均含量209 mg/100 g。
3 结论
本研究采用单因素和正交试验确定了南瓜叶中γ-氨基丁酸的提取条件,即精密称取供试品适量,加入17倍体积的20%乙醇、常温浸提1 h。并以薄层扫描法测定南瓜叶中γ-氨基丁酸的含量为209 mg/ 100 g,其方法操作简单、灵敏,结果准确可靠。
1 Jiangsu New Medical College(江苏新医学院编).Dictionary of Chinese Materia Mediaca(中药大词典(上册)).Shanghai:Shanghai Scientific&Technical Publishers,1985.1555-1560,3225.
2 Liu Y(刘洋),Zhang YW(张耀伟),Cui CS(崔崇士).Correlative analysis on nutritional components and fruit characteistics of India pumpkin raised for pulp.Northern Horticul (北方园艺),2007,(1):14-16.
3 Wei ZZ(魏珍珍),Zhao M(赵明),Li SR(李双容),et al.Study on feasibility of determination of GABA content in tea by colorimetric method.Acta Agric Jiangxi(江西农业学报),2010,22(8):56-58.
4 Huang ME(黄美娥),Yu HZ(于华忠),Cao Y(曹庸).Extraction and determination of γ-aminobutyric acid in fern.A-mino Acids&Biotic Resour(氨基酸与生物资源),2004,27:77-78.
5 Deng K(邓康),Luo J(罗健).TLC scanning determination of 4 kinds of neurotransmitter in mouse brain.Northwest Pharm J(西北药学杂志),2000,15:150-151.
6 Zhao CQ(赵长琦),Li GM(李广民),Wang J(王军).TLC-densitometric determination of hypotensive constituent γ-aminobutyric acid in Hongqi.J Northwest Univ,Nat Sci(西北大学学报,自科版),1995,6:277-278.
7 Pang MJ(逄敏洁),Li DW(李多伟),Wang YC(王义潮),et al.TLC scanning determination of sclareol.Chin J Pharm Anal(药物分析杂志),2008,28:1554-1555.

