不同施肥措施大豆田土壤镰孢菌种群动态定量研究初报
魏 巍,许艳丽,刘金波,韩晓增
(1. 中国科学院东北地理与农业生态研究所黑土区农业生态院重点实验室,海伦农田生态系统国家野外观测研究站,黑龙江哈尔滨150081;2. 中国科学院研究生院,北京100049)
镰孢菌属真菌(Fusarium spp. )是土壤真菌的主要类群。其可以侵染寄主植物的维管束系统和器官,从而引起植物萎蔫和根、茎、叶和果实腐烂等症状[1],因此该属真菌是农业生产中作物萎蔫病和根腐病的主要病原菌。由其引发的病害可降低农作物产品品质,甚至导致大量减产,是农业生产上最难防治的土传病害[1-2]。近年来,为降低镰孢菌病害带来的损失,广泛提倡结合化学药剂拌种[3-4]、应用轮作以及保护性耕作等农艺措施[5-6],施用生防菌[7]等方法改善土壤镰孢菌种群分布,进而缓解病害发生的程度。施肥作为重要的农业管理措施,可以通过直接影响土壤中的化学成分,引起土壤微生物活性和群落结构改变[8];还可以通过改变土壤物理性状,进而影响地上植被的生长及地下根系发育及其分泌,从而间接地影响土壤微生物群落[9]。然而,长期施肥措施对土壤中镰孢菌种群的影响等方面的研究,还鲜见报道。
土壤中镰孢菌种群密度的研究多采用稀释平板法等传统研究手段,而传统方法的局限性使其无法全面反映自然条件下镰孢菌的种群密度,从而使结果产生偏差。实时荧光定量PCR (real-time quantitative polymerase chain reaction,Real-Time QPCR)技术的提出,为植物病原菌检测提供了全新的方法,即通过实时监测病原菌目的序列的PCR 扩增产物的荧光信号强度并进行解析的方法[10]。目前,国内外研究者根据植物保护学领域中病害诊断和病原菌检测等方面的需要,广泛地使用简便易行、成本较低的荧光嵌合法,选择SYBR GreenⅠ和Eva Green 等荧光染料对环境样品中的镰孢菌进行绝对定量分析[11-13]。
应用传统定量方法和Real-Time QPCR 定量方法对黑土大豆田土壤镰孢菌种群密度进行了研究,旨在对比两种定量研究方法的同时,建立土壤镰孢菌属种群密度的Real-Time QPCR 研究体系。通过对3 种施肥措施下土壤镰孢菌属种群密度动态的研究,探讨不同施肥措施对土壤镰孢菌种群密度动态的影响,以期从科学施肥角度为如何改善土壤镰孢菌种群分布,降低镰孢菌病害发生提供补充及参考。
1 材料与方法
1.1 样地设置
试验设在中国科学院海伦农业生态试验站(47°26'N,126°38'E)长期定位试验区。该试验区地处于温带大陆性季风气候的东北黑土区中部,冬季寒冷干燥,夏季高温多雨,雨热同季。年平均气温1.5 ℃,年均降水量570 mm,年均有效积温2 400 ℃。土壤类型为中厚层黑土,开垦前为草甸草原植被,开垦历史为100 a 左右。于1993 年将农田设3 个施肥处理:无肥处理(No Fertilizer,NF)、化肥处理(NP chemical fertilizer,NP)和化肥配施有机肥处理(NP chemical fertilizer and organic manure,NPM)。施肥量为N 32.26 kg·hm-2、P2O582.44 kg·hm-2、有机肥15 000 kg·hm-2,有机肥为腐熟猪粪[14-15]。土壤理化性质如表1 所示。种植方式为小麦-玉米-大豆轮作,研究取样时农田作物为大豆。
1.2 样品采集
样品采集于2008 年大豆田3 种施肥措施下的土壤,时间对应大豆的5 个生育时期:播前期(5 月13日)、苗期(6 月13 日)、花期(7 月13 日)、鼓粒期(8 月8 日)和成熟期(9 月28 日)。采用土钻按五点取样法采集非根际土壤,同时为避免空气对土壤表层的影响,去除0~5 cm 处的表土,采集5 cm~20 cm 深度的土壤样品。混合均匀后用无菌封口袋包扎密封,置于冰盒中带回实验室。新鲜土样过2 mm 土壤筛后分成3 份,于4℃保存备用。
1.3 土壤镰孢菌传统定量研究
土壤镰孢菌的传统定量研究结合土壤稀释平板法和形态学鉴定方法进行。取10g 土壤样品,加入100ml 无菌水中,制成10-1稀释液。室温,120 rpm 震荡20 min 后静止10 min,取上清液依次制成10-2和10-3稀释液。无菌条件下分别取3 个稀释度的溶液0.5 ml 涂匀于PPA 培养基平板上[16],各3 次重复。25℃培养3 d~5 d,选择代表性稀释度进行CFU 计数。再将该稀释度下生长的全部菌落转到PDA 平板上,经25℃光照与黑暗交替培养4 d 后进行形态学鉴定[17-18],最终确定该稀释度下镰孢菌属真菌数量并统计单位土壤中镰孢菌数量。
1.4 土壤镰孢菌Real-Time QPCR 定量研究
1.4.1 土壤微生物基因组总DNA 及Real-Time QPCR 标准品尖镰孢菌基因组总DNA 提取。应用美国Omega 公司的土壤微生物基因组DNA 提取试剂盒提取土壤微生物基因组总DNA,提取过程按照说明手册进行。Real-Time QPCR 应用经形态学鉴定及单孢分离得到的尖镰孢菌Fusarium oxysproum 的基因组DNA 作为标准品。镰孢菌纯菌基因组总DNA 的提取参考李志岗等方法[19]。提取到的DNA 均使用大连宝生物公司生产的TAE 琼脂糖凝胶DNA 回收试剂盒进行纯化。纯化后总DNA 通过0.8%的琼脂糖凝胶电泳进行检验。
1.4.2 Real-Time QPCR 扩增反应引物及条件。应用镰孢菌属特异性引物TR 和TS 进行Real-Time QPCR 检测,其扩增片段位于镰孢菌ITS 基因上,长度为170 bp[20]。序列分别为上游引物TR:5'-TTC GTG ATA CCA AAG GGA C-3'和下游引物TS:5'-CCA CAA GGG CAG CAA CGG-3'。
Real-Time QPCR 应用Bio-Rad 公司MJ Opticon Monitor 荧光定量PCR 仪进行。反应体系体积为25 μL,其中10 ×PCR Buffer 2 μL,MgCl2(200 mmol·L-1)2 μL,dNTP (10 mmol·L-1)2 μL,上、下游引物(20 pmol·L-1)各1 μL,Taq 酶0.3 μL,EVA GreenⅠ2 μL,DNA (20 ng·μL-1)提取物2 μL,最后加去离子水补足。反应条件为:94℃预变性4 min;94℃变性10 s,56.6℃退火30 s,72℃延伸20 s,并收集荧光信号,40 个循环;72℃5 min。熔点曲线分析温度设于65℃~95℃之间,每隔0.2℃收集荧光信号1 s。
1.5 数据分析
采用MJ Opticon Monitor TM 3.1 实时荧光定量分析软件和DPS 7.55 统计软件对试验数据进行统计分析。

表1 供试土壤的基本理化性质Table 1 Basic physical and chemical properties of soilsg·kg -1
2 结果与分析
2.1 土壤镰孢菌传统定量研究
稀释平板法计数3 种施肥措施下土壤镰孢菌数量的结果显示,图1。在大豆生育期中的播前期、苗期、花期、鼓粒期和成熟期5 个时期,3 种施肥措施下土壤镰孢菌属数量呈现出不同的动态变化趋势。其中,无肥措施(NF)镰孢菌数量变化趋于平稳,在花期达到数量峰值。但该峰值与其它时期土壤镰孢菌数量间差异不显著(p >0.05)。施用化肥(NP)和化肥配施有机肥(NPM)措施土壤镰孢菌数量变化趋势相似,均为由苗期开始数量逐渐上升,达到各自的峰值后再分别有所下降。不同的是NP 措施在花期达到了峰值,而NPM 措施在苗期达到了峰值。然而,NP 和NPM 措施土壤镰孢菌数量峰值与二者其它时期土壤镰孢菌数量间同样为差异不显著(p >0.05)。
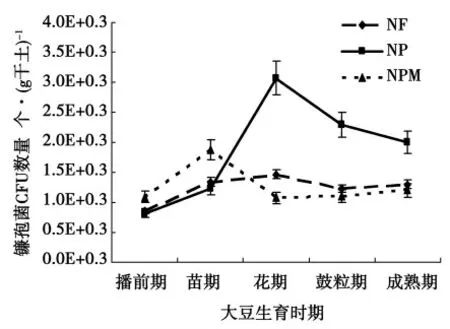
图1 不同施肥措施土壤镰孢菌CFU 数量动态Fig.1 Dynamics of the CFU of soil Fusarium spp. in different fertilization managements
2.2 土壤镰孢菌Real-Time QPCR 定量研究
2.2.1 Real-Time QPCR 定量研究体系建立。研究中选取尖孢镰孢菌基因组DNA 作为标准品,测定该标准品原始溶液DNA 浓度为58.8 ng·μL-1。利用MJ Opticon Monitor TM 3.1 软件绘制出反应后的熔点曲线和标准曲线。熔点曲线无杂峰,图2,表明扩增反应产物单一且无引物二聚体。标准曲线的相关系数R2=0.991,斜率为-0.301 4,计算其扩增效率E=101%,图3。
2.2.2 土壤镰孢菌DNA 含量动态研究 根据标准曲线的斜率及C (t)值,由MJ Opticon Monitor TM 3.1软件计算出样品组DNA 含量,并绘制其动态变化曲线,图4。在大豆生育期中的播前期、苗期、花期、鼓粒期和成熟期5 个时期,3 种施肥措施下土壤镰孢菌属DNA 含量动态变化趋势均为由苗期开始随着大豆生育期逐渐上升,达到各自的峰值后再分别下降。其中,无肥措施土壤镰孢菌DNA 含量在花期达到峰值,每克干土中含量为99.61 pg。该峰值与播前期、苗期和成熟期土壤镰孢菌DNA 含量间差异极显著(p<0.01),而与随后的鼓粒期土壤镰孢菌DNA 含量差异不显著(p >0.05),同时播前期和苗期间差异也不显著(p >0.05)。各生育时期土壤镰孢菌DNA 含量间的差异程度说明在不施用肥料的条件下,土壤镰孢菌DNA 含量经过播前期的过渡,由苗期开始急剧升高,并在花期达到最大,随后在鼓粒期和成熟期又迅速地下降。
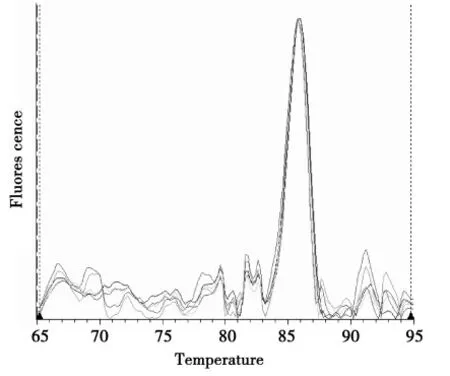
图2 Real-Time QPCR 反应中标准品熔点曲线Fig.2 The melting curve of standard substrate in real-time QPCR
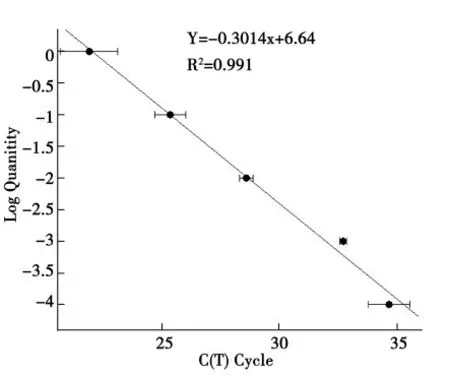
图3 Real-Time QPCR 标准曲线Fig.3 The standard curve of real-time QPCR
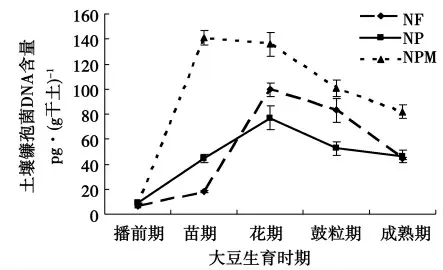
图4 不同施肥措施土壤镰孢菌DNA 含量动态Fig.4 Dynamics of the genetic DNA of soil Fusarium spp. in different fertilization managements
施用化肥(NP)后,土壤镰孢菌DNA 数量达到最大的时期仍然是花期,但其峰值较无肥措施有所下降,每克干土中含量为77.09 pg。该峰值与苗期和鼓粒期土壤镰孢菌DNA 含量间差异以及播前期和苗期间差异均达到极显著水平(p <0.01),而鼓粒期和成熟期间的差异则不显著(p>0.05),且除苗期外的各时期数值均低于无肥措施。这说明NP 的施用尽管没有改变土壤中镰孢菌DNA 的时间分布趋势,但却在总体上降低了其在土壤中的含量。同时也改变了初期(播前期)镰孢菌DNA 数量的增长速度,从播前期即开始迅速地上升。花期过后迅速下降,到鼓粒期时趋于平稳。
施用化肥配施有机肥(NPM)后,土壤镰孢菌DNA 数量出现峰值的时期发生改变,提前至苗期,每克干土中含量达到140.83 pg,且远高于同时期的另外2 种施肥措施(p <0.01)。该峰值与播前期土壤镰孢菌DNA 含量间差异达到极显著水平(p <0.01),而与花期间的差异并不显著(p >0.05)。这说明在改施NPM 后,土壤中镰孢菌DNA 的时间分布趋势发生了变化。其土壤中的含量在播前期开始急剧地上升,苗期达到最大并将此状态保持到了花期,随后才开始下降。同时5 个生育时期的土壤中镰孢菌DNA 数量均高于同期其它施肥方式,由此可见NPM 的施用可以显著地增加土壤中镰孢菌DNA 的含量。
比较苗期3 种施肥措施土壤中镰孢菌DNA 总含量,NPM 措施含量最高,每克干土中含量达到140.83 pg 。其次为NP 措施,含量为44.61 pg。无肥措施最低,仅为18.33 pg。并且3 种措施相互间的差异均达到极显著水平。该结果说明大豆田土壤采取NP 或NPM 措施,均可极显著地增加苗期土壤镰孢菌DNA 含量。其中,NPM 措施甚至可以将土壤镰孢菌DNA 含量提升1 个数量级。由此可见,施肥措施的不同,不仅可以影响土壤镰孢菌DNA 的含量,甚至可以改变其时间分布规律。
3 讨论
传统定量方法研究大豆田土壤镰孢菌种群密度结果表明,3 种施肥措施土壤镰孢菌种群密度对应大豆生育时期的动态变化均不显著(p >0.05)。施肥有利于提高土壤微生物数量,特别是化肥与有机肥配施可明显增加土壤的微生物数量[8],而上述土壤镰孢菌种群密度变化不显著的结果很可能是由于传统稀释平板法所具有的限制作用造成的。长期以来,土壤镰孢菌种群密度的研究一直借助于稀释平板法等传统研究手段。虽然稀释平板法凭借操作简便、快捷和易成功等优点[21],成为土壤微生物分离培养及衡量微生物小群体多样性的常规手段,但是该方法也存在很多缺陷,例如培养基的成份可以影响微生物的生长状况,进而影响所得菌落的多样性水平;菌落形成单位(CFU)的数量通常随培养基营养浓度的降低而增加[22]。因此其无法全面反映自然条件下微生物的生长状况,从而使结果产生偏差。另一方面,土壤中镰孢菌可以通过大型分生孢子、小型分生孢子、厚垣孢子以及菌丝段等方式进行繁殖。因此通过稀释平板法分离培养出的镰孢菌,其来源可能是土壤中尚未生长的大、小分生孢子、厚垣孢子甚至是稀释及接种过程中产生的菌丝段,所以无法真实地反映出自然条件下镰孢菌的数量,致使该方法在进行大量样品中镰孢菌种群密度分析和后续研究时成为一个可能的限制因子。因此,寻找更适合的土壤镰孢菌种群密度的研究方法变得尤为重要。
Real-Time QPCR 反应的得到的熔点曲线无杂峰,标准曲线的相关系数R2=0.991,斜率为-0.301 4,均达到Real-Time QPCR 反应的理想条件,并对不同施肥措施土壤中镰孢菌DNA 含量进行了绝对定量分析。建立Real-Time QPCR 检测体系的最大困难除了引物应具有良好的特异性外,标准曲线的建立同样至关重要。由于Real-Time QPCR 绝对定量是建立在模板的初始浓度与Ct 值关系的基础上,因此为保证样本定量分析具有稳定可重复的结果,标准曲线参数的要求非常严格。理论上一条合格的标准曲线具有3个特点:一致的重复反应、高的线性(R2>0.99)和高扩增效率(E:90%~105%,即斜率≈-0.3)。其中,扩增效率大于100%的原因可能是由于反应抑制剂的存在所造成的。反应抑制剂能够延迟反应Ct值,但随着标准品样品模板的稀释,其浓度逐渐减小,因此在高稀释度标准品样品中反应抑制剂对Ct 值的延迟程度也在减弱,导致高稀释度标准品样品Ct 值略微增高,进而造成扩增效率计算结果略微大于100%。由于研究中作为标准品的镰孢菌基因组DNA 的提取过程中应用了可以成为反应抑制剂的化学药品,如氯仿、饱和酚等[11],所以导致结果中扩增效率为101%。研究中应用的引物扩增已分离镰孢菌菌株的序列大小一致,且无引物二聚体及非特异性扩增出现。因此得出的DNA 质量结果与镰孢菌个体数呈正向相关,即可以通过土壤中镰孢菌DNA 含量间的差异来反映不同施肥措施间土壤镰孢菌种群密度的差异。该方法不经过分离培养过程,可以克服上述传统稀释平板法的局限性,同时还具有快捷、省力等优势。
在大豆根部病害高发的苗期,3 种施肥措施下土壤镰孢菌总DNA 在每克干土中质量(Q)由高到低的顺序为QNPM>QNP>QNF。李海波等(2007)研究表明农田不施肥,有机质含量显著下降;单施化肥或高量化肥可使有机C、N 库保持稳定或小幅波动;化肥和有机肥配合施用则能提高有机质含量,改善土壤质量,提高土壤肥力[23]。因此,大豆田土壤施入化肥配施有机肥(NPM)后,能明显提高土壤有机质养分含量,增强土壤酶活性,增加土壤微生物的数量,创造有利于土壤微生物生长繁育的土壤生态化学环境[22]。土壤镰孢菌的正常生长繁殖同样需要土壤有机质作为养分,因此土壤有机质含量与土壤镰孢菌种群密度应存在正向相关关系,这也很可能是大豆田土壤镰孢菌DNA 含量在NPM 措施中最高的原因。然而土壤中有机质的补充不仅有利于土壤微生物的生长繁殖,还可以显著地提高土壤微生物得多样性水平,使土壤抑制土传植物病害能力提高[24]。已有研究表明,土壤中镰孢菌属不仅包含了大量的植物致病种,其属内的非致病种的营腐生性特性使其可以成为某些致病镰孢菌的生防菌株[25]。因此,尽管在NPM 措施下大豆田土壤镰孢菌DNA 含量高,种群密度大,但同样由于土壤有机质的作用,使其种群多样性水平较无肥措施更为丰富,抑制了致病性镰孢菌的生长,从而提高了土壤自身对大豆根腐病原镰孢菌的抑制能力。然而该结论仍需结合对大豆田土壤镰孢菌种群多样性研究加以证明。
[1]Kistler H C,C Alabouvette,R P Baayen,et al. Systematic Numbering of Vegetative Compatiability Groups in the Plant Pathogenic Fungus Fasarium oxysporum[J]. Phytopathology,1999 (88):30-32.
[2]Isabel M,G Roncero,C Hera. Fusarium as a model for studying virulence in soil borne plant pathogens[J]. Physiological and Molecular Plant Pathology,2003,62 (2):87-98.
[3]Tu J C. Integrated control of the pea root rot disease complex in Ontario[J]. Plant Disease,1987,71 (1):9-13.
[4]Yehia A H,S A EI-Hassan,A H EI-Bahadli. Biological seed treatment to control Fusarium root-rot of broad bean[J]. Egyptian Journal of Phytopathology,1982,14 (1-2):59-66.
[5]Steinkellner S,I Langer. Impact of Tillage on the Incidence of Fusarium spp. in Soil[J]. Plant and Soil,2004,267 (1-2):13-22.
[6]Mohamed Z K. Physiological and antagonistic activities of streptomycetes in rhizosphere of some plants[J]. Egyptian Journal of Phytopathology,1982,14 (1-2):121-128.
[7]刘金波,许艳丽,李春杰,等. 长期连作对大豆根际真菌主要类群的影响[J]. 农业系统科学与综合研究,2009,25 (1):105-108.
[8]Boehm M J,T Wu,A G Stone,et al. Cross-Polarized Magic-Angle Spinning13C Nuclear Magnetic Resonance Spectroscopic Characterization of Soil Organic Matter Relative to Culturable Bacterial Species Composition and Sustained Biological Control of Pythium Root Rot[J]. Applied and Environmental Microbiology,1997 (63):162-168.
[9]黄进勇,李春霞. 土壤微生物多样性的主要影响因子及其效应[J]. 河南科技大学学报:农学版,2004,24 (4):10-13.
[10]Nitsche A,N Steuer,C A Schmidt,et al. Different real-time PCR formats compared for the quantitative detection of human cytomegalovirus DNA[J]. Clinical Chemistry,1999,45 (1):1932-1937.
[11]Zhang Z,J Zhang,Y Wang,et al. Molecular detection of Fusarium oxysporum f. sp. niveum and Mycosphaerella melonis in infected plant tissues and soil [J]. FEMS Microbiology Letters,2005,249 (1):39-47.
[12]Gao X,T A Jackson,K N Lambert,et al. Detection and quantification of Fusarium solani f. sp. glycines in soybean roots with Real-Time Quantitative Polymerase Chain Reaction [J]. Plant Disease,2004,88 (12):1372-1380.
[13]Nicolaisen M,S Suproniene,L K Nielsen,et al. Real-time PCR for quantification of eleven individual Fusarium species in cereals[J].Journal of Microbiological Methods,2008,76 (3):234-240.
[14]乔云发,苗淑杰,王树起,等. 不同施肥处理对黑土土壤呼吸的影响[J]. 土壤学报,2007,44 (6):1028-1035.
[15]王树起,韩晓增,乔云发,等. 长期施肥对东北黑土酶活性的影响[J]. 应用生态学报,2008,19 (3):551-556.
[16]刘金波,许艳丽,魏 巍. 大豆根际土壤镰孢菌不同分离方法比较[J]. 大豆科学,2008,27 (1):106-112.
[17]王拱辰,郑 重,叶琪明,等. 常见镰孢菌分类指南[M]. 北京:中国农业出版社,1996.
[18]Leslie J F,B A Summerell. The Fusarium Laboratory Manual[M]. Ames,Iowa,USA:Blackwell Publishing Professional,2006.
[19]李志岗,宋东辉,王建明,等. 耕层土壤镰刀菌单胞系的建立和基因组DNA 的快速抽提[J]. 山西农业大学学报,2002,32(1):32-35.
[20]魏 巍,许艳丽,刘金波,等. 土壤镰孢菌Real-Time QPCR 定量方法的建立及应用[J]. 大豆科学,2010,29 (4):655-658.
[21]沈 萍,范秀容,李广武. 微生物学实验,3 版[M]. 北京:高等教育出版社,1999.
[22]Helle H,E Susanne. A Resource-Saving Method for Isolation of Fusarium and Other Fungi from Individual Soil Particles[J]. Mycological Research,1999,103 (12):1545-1548.
[23]李海波,韩晓增,王 风. 长期施肥条件下土壤碳氮循环过程研究进展[J]. 土壤通报,2007,38 (2):384-388.
[24]Bailey K L,G Lazarovits. Suppressing soil-borne diseases with residue management and organic amendments[J]. Soil and Tillage Research,2003,72 (2):169-180.
[25]Bao J R,J Velema,K F Dobinson,et al. Using GUS expression in a nonpathogenic Fusarium oxysporum strain in measuring fungal biomass[J]. Canadian Journal of Plant Pathology,2000 (22):70-78.

