2-溴乙烷磺酸钠对ABR反应器运行效果和微生物菌群结构的影响
邓遵,彭剑峰,宋永会* ,袁林江
1.西安建筑科技大学环境与市政工程学院,陕西 西安 710055
2.中国环境科学研究院城市水环境科技创新基地,北京 100012
目前厌氧反应器酸化问题日益严重,国内外有很多关于厌氧折流板反应器(Anaerobic Baffled Reactor,ABR)酸化特征及相应的恢复方法的研究报道[1-3]。这些研究主要集中在由高负荷运行引起的pH降低以及反应器酸化,恢复方法的研究局限于降低负荷、提高碱度等物理化学恢复方法。对于其他问题引起的酸化(如抑制剂对微生物的抑制作用引起的酸化等)及其对ABR反应器的运行效果和微生物群落影响的研究较为缺乏,因而难以为酸化恢复方法的拓展提供有效支撑。
表面活性剂既是民用洗涤剂的重要原料,又是众多工业部门所必需的助剂,所以有“工业味精”的美称,并开始向独立的精细化工产品的方向发展。随着世界人口数量的增加,对日化产品的需求也同步增长[4]。2- 溴乙烷磺酸钠(BrCH2CH2SO3Na,BES)是合成新型表面活性剂不可缺少的原料之一[5-8],如以BES、乙二胺、月桂酸等为主要原料合成的阴离子型双子表面活性剂乙撑-双(N-乙磺酸-十二酰胺)钠盐,以及以BES为亲水基物料和烷基咪唑啉合成的磺基咪唑啉甜菜碱表面活性剂等。
同时,2-溴乙烷磺酸钠是产甲烷菌特有的辅酶M(2-巯基乙烷磺酸)的结构类似物,可选择性地抑制几乎所有产甲烷菌的产甲烷活性[9],当产甲烷菌受到抑制时,产酸菌和产甲烷菌之间的代谢平衡将会遭到破坏,乙酸、甲酸、甲醇等物质不能通过产甲烷菌的作用而降解,造成乙酸等挥发性脂肪酸(volatile fatty acid,VFA)的积累,使厌氧消化过程滞留在产酸阶段,从而导致反应器的酸化。笔者分析了由BES引起的厌氧酸化过程中反应器内CODCr去除率、pH以及VFA的变化,并着重研究了BES对ABR各隔室污泥中微生物群落结构及其演替特征的影响,以期为采用新型生物技术解决酸化问题提供借鉴。
1 材料与方法
1.1 装置与方法
试验装置为三隔室ABR厌氧反应器(图1),反应器总体积为9 L,设计水力停留时间为24 h,温度维持在(35±1)℃。试验采用模拟废水(CODCr∶N∶P=350∶5∶1),其中进水 CODCr为 2000 mg/L 左右。接种污泥取自闲置反应器中的厌氧颗粒污泥,接种量为3 L。BES投加在进水箱中,投加量从0 mmol/L逐渐提高到0.27 mmol/L。

图1 ABR处理工艺流程Fig.1 Schematic diagram of the anaerobic baffled reactor
1.2 分析方法
1.2.1 常规指标分析方法
CODCr采用重铬酸钾法测定;pH采用PH S-25型数显pH计测定;VFA采用气相色谱法测定。
1.2.2 荧光原位杂交技术(FISH)
污泥样品用4%多聚甲醛于4℃恒温固定过夜,再利用PBS和乙醇洗涤固定液于-20℃保存备用。利用超声打散样品,经预处理后,于46℃杂交2 h,DAPI染色,荧光抗淬灭封片剂封片,在Olympus BX51荧光显微镜下观察、拍照,每种微生物拍5~8组照片,通过Image-Pro-Plus软件对照片进行计数分析,最后取平均值,标准偏差为±0.1,FISH试验中采用的探针[10-13]如表1所示。
1.2.3 聚合酶链式反应-变性梯度凝胶电泳技术(PCR-DGGE)
采用Qiagen公司生产的离心式DNA快速提取试剂盒(Qiagen,美国)提取细菌的总DNA,提取到的总DNA采用1%的琼脂糖凝胶电泳进行检测。再将提取到的DNA进行PCR扩增,采用套式PCR技术,所用引物如表2所示。首先采用细菌通用的27F和1378R引物对总细菌16S rDNA进行扩增。第二轮PCR以第一轮PCR的产物作为模板,使用357F-GC和518R引物对总细菌16S rDNA V3区进行扩增。PCR产物用1%的琼脂糖凝胶电泳进行检测。

表1 试验所选用的探针类型Table 1 16S rRNA-targeted oligonucleotide probes used in this study

表2 PCR扩增中使用的引物Table 2 List of the primers used in PCR amplification
使用D-Code系统(Biorad,美国)对PCR扩增后的产物进行DGGE分离。DGGE电泳结果采用Genfinder(Invitrogen,美国)进行染色,并利用凝胶成像系统(Biorad GelDoc XR,美国)对染色后的DGGE结果进行观察、拍照。将含目的DNA条带的凝胶割下,放入200μL离心管中捣碎,再加入20μL超纯水(ddH2O),在4℃过夜溶解。取上清液进行PCR,引物采用357F和518R,将PCR产物送至上海生工测序中心进行 DNA片段序列测定,测序结果与NCBI基因文库(http://www.ncbi.nlm.nih.gov/blast/)的已知序列进行对比。
1.2.4 图谱解析方法
各样品间的相似度指数可用Dice指数(CS)表示[14],其计算公式:

式中,j为2个样品间共有条带数;a、b分别为2个样品各自条带数。
采用Shannonce-Wiener多样性指数(H')表征微生物种群多样性[15],其计算公式:

式中,pi=ni/N;ni为第i个条带的强度;N为所有条带强度之和。
采用种群丰富度指数(R)表征样品的微生物丰富度[16],其计算公式:
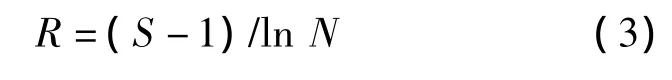
采用优势度指数(D)表征样品中优势种群的优势程度,其计算公式:

2 结果与分析
2.1 对CODCr、pH及VFA的影响
图2和图3为BES对ABR反应器中CODCr及pH的影响。由图2和图3可知,随着BES浓度的增加,反应器内 CODCr去除率及 pH急剧下降;当BES浓度为0.13 mmol/L时,CODCr去除率降到20%以下,出水pH降到6.0以下;当BES浓度增至0.2和0.27 mmol/L时,其去除率降到10%以下,出水pH降到5.5以下,ABR反应器出现了酸化。
VFA是污染物降解的中间产物,也是评估反应器正常运行与否的重要指标。BES对ABR反应器中VFA浓度的影响如图4所示。正常运行时,VFA浓度随着隔室的增加而减少,出水中只含有少量的乙酸和丙酸,浓度不超过40μmol/L。而废水中投加BES后,反应器内VFA浓度不仅不随着隔室的增加而减少,反而随着隔室的增加而增加,出水VFA浓度达到15.3 mmol/L左右;且VFA的种类有所增加,除了乙酸、丙酸之外,还有丁酸、异丁酸、戊酸、异戊酸、己酸、异己酸和庚酸,其中丁酸、戊酸、己酸等占36%左右。
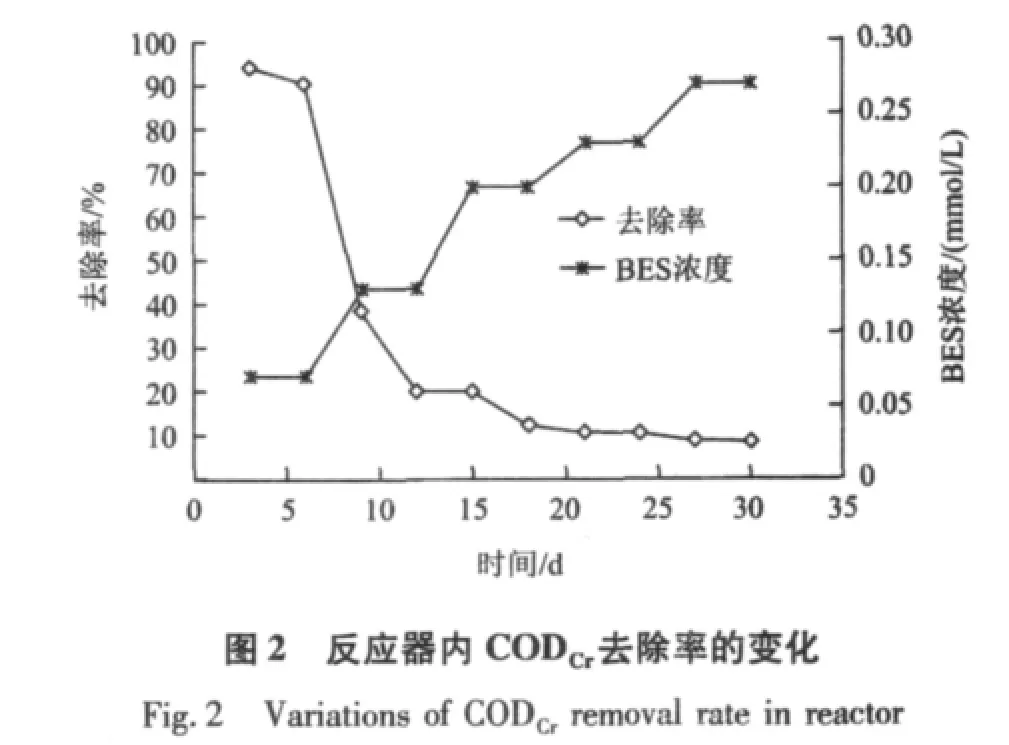
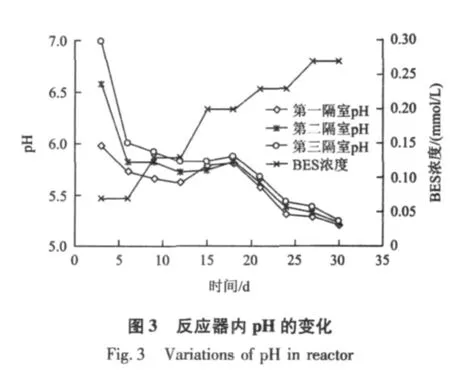
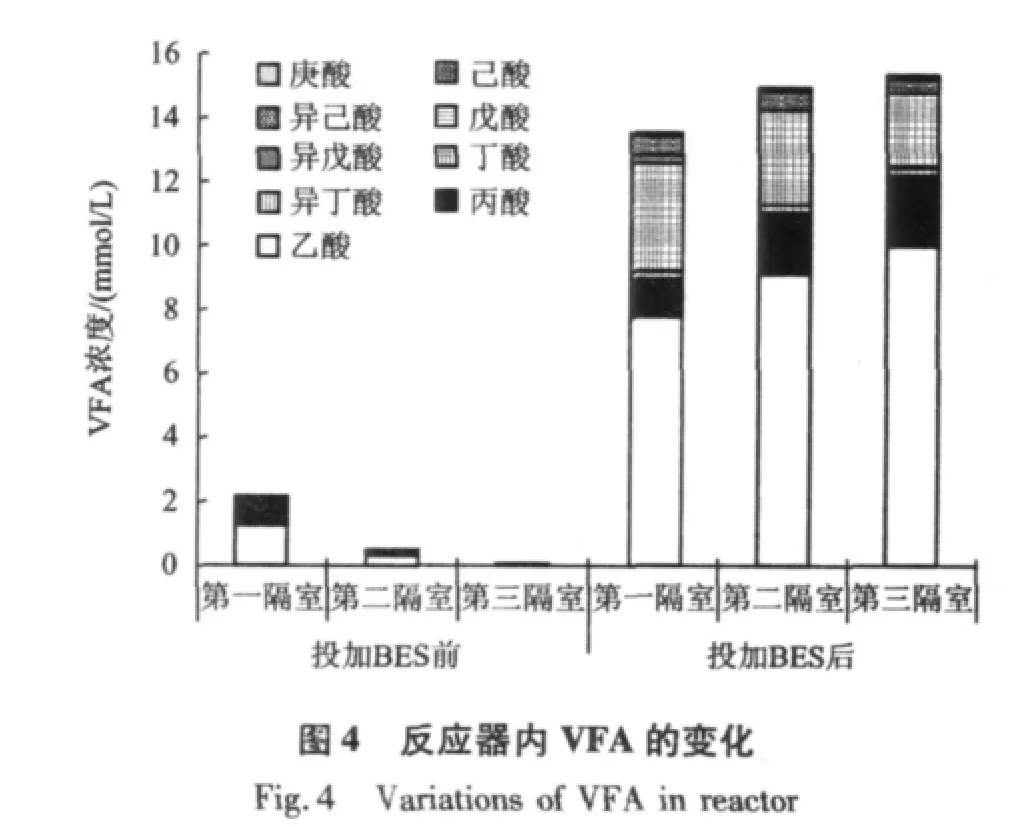
综合考虑CODCr去除率、pH及VFA浓度的变化可知,投加BES后,CODCr去除率急剧下降到10%以下,出水pH降到5.5以下,出水VFA浓度达到15.3 mmol/L左右,ABR反应器形成了酸化环境。这说明BES能抑制产甲烷菌产甲烷活性[9],导致VFA等中间产物无法转化为CH4等最终产物,造成VFA严重积累,从而导致CODCr去除率下降,反应器内的pH降低,VFA浓度增大及种类增多,最终导致ABR反应器酸化。
2.2 对微生物丰富度的影响
取投加BES运行稳定后污泥样品,利用FISH技术来表征BES对ABR反应器内真细菌、古细菌及典型微生物相对丰度的影响,结果如图5所示。由图5可知,投加BES之后,真细菌的相对丰度有所增加,平均增加了40%,真细菌里的典型微生物种群产氢产乙酸菌和耗氢产乙酸菌的相对丰度也有所增加,其中产氢产乙酸菌增加了9%,耗氢产乙酸菌增加了7%。而古细菌的相对丰度下降了30%,厌氧消化过程中最关键的产甲烷菌的相对丰度平均下降了25%左右。

图5 BES对ABR反应器内各种微生物相对丰度的影响Fig.5 Effect of2-bromoethane sulfonate on relative abundance of microorganisms in ABR reactor
由图5可知,BES对产甲烷菌具有强烈的抑制作用,由于BES抑制了产甲烷菌的活性,使产甲烷菌不能消耗VFA,进而造成了VFA的积累。VFA的积累会进一步抑制产甲烷菌的活性,造成恶性循环,因此产甲烷菌的相对丰度大大降低。产甲烷菌是ABR反应器中最主要的古细菌,其丰富度的降低造成古细菌的相对丰度大幅减少。
VFA的积累增加了产氢产乙酸菌所能利用的营养底物,促进了产氢产乙酸菌的生长繁殖,同时释放出更多的氢气,氢气的增加又会促进耗氢产乙酸菌的作用,刺激耗氢产乙酸菌的生长,因此产氢产乙酸菌和耗氢产乙酸的相对丰度都有很大程度的提高。
2.3 对真细菌种群结构的影响
2.3.1 DGGE指纹图谱、相似性与多样性分析
对ABR反应器正常运行及投加BES运行稳定后的各隔室污泥样品进行DNA提取,PCR扩增及DGGE分析,可得到真细菌的DGGE指纹图谱,如图6所示。
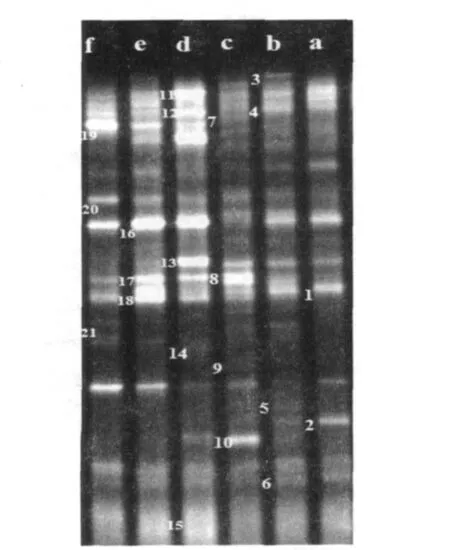
图6 投加BES前后ABR反应器内各隔室厌氧污泥的DGGE指纹图谱Fig.6 DGGE fingerprints patterns of anaerobic sludge in the compartments of ABR reactor
由图6可见,六个样品的DGGE条带数量有明显的差异,投加BES之后,DGGE条带数有所减少;并且不同污泥样品中的优势菌种结构发生了很大的改变。污泥样品的种群相似度(表3)均在75%以下,第一隔室的相似度为67.8%,第二隔室的相似度为74.2%,第三隔室的相似度仅为59.4%。在样品a中,Band1和Band2是正常运行时第一隔室的优势菌带,而在样品d中,除了Band1和Band2继续存在以外,增加了五条很亮的条带。对比b和e两个样品,样品e中有五条很亮的条带,而在样品b中有三种菌带虽然存在,但是亮度有所减弱,并且优势菌带不明显。样品c中的优势菌带为 Band8和Band10,在样品f中,Band8依然存在,但是亮度有所减弱,同时增加了四种优势菌带。

表3 污泥DGGE指纹图谱的相似度矩阵Table 3 Dice index comparing the similarity of DGGE fingerprints %
微生物种群多样性指数(H')、丰富度指数(R)和优势度指数(D)分别是从不同角度反映微生物种群类型、种群结构的差异以及种群演替的变化。各指数的计算结果见表4。由表4可知,投加BES之后,ABR反应器内各隔室的污泥样品的DGGE指纹图谱中条带数即微生物种数均有所减少,种群的多样性指数和丰富度也呈现出相似的变化特征。而投加BES之后,ABR反应器内的优势微生物的优势度明显增大。
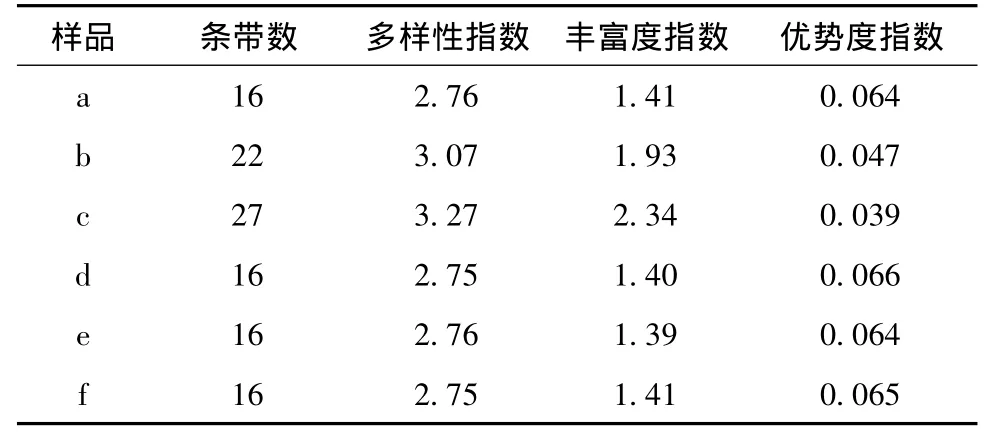
表4 投加BES前后ABR反应器内各隔室污泥中微生物种群多样性指数Table 4 Microbial community diversity index of anaerobic sludge in the compartments of ABR reactor
通过图6,表3和表4的比较可知,投加BES后,微生物种群结构发生了显著变化。首先,有一些对环境敏感的细菌死亡并消失,使得反应器内的真细菌种类有所减少,导致微生物种群多样性和丰富度相应减少,说明BES对ABR反应器内某些种类的细菌有很强的抑制作用。其次,ABR反应器内的优势微生物种类增多,并且优势度明显。这可能是因为微生物种群的自主驯化作用,投加BES后,经过一个月的驯化培养,诱发出适应BES的微生物,同时淘汰劣势微生物,因此优势微生物的数量增多,优势度提高。
2.3.2 部分优势菌种的鉴定
将目标微生物进行DNA片段序列测定,其测序结果与NCBI数据库中的已知菌种的序列进行比对,结果如表5所示。由表5可知,投加 BES后,ABR反应器各隔室的优势微生物均发生了很大改变。以第一隔室为例,ABR正常运行时的优势微生物与Uncultured bacterium clone cs78相似度为99%,属于Firmicutes(厚壁菌),与乳酸盐和硫酸盐的去除有关[17]。而投加BES后,优势微生物变为与 Uncultured bacterium clone 23-1、Uncultured rumen bacterium clone RDX_194-Control_0_hr、Uncultured bacterium SHA-116及Uncultured bacterium clone:OS-100相似。其中 Uncultured bacterium clone 23-1属于 Bacteroides(拟杆菌),与乙醇发酵有关[18];Uncultured rumen bacterium clone RDX_194 属于 Bacterium,与 1,3,5-trinitro-1,3,5-triazacyclohexane的转化有关;Uncultured bacterium SHA-116与氯的去除有关,属于Spirochaetes(螺旋体菌)[19];而 Uncultured bacterium clone:OS-100 是δ-proteobacteria(δ-变形菌),与乙酸盐或甲醇的同化有关[20]。

表5 部分优势细菌的克隆测序结果Table 5 Phylogenetics of dominant bacteria
通过优势细菌的测序结果可知,投加BES后,ABR反应器各隔室内的优势微生物种群发生了很大改变,第一隔室由厚壁菌门变为拟杆菌门、螺旋菌门及δ-变形菌门;第二隔室的优势微生物由拟杆菌门、厚壁菌门变为地杆菌科微生物、δ-变形菌门及厚壁菌门;第三隔室由杆菌属、厚壁菌门变为厚壁菌门及螺旋菌门。
3 结论
(1)随着进水中BES投加量从0 mmol/L增加到0.27 mmol/L,ABR反应器的 CODCr去除率从95%降到10%,且一直维持在10%以下,出水pH从6.0~7.0降到5.5以下。说明BES的投加对厌氧消化过程有很大的影响,容易导致反应器酸化。
(2)BES的投加,造成反应器内VFA明显积累,VFA浓度随着隔室的增加而增加,出水VFA浓度达到15.3 mmol/L左右;同时出水VFA组成由BES投加前的以乙酸、丙酸为主,变为乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸、己酸、异己酸和庚酸,其中丁酸、戊酸、己酸等占总VFA的36%。
(3)BES会抑制产甲烷菌的活性,从而使产甲烷菌的相对丰度平均降低25%左右。同时,BES使产氢产乙酸菌及耗氢产乙酸菌的相对丰度分别增加了9%和7%。
(4)投加BES后,ABR反应器各隔室的微生物种群结构发生了显著变化,其最低相似度仅为59.4%。BES的投加,使ABR中的微生物种类、种群多样性及丰富度均有所降低,微生物种类由二十几种降到十几种,种群多样性指数由3.27降到2.75;优势微生物种群由厚壁菌门、杆菌属变为拟杆菌门、螺旋菌门及δ-变形菌门。
[1]李清雪,王欣,刘书燕.ABR酸解及恢复过程中的特征研究[J].河北师范大学学报,2007,31(2):225-228.
[2]徐金兰,王志盈.关于ABR系统中酸解过程的特征及其恢复调控问题[J].环境科学学报,2004,21(1):20-26.
[3]刘然,彭剑峰,宋永会,等.厌氧折流板反应器酸化及其对微生物种群分布的影响[J].环境科学,2010,31(7):1555-1559.
[4]刘波,闫书,梁渠,等.绿色双子表面活性剂的合成研究进展[J].日用化学工业,2010,40(5):369-376.
[5]赵田红,胡星琪,赵法军,等.一种阴离子型双子表面活性剂的合成与表征[C]//2007(第六届)中国日用化学工业研讨会.太原:中国日用化学工业研究院,2007.
[6]陈洪龄,葛灵.磺基咪唑啉甜菜碱表面活性剂的合成和性能[J].化学世界,1999(1):19-21.
[7]彭国锋,蒋燕武,郭福军,等.阴离子型Gemini表面活性剂的合成与表征[J].精细石油化工进展,2007,8(5):50-53.
[8]贾卫红,宋湛谦,饶小平,等.松香基磺酸盐Gemini表面活性剂的合成和性能[J].石油化工,2009,38(6):651-655.
[9]RALF C,KLOSE M.Selective inhibition of reactions involved in methanogenesis and fatty acid production on rice roots[J].FEMS Microbial Ecology,2000,34(1):27-34.
[10]刘然,彭剑峰,宋永会,等.厌氧折流板反应器(ABR)中微生物种群演替特征[J].环境科学研究,2010,23(6):742-747.
[11]彭剑峰,宋永会,刘然,等.厌氧污泥颗粒化中微生态形成过程表征[J].环境科学,2011,32(7):2013-2018.
[12]左剑恶,杨洋,沈平,等.荧光原位杂交(FISH)技术厌氧颗粒污泥研究中的应用[J].中国沼气,2004,22(1):741-747.
[13]孙寓姣,左剑恶,邢薇,等.高效厌氧产甲烷颗粒污泥微生物多样性及定量化研究[J].环境科学,2006,27(11):111-123.
[14]WHITTAKER R H.Evolution and measurement of species diversity[J].Taxan,1972,21:213-251.
[15]GAFAN G P,LUCAS V S,ROBERTS G J,et al.Statistical anslyses of complex denaturing gradientgelelectrophoresis profiles[J].Journal of Clinical Microbiology,2005,43(8):3971-3978.
[16]STAMPER D M,WALCH M,JACOBS R N.Bacterial population changes in a membrane bioreaction for gray water treatment monitored by denaturing gradient gel electrophoretic analysis of 16S rRNA gene fragments[J].Applied and Environmental Microbiology,2003,69(2):852-860.
[17]ZHAO Y G,REN N Q,WANG A J.Contributions of fermentative acidogenic bacteria and sulfate-reducing bacteria to lactate degradation and sulfate reduction[J].Chemosphere ,2008,72(2):233-242.
[18]REN N Q,XING D F,ZHAO L H,et al.Microbial community structure of ethanol type fermentation in bio-hydrogen production[J].Environmental Microbiology,2007,9(5):1112-1125.
[19]SCHLÖTELBURG C,WINTZINGERODE C,HAUCK R,et al.Microbial structure of an anaerobic bioreactor population that continuously dechlorinates 1,2-dichloropropane[J].FEMS Microbiology Ecology,2002,39(3):229-237.
[20]OSAKA T,YOSHIE S,HIRATA A,etal.Identification of acetateor methanol-assimilating bacteria under nitrate-reducing conditions by stable-isotope probing[J].Microbial Ecology,2006,52(2):253-266. ▷

