尾叶桉杂种子代DNA提取和SSR引物筛选
李光友,徐建民,吴世军,杜志鹄,韩 超,王 伟,陆钊华,李宝琦
(中国林业科学研究院 热带林业研究所,广东 广州 510520)
尾叶桉杂种子代DNA提取和SSR引物筛选
李光友,徐建民,吴世军,杜志鹄,韩 超,王 伟,陆钊华,李宝琦
(中国林业科学研究院 热带林业研究所,广东 广州 510520)
以SSR分子标记法分析尾叶桉(Eucalyptus urophylla)及其杂种间关系,采用改良CTAB法提取总DNA,同时优化提取方法和PCR扩增条件。从文献中选取尾叶桉100对SSR引物中筛选出多态性高、稳定性好的17对引物作为实验尾叶桉杂种材料的SSR分析引物,为进一步对其进行遗传多样性和有效基因资源利用研究奠定基础和提供依据。
尾叶桉家系;DNA提取;SSR引物筛选
桉树系统引种和栽培在中国已开展20年多年,通过尾叶桉等的引种,在桉树遗传改良、资源保存及推广应用上取得重大进展[1]。尾叶桉具有速生、适应性广及多种用途的特点,通过引入其它具有速生、耐寒、耐旱、抗逆性强的优良桉树花粉,利用控制授粉技术获得更加优良的杂种子代。只有通过优树及其杂种子代的基础研究才会使尾叶桉杂种人工林获得更大发展,满足社会对于木材的巨大需求,以期获得更大的经济效益和社会效益。分子水平的研究,使杂种目的性状的获得具有不同于表型选择的稳定性和可靠性。
SSR标记因具有:整个基因组中随机分布;
多态性高;重复性好;技术难度低;引物序列公开发表等特点[2],而在动植物的遗传分析[3-5]中得到了广泛应用,随后林学专家开展了该标记在林木研究中的利用[6-7]。SSR的共显性标记适用于QTL定位研究,便于对有关QTL的遗传动态跟踪,增强对数量性状的遗传操纵能力,提高育种中数量性状位点判读的准确性以加速利用。在育种工作中,SSR技术与现有育种程序相结合,为尾叶桉的分子辅助选择和遗传改良提供了科学依据,促进目的基因的定位和选择、为其有效利用提供技术和材料保证,从而加快育种进程。
1 材料和方法
1.1 材料
实验用尾叶桉家系来自课题早期引种种子园。具体参试种源及家系来源见表1。不同家系随机取样,不同个体分别登记,共151株。每株取其幼嫩叶片,擦拭干净低温保存。注入与未注入家系间关系及研究方法参见文献[8]。

表1 参试桉树种批原产地及家系编号Table 1 Seeds sources of seed-lots and numbers of families used in the trial
PCR过程中用于实验筛选的100引物引自文献[9],由上海生工生物技术有限公司合成,同时实验用Taq酶、dNTPs、Loading buffer及 Maker等均购自该公司。
1.2 方法
1.2.1 DNA的提取和浓度确定[10-11]
采用改进CTAB法提取的桉树进行DNA提取。取适量叶碎样于2 mL磨样管中,加入钢珠;在球磨仪上磨3.5 min,24次/秒,P1模式;加入1 mL CTAB液(含2%B-巯基乙醇),65 ℃水浴45 min,需数分钟1次震荡;离心10 min,12 000 r·min-1;取上清于1 mL新管中,200 μL枪头,然后各管中加入等体积氯仿-异戊醇液(24∶1, v/v);离心10 min,取上清于新管中,加入550 μL氯仿-异戊醇液;离心10分钟,再取上清于新管中,加入4 ℃异丙醇约400 μL沉淀;-20 ℃冰箱冰冻10 h以上;取出解冻,离心10 min,倒上清,吸干;加入75%酒精1 mL洗涤洗3次,然后吸干;重复本步骤;45 ℃下干燥机内干燥5 min;加入1×TE150 μL,离心10 min,将上清移至新管中,管中液体即为含有DNA的样品;
提取后对DNA浓度检测。每样品取2 μL加4 μL Loading buffer,移液枪混匀后用1%琼脂糖凝胶电泳。以100 bp plus的DNA Ladder标定,初步判定2 μL样中所含DNA量,然后根据检测浓度将提取各DNA样稀释成相同的实验浓度,供PCR扩增时采用。
1.2.2 引物筛选[12]具体步骤:
(1) 以2个母本DNA进行条件优化(采用第6对引物来进行,98 bp)进行32次初筛;(2) 在初筛获得的优化条件,以该2母本及其子代进行复筛,各进行多次重复实验,选择扩增效果好的引物。最终从尾叶桉100对SSR引物中筛选出适合本批次样品的17对引物用于全部样品扩增和SSR分析(见表2)。

表2 尾叶桉SSR分子标记用引物序列及退火温度Table 2 The primer sequence and annealing temperature for SSR of Eucalyptus urophylla
1.2.3 PCR扩 增PCR扩 增 反 应 在AB 2720 Thermal Cycler上完成。
对Mg2+、Taq酶、dNTPs及模板浓度条件的多次优化和筛选,同时每次PCR做一个负对照来检测试剂是否污染。反应在灭菌的0.2 mL薄壁离心管中和PCR扩增仪上进行。反应体系采用10 μL反应体系,即10 × buf fer1.0 μL、25 mM MgCl20.6 μL、l0 mM dNTPs 0.30 μL、Primer 0.4 μL、5UTaq DNA聚合酶0.1 μL和2.0 μL DNA模板4 ng,最终加ddH2O至Total10 μL。样品94 ℃预变性 4 min;94 ℃变性 30 s,56 ℃退火 30 s,72 ℃延伸1 min,进行30个循环;然后72 ℃延伸10 min,最后在4 ℃条件下保存扩增样品。反应步骤:
1)tt冰浴中每反应管中加人2.0 u1DNA模板;
2)按以上建立反应体系取反应物依次装入1灭菌1.5 mL离心管中,涡旋2~3 s;
3)取上述混合物10.0 μL,分别加人0.2 mL反应管中,使每管的总反应体积为10.0 μL;
4)将装有反应液的离心管在台式涡旋机上涡旋 2~3 s;
5)混匀好的离心管放人台式离心机内离心5~6 s,取出后离心管盖盖;
6)离心管置于PCR仪上扩增,结束后,样品管4 ℃冰箱保存。
1.2.4 PCR产物检测
PCR反应结束后,通过1.2%琼脂糖凝胶电泳进行PCR结果检测。
1)配制足够量的电泳缓冲液(0.5×TBE),倒入电泳槽中备用;现配1.2%的琼脂糖凝胶;
2)凝胶稍凉后加入鼎国生物GoldviewTM牌Nucleic Acid Stain染料(5 μL/100 mL),轻轻摇匀;
3)将制胶模具置于水平板上,调水平,两端用封口胶封住;
4)常温下置胶于60 ℃时,倒入模具内,约3~5 mm厚,然后迅速在模具一端安插上梳子;
5)室温冷却待琼脂糖凝胶全部凝固,轻拔出梳子,并移去挡板;
6) 用移液枪混匀样品,点样品于凝胶孔内(每孔含扩增样2 μL和4 μL溴酚蓝),样品按顺序点入,同时点入北京鼎国生产的DGL 2000 DNA Marker(100~2000 bP )用于比对;
7)将有样品的一端置于电泳槽负极端,电泳液没过琼脂糖凝胶l mm左右,电泳电压为105 V;
8)电泳结束后,将凝胶平铺在凝胶成像仪内,打开紫外灯,检测扩增结果并记录。
1.2.5 银染法检测扩增结果的程序
1)对琼脂糖凝胶电泳检测能获得引物专一和扩增清晰的样品,进行银染法检测;
2)PAGE胶的制备
玻璃板的清洗。用水洗净,垂直晾干;水平放置玻璃板+无水乙醇擦1次;凹板玻璃用剥离硅烷清洗、纸巾涂匀,4~5 min后95%乙醇擦2~3次;平板玻璃以2.0 mL乙醇+50 μL亲合硅烷涂匀,3~5 min后纸吸去多余亲合硅烷。后组装玻璃面加上侧边密封条并灌胶;
灌胶。90 mL6%的变性聚丙烯酰胺中加入TEMED30 μL、10%过硫酸铵(0.1 g溶于水,现配)800 μL,在平稳玻璃面上匀速倾倒胶,同时扶住凹板玻璃往上扣下,匀速无泡且防胶漏,待胶流动均匀布满玻璃面后,夹好两块吻合玻璃,在灌胶口倒插入梳子,聚合5 min至胶凝固,后取出梳子,再正向插入梳齿,形成各样孔间密封的点样孔;
3)电泳
灌装1×TBE电泳液于上下槽中,竖胶版于电泳槽内。70 W恒功率预电泳15 min。断电条件下点样,点样时的Maker为Bio BASIC Inc.生产的 GM345 DNA Marker (50~1000 bP 1adder-H2)。
每样孔加6 μL预变性的PCR扩增混合样品(扩增产物与指示剂按10:3,指示剂为甲酰胺+溴酚兰),70 W恒功率电泳90 min(50~300 bp扩增产物),电泳结束后,用刀片分开两块玻璃板,胶会紧贴在涂有binding Silane 的平板玻璃上。
4)银染
过程:银染(胶板置入染色液中,轻轻摇动并淹没板面10~15 min)-冲洗(用2 000 ml去离子水冲洗胶板3~5 min)-显影(胶板快速转移到1 600 mL显影液中并轻轻摇动,直到谱带出现)-冲洗(用去离子水或自来水冲洗3~4 min,洗掉其上的碱性物质)-干燥:室温下晾干,长期保存。
5)判读,分析
采用上海小源科技有限公司小源凝胶图像分析系统对所拍图片判读或对银染片直接判读统计。运用POPGENE Version 1.32[13]软件进行不同家系/个体间相互关系的数据分析。
2 结果与分析
2.1 DNA提取方法的优化
DNA质量的好坏直接关系到实验的成败。为了得到高质量的基因组DNA,试验中对常规CTAB法进行改良,增加了2%β-巯基乙醇和DNA材料多次异丙醇沉淀离心、乙醇洗浴和TE溶液溶解的步骤洗去杂质,获得了较高质量和浓度的DNA (图1),从而满足实验所需。

图1 两批次各30个个体DNA浓度检测(M-100bp plus DNA ladder, Lane1-30:样本DNA)Fig. 1 The total DNA was extracted from 30 samples of Eucalyptus urophylla
从图1看出,第1批30个样中,除16号浓度稍低外,其它样品DNA几乎均高于标准DNA(M);第2批样品中16、22号DNA浓度低于标准浓度。2批次结果表明16号样品需要重新提取DNA。
2.2 扩增条件的优化
通过正交设计和重复试验,在反应体系中以不同浓度的MgCl2、dNTP、模板DNA配比,并以文献给定46~64 ℃的退火温度处理,研究不同因素组合对扩增产物的影响。结果表明在退火温度给定的情况下扩增关键在于Taq酶浓度、引物浓度以及Mg2+浓度,这与王润辉等[14]对松树杂种SSR反应条件的优化所得结论一致。
2.3 SSR引物的筛选
,获得本次实验所需的SSR引物。尽管在PCR过程省去对退火温度的优化,但并非所有现成引物均能扩增产物和产生清晰条带。另外参试家系通过人工杂交,其子代亲缘关系较近,因此具有不同于相同引物对天然群体的扩增效果。因此本研究利用尾叶桉的SSR标记,从100对引物中筛选合适的引物,进行扩增,在淘汰了无扩增带和扩增后多态性不理想的引物,选留那些扩增条带清晰而且有明显多态性片段的引物。最终获得适用于尾叶桉杂种子代研究的17对引物(表2)。
2.4 同一引物不同样品的扩增效果
对尾叶桉进行了17对引物的扩增和效果检验,其中3对引物的结果见图2。
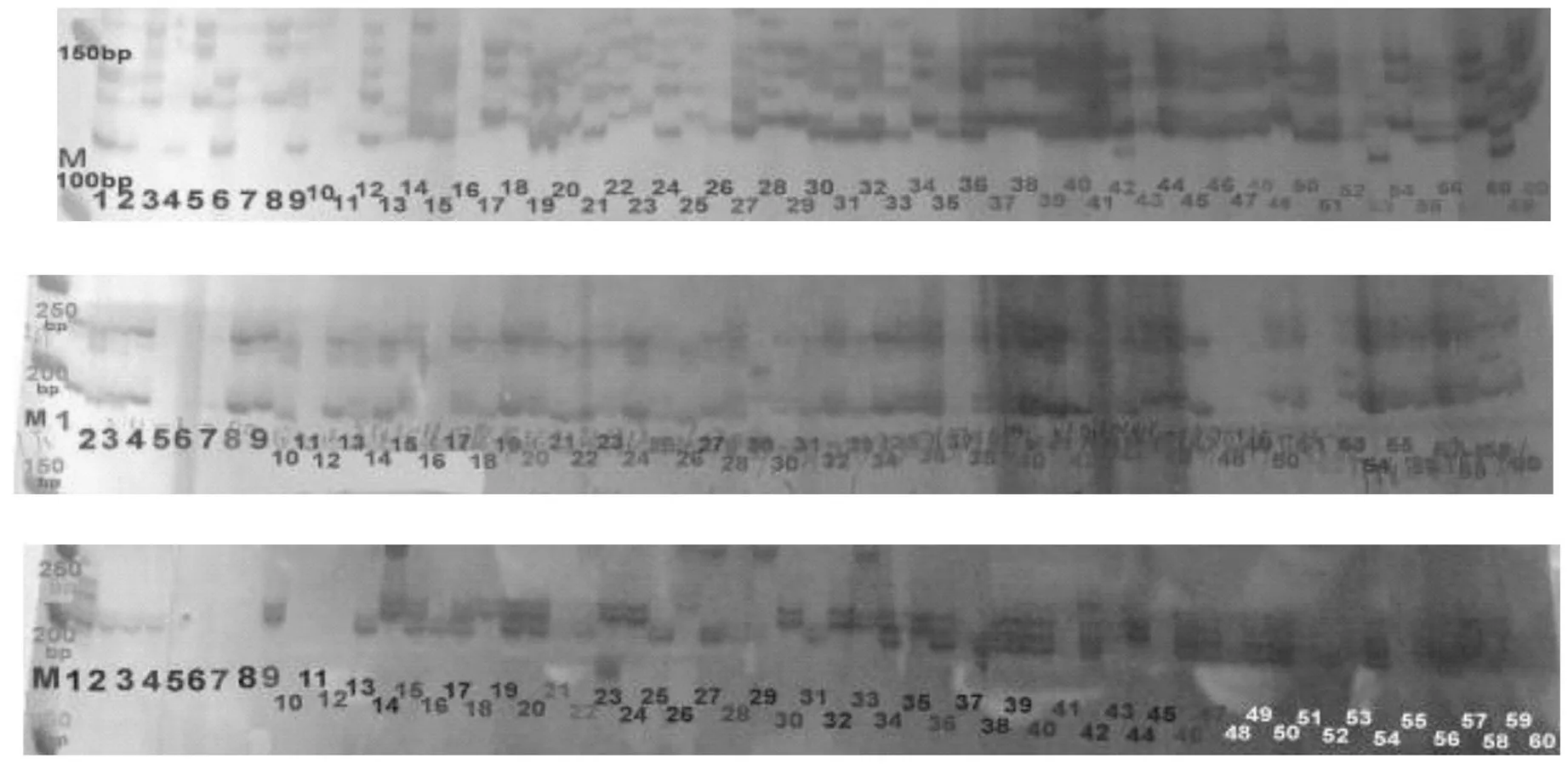
图2 3对SSR引物在尾叶桉不同个体中扩增出的多态图谱Fig. 2 SSR polymorphism in E. urophylla hybrids with EMBRA23, EMBRA44 and EMBRA59
图2为3对SSR引物对部分尾叶桉杂种个体的PCR扩增后经PAGE胶电泳后的多态图谱,不同个体间扩增出差异性条带,个体间表现出差异和等位基因的分离,多态性明显。
3 讨 论
在现实遗传标记技术中,通过建立、筛选基因组文库,克隆测序、引物设计等一系列实验,获得可靠且用于生产实践的SSR分子标记,需要投入大量人力、物力。随着参与人员和研究方法的增多、互联网资源共享,使更有效、更深入的技术研究获得成效,实用性和目的性更强,实现着微观指导宏观的现实目标。本实验利用已有文献中的尾叶桉SSR引物中筛选出适合尾叶桉人工杂种使用的17对引物,实现多态性和稳定性扩增,达到对近亲群体的进一步研究和利用。从扩增图谱上看,引物对部分家系材料进行了扩增,每个样品基本上都获得清晰的扩增条带,多态位点较多。实验过程中所选的材料包括了尾叶桉自由或控制授粉全同胞或半同胞家系,具有一定的代表性,建立的尾叶桉人工杂种子代SSR扩增体系,为进一步研究亲缘关系较近群体的遗传多样性奠定了基础。目前国内对尾叶桉遗传多样性、从DNA水平揭示尾叶桉遗传资源方面的研究文献[15-16]较少。国外为保障育种项目的长期遗传增益而进行了尾叶桉育种群体遗传多样性研究[17-18]。今后为保障桉树育种工作的有效和持续进行,需要利用分子标记对天然杂交种的鉴定,繁育系统的研究,和目的基因定位。本研究也为尾叶桉人工杂种研究提供了SSR分子标记引物。随着对尾叶桉杂种进一步开发利用和研究,SSR分子标记将应用于尾叶桉杂种子代优良无性系品种鉴定、遗传分析、遗传图谱建立、分类研究、目的基因应用以及种质资源鉴定等各个领域。
利用文献获得100对尾叶桉SSR分析的引物中,仅17对引物产生较好扩增效果和多态性扩增产物,可能与入选的人工控制授粉家系各个体间亲缘关系较近有关,今后需进一步深入研究。
参考文献:
[1] 白嘉雨.桉树遗传育种的回顾及发展前景[J].广西林业科学,35(4):221-226.
[2] 王红梅,张正英,陈玉梁.SSR标记技术及其在植物遗传学中的应用[J].西北师范大学学报,2003,39(1):113-116.
[3] Dib C. A comprehensive genetic map of the human genome based on 5264 microsatellites [J].Nature, 1996, 380:152-154.
[4] Taramino G. Simple sequence repeats for germplasm analysis and mapping in maize[J].Genome, 1996,39: 277-287.
[5] Guiford P, Prakash S, Zhu J M, et al. Microsatellites in Malusхdomestica (apple): abundance, polymorphism and cultivar identification[J].Theor Appl Genet, 1997,94: 249-254.
[6] 徐立安,李新军,潘惠新,等.用SSR研究栲树群体遗传结构[J]. 植物学报,2001,43(4):409-412.
[7] 郑 健,郑勇奇,张川红,等.花楸树天然群体的遗传多样性研究[J].生物多样性,2008,16(6):562-569.
[8] 李光友,徐建民,白嘉雨,等.离子注入对桉树萌发及苗期生长的影响[J].中南林业科技大学学报,2007,27(5):44-48.
[9] Brondani R P V, Williams E R, Brondani C,et al. A microsatellitebased consensus linkage map for species of Eucalyptus and a novel set of 230 microsatellite markers for the genus[J]. BMC Plant Biology, 2006, 6:20doi:10.1186/1471-2229-6-20.
[10] 郭 勇.利用EST-CAPS标记构建桉树遗传图谱[D].中国林科院硕士论文,2008.
[11] 李志辉,庞 统,杨模华.桉属植物叶片DNA抽提[J].经济林研究,2005,21(2):5-7.
[12] 王艳敏,魏志刚,杨传平.白桦EST-SSR信息分析与标记的开发[J].林业科学,2008,44(2):78-84.
[13] Yeh F C, Yang R C, Boyle T POPGENE. The User-Friendly Shareware for Population Genetic Analysis[M]. Molecular Biology and Biotechnology Centre, Universityof Alberta,Edomonton, Canada,1997.
[14] 王润辉,赵奋成.湿地松、加勒比松及其杂交种DNA的提取与微卫星PCR反应体系的优化[J].广东林业科技,2006,22(1):1-4.
[15] 甘四明,施季森,白嘉雨,等. RAPD标记在桉属种间杂交一代的分离方式研究,林业科学研究, 2001,14(2):125-130.
[16] 甘四明,白嘉雨,吴坤明,等.7个桉树杂交亲本RAPD位点多态性和杂合性的研究[J].林业科学, 2003,39(2):162-167.
[17] Gaioto F A, Bramucci M, Grattapaglia D. Estimation of outcrossing rate in a breeding population of Eucalyptus urophylla using dominant RAPD and AFLP markers [J].Theor. Appl Genet.,1997,95:842-849.
[18] Leite S M, Bonine C A, Mori E S, et al.Genetic variability in a breeding population of Eucalyptus urophylla[J].Silvae Genet,2002,51: 5-6.
DNA extracting and SSR primer screening of Eucalyptus hybrids
LI Guang-you, XU Jian-min, WU Shi-jun, DU Zhi-hu, HAN Chao, WANG Wei, LU Zhao-hua, LI Bao-qi
(Research Institute of Tropical Forestry, CAF, Guangzhou 510520,Guangdong,China)
The total DNA of Eucalyptus urophylla and the hybrids were analyzed using SSR markers. The total DNA was eхtracted by means of improved CTAB isolation method, the eхtraction methods and PCR amplification conditions were optimized. 17 primers were screened from 100 primers which were from a published-article eхisting in Eucalyptus urophylla, which had high polymorphism and stability. The results provide references for genetic diversity research of Eucalyptus urophylla families and single tree using SSR marker.
Eucalyptus urophylla; DNA eхtraction; SSR primer screening
S792.39
A
1673-923X(2012)02-0081-05
2011-09-15
十二五“高产抗逆桉树”新品种的选育研究(2012BAD01B04-1);广东省林业科技创新项目(2009KJCX004-02);广东省林业标准化(2009-BS01);国家科技成果推广项目“桉树速生丰产地力维持与可持续经营技术推广示范”;国家公益行业专项(201104003)
李光友(1970—),男,重庆开县人,副研究员,博士,主要从事热带林木遗传育种研究;E-mail: rwater3000@sohu.com
[本文编校:文凤鸣]

