高静压处理对花生蛋白的改性研究
周婷婷,吕茜,张玉玉,宋弋,李娟,杨瑞学,李全宏,*
(1.中国农业大学食品科学与营养工程学院,北京100083;2.中国农业机械化科学研究院,北京100083)
花生蛋白质主要由花生球蛋白和伴花生球蛋白组成,其中花生球蛋白占63%,伴花生球蛋白占33%,是一种高营养的植物蛋白资源[1]。花生蛋白应用于食品行业,最重要的方面是利用其功能性质。花生蛋白的功能特性是指花生蛋白在加工、处理、贮藏制备和消费过程中影响蛋白质在食品体系中应用的某些物理、化学特性的总称[2],包括溶解性、乳化性、发泡性等。然而天然花生蛋白的功能性质无法满足食品加工的需要,因此,对花生蛋白深度的开发离不开花生蛋白改性的研究。
高静压技术(High Hydrostatic Pressure,HHP),是能改善食品功能性质的一种新型食品加工技术。高压加工可引起蛋白质等生物高聚物结构和反应活性的复杂变化,但对食品的营养物质、天然风味和色泽的破坏极小,从而可以生产出高品质的产品[3]。目前超高压对蛋白的改性研究主要集中于大豆蛋白[4-5],对花生蛋白的改性研究较少。
本文以花生分离蛋白及花生蛋白中含量较多的组分花生球蛋白为实验材料,研究了高静压处理对花生分离蛋白、花生球蛋白的溶解性、乳化性、表面疏水性 巯基含量等性质的影响,为花生蛋白的深度加工利用提供依据。
1 材料与方法
1.1 材料与试剂
低温冷榨花生粕(市售),粉碎后过60 目筛,水分7.4%,蛋白质40.4%,灰分4.49%;大豆精制油:福临门有限公司;其它试剂均为分析纯。
1.2 仪器
TGL-16A 台式高速冷冻离心机:长沙平凡仪器仪表有限公司;2802 紫外可见分光光度计尤尼科:上海仪器有限公司;Cary Eclipse 荧光分光光度计:美国Varian 公司;HHP-650 高静压设备:包头科发高压科技有限公司;LGJ-12 冷冻干燥机:北京松源华兴科技公司;DK-98-1 型电热恒温水浴锅:上海精宏精密实验设备有限公司。
1.3 方法
1.3.1 花生分离蛋白、花生球蛋白的制备
将低温冷榨花生粕粉碎过60 目筛,与正己烷以1 ∶5 体积比混合,室温下连续搅拌脱脂1 h,静置沉降分层,倾出有机溶剂后重复上述步骤,室温下通风干燥12 h 得脱脂花生粉。
采用碱溶酸沉法[6]提取花生分离蛋白,取脱脂花生粉,按1 ∶9(质量比)比例加水后升温至60 ℃,在搅拌条件下用氢氧化钠溶液调节pH 至9.0,浸提1.5 h,离心后取沉淀进行二次提取,合并上清液,用盐酸调整pH 至4.5,离心取沉淀,中和pH 至7.0,透析,冷冻干燥得花生分离蛋白(PPI)。
花生球蛋白的提取参照文献[7]的等电点沉淀法,将5 g 脱脂花生粉加入0.03 mol/L Tris-HCl(pH8.5)缓冲液中,45 ℃搅拌提取1 h,9 000 r/min 冷冻离心30 min,取沉淀以相同条件进行二次提取,合并两次上清液,加入亚硫酸氢钠至0.01 mol/L,调pH 至6.4,4 ℃冷沉过夜。6 500 r/min 4 ℃离心20 min,将沉淀溶解,中和pH 至7.0,透析,冷冻干燥得花生球蛋白。
1.3.2 蛋白溶液的高静压处理
将2 g 花生分离蛋白、花生球蛋白分别溶解于0.03 mol/L Tris-HCl 缓冲液中,调节pH 至7.5。室温下搅拌30 min,使蛋白充分溶解。然后将蛋白溶液真空密封于聚乙烯塑料袋中(不留气泡),放于压力容器内腔,并浸没于传压介质中,进行高静压处理,设定压力水平分别为(300±10)、(400±10)、(500±10)、(600±10)MPa,常温保压20 min。压力处理后的样品冷冻干燥处理,以备后续实验。
1.3.3 蛋白溶液的配制
取适量冷冻干燥的未处理和超高压处理过的花生分离蛋白、花生球蛋白粉分别溶于0.03 mol/L Tris-HCl 缓冲液中,调节pH 至7.5,室温下搅拌30 min,使蛋白充分溶解。
1.3.4 蛋白质溶解性测定
取适量蛋白溶液于10 000 r/min,4 ℃下离心10 min,以福林-酚法[8]测定上清及总蛋白含量。蛋白质的氮溶指数NSI(%)按下式计算:

1.3.5 乳化性和乳化稳定性的测定方法[9]
使用5 mL 大豆精制油和15 mL 蛋白溶液制备乳状液,在高速组织捣碎机中均质,10 000 r/min 处理5 min,而后迅速从乳状液底部取出50 μL 乳浊液,用5 mL 0.1%SDS 溶液稀释,在微型旋涡混合仪上混匀后取少量稀释样品于500 nm 下测定吸光度A0。10 min后再取50 μL 样品用5 mL 0.1%的SDS 溶液稀释,并测定500 nm 处吸光度A10。乳化性和乳化稳定性分别用EAI 和ESI 表示。
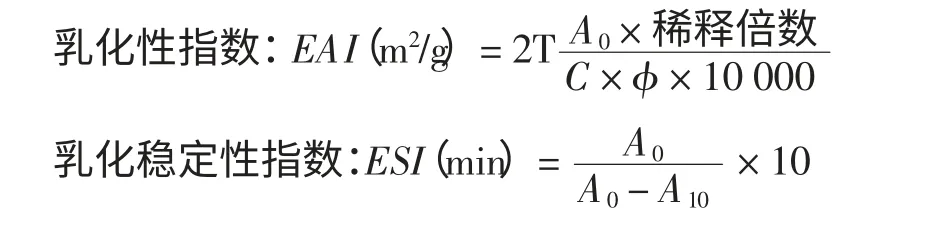
式中:C 为蛋白浓度,(g/mL);T=2.303;φ=0.25;稀释倍数为1 000。
1.3.6 蛋白质表面疏水性测定
表面疏水性采用ANS(8-苯胺基-1-萘磺酸)荧光探针法进行测定[10]。使用0.03 mol/L pH7.5Tris-HCl 缓冲液将两种花生蛋白溶液的蛋白浓度分别稀释至0.05 mg/mL~0.8 mg/mL。取不同浓度稀释样品2 mL,在390 nm 的激发波长和470 nm 的发射波长下分别测定样品的荧光强度(FI0)和样品加入10 μL ANS 溶液(8 mmol/L)后的荧光强度(FI1),FI1和FI0的差值记为FI,以蛋白质浓度为横坐标,FI 为纵坐标作图,曲线的初始阶段的斜率即蛋白质分子的表面疏水性指数,记为S0。相对表面疏水性指数RS0(%)计算公式如下:
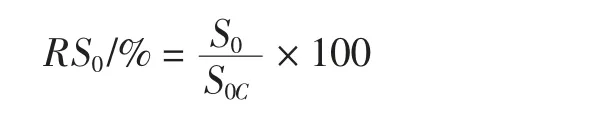
式中:S0C为未处理样品的表面疏水性指数。
1.3.7 游离巯基含量的测定[11]
取未处理和超高压处理过的花生蛋白溶液0.5 mL,加入4.5 mLTris-甘氨酸标准缓冲溶液(pH=8.0,含0.01 mol/L EDTA),混匀后于40 ℃恒温水浴中保温30 min,然后加入125 μL Ellman 试剂,混匀后于20 ℃恒温水浴中保温 ,用紫外分光光度计在波长下测定吸光值A412。游离巯基含量可通过下式计算得出:

式中:D 为稀释倍数;13600 为摩尔吸光系数,[L/(mol·cm)];C 为样品中蛋白质含量,(mg/mL)。
2 结果与分析
2.1 高静压处理对花生分离蛋白、花生球蛋白溶解性的影响
超高压处理可以破坏蛋白质的氢键、静电相互作用和疏水作用等非共价键作用,从而影响蛋白质的水合性质,使得溶解度发生变化[12]。高静压处理对花生分离蛋白、花生球蛋白溶解性的影响,见图1、图2。
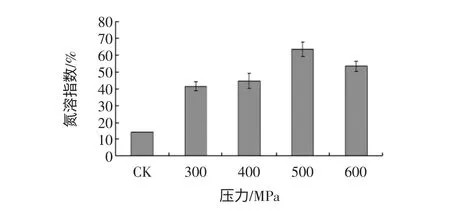
图1 高静压处理对花生分离蛋白溶解性的影响Fig.1 The effect of HHP on solubility of PPI
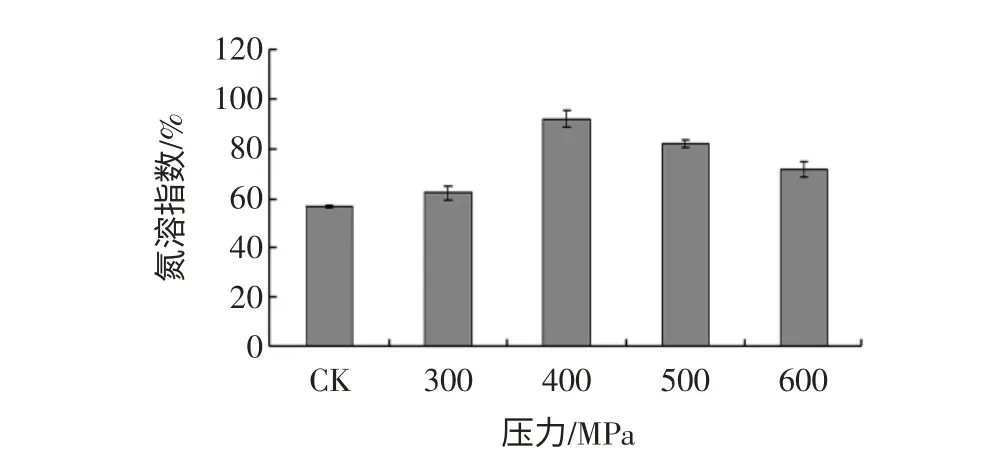
图2 高静压处理对花生球蛋白溶解性的影响Fig.2 The effect of HHP on solubility of peanut globulins
由图1、图2 可知,高静压处理对花生分离蛋白和花生球蛋白的溶解度产生了显著影响,两者氮溶指数的最高值分别比未处理蛋白的提高了约3.5 倍和1倍,但花生分离蛋白和花生球蛋白的溶解性变化趋势略有不同。在0.1 MPa~400 MPa 范围内,两种蛋白质的溶解度均随着压力升高而变大,且花生球蛋白的溶解度在400 MPa 时达到最大值,在此范围内超高压处理使凝聚球状蛋白质松散和伸展,与水作用的极性基团或离子基团增多,蛋白水化增强,使蛋白溶解性增大。400 MPa~600 MPa 范围内花生分离蛋白的溶解度先增大后减少,在 处达到最大,花生球蛋白的溶解性则随着压力的增大而减少,在较高压力下,蛋白质疏水基团和巯基暴露出来,形成不可溶聚集体,从而使蛋白质的溶解度下降。由于两者的蛋白组成、结构稳定性不同,溶解度从而呈现出不同的趋势。
2.2 高静压处理对花生分离蛋白、花生球蛋白乳化性及乳化稳定性的影响
高静压处理对花生分离蛋白、花生球蛋白乳化性及乳化稳定性的影响,见图3、图4。

图3 高静压处理对花生分离蛋白乳化性及乳化稳定性的影响Fig.3 The effect of HHP on emulsifying activity and stability of PPI

图4 高静压处理对花生球蛋白乳化性及乳化稳定性的影响Fig.4 The effect of HHP on emulsifying activity and stability of Peanut globulins
由图3、图4 可以看出,高静压处理对花生分离蛋白和花生球蛋白的乳化性产生了显著影响,两者乳化性指数的最高值分别比未处理蛋白的提高了1.5 倍和4 倍,但花生分离蛋白和花生球蛋白的乳化性变化趋势略有不同,乳化稳定性均呈下降趋势。在0.1 MPa~400 MPa 范围内,两种蛋白质的乳化性均随着压力升高而变大,且花生分离蛋白的乳化性在400 MPa 时达到最大值,在此范围内蛋白经超高压处理后,分子伸展,与水作用的极性基团或离子基团增多,亲水性增加;另一方面,超高压也会使蛋白分子内部的疏水基暴露出来,亲油性增加,两者达到较好的平衡,乳化性能得到提高[13]。花生分离蛋白的乳化性则随着压力的增大而减少,其原因在于两者组成不同,降低油-水界面表面张力的能力大小有所区别,当蛋白受到的压力过大时,亲油 亲水的平衡被打破,蛋白质的乳化性能则下降。
2.3 高静压处理对花生分离蛋白、花生球蛋白表面疏水性的影响
高静压处理对花生分离蛋白、花生球蛋白表面疏水性的影响,见图5、图6。
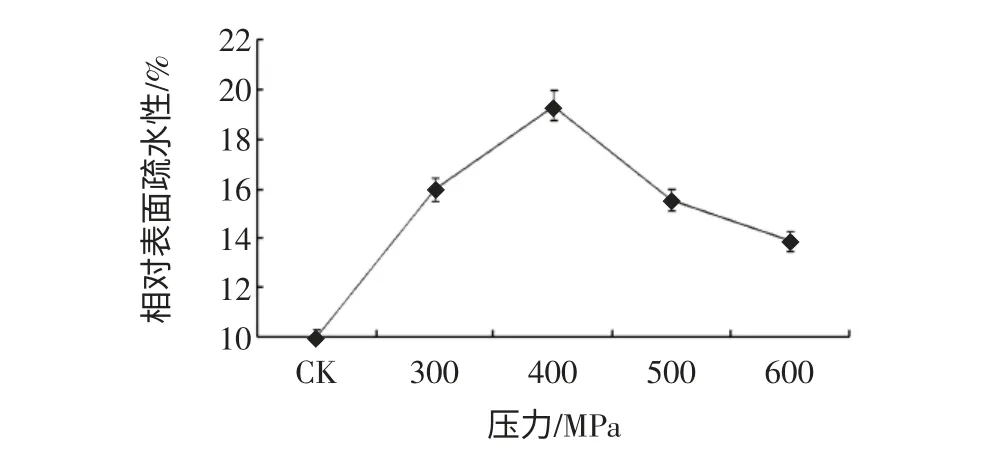
图5 高静压处理对花生分离蛋白表面疏水性的影响Fig.5 The effect of HHP on surface hydrophobicity of PPI
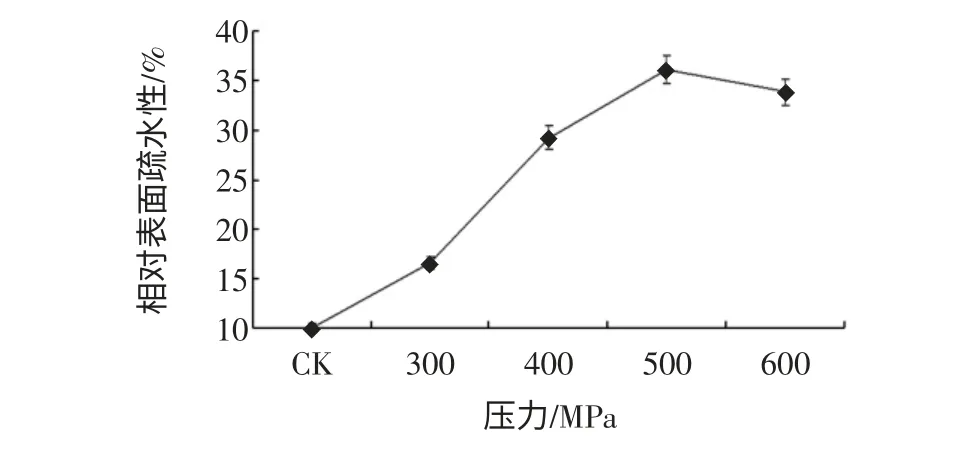
图6 高静压处理对花生球蛋白表面疏水性的影响Fig.6 The effect of HHP on surface hydrophobicity of peanut globulins
由图5、图6 可以看出,高静压处理导致花生分离蛋白、花生球蛋白表面疏水性大幅度上升,花生分离蛋白在400 MPa 时达到最高,400 MPa 以上处理表面疏水性略有下降,花生球蛋白则在500 MPa 时达到最高。这是因为超高压处理可以破坏分子内弱的氢键和静电相互作用等非共价键,使蛋白分子展开,导致内部疏水基团暴露至分子表面。对比图3、图4 可以发现,乳化性的变化与表面疏水性的变化一致,说明表面疏水性与蛋白的功能性质如乳化性等存在一定的正相关,与大多数的研究结果一致。
2.4 高静压处理对花生分离蛋白、花生球蛋白游离巯基含量的影响
高静压处理对花生分离蛋白、花生球蛋白游离巯基含量的影响,见图7、图8。由图7 可知,花生蛋白游离巯基的含量随着压力的升高呈现先上升后下降的趋势,在300MPa 处取得最大值;由图8 可知,花生球蛋白游离巯基含量随着压力上升而下降,但差异不显著。可能是压力较小时,蛋白凝聚水平低,SH 较稳定,压力升高引起了蛋白结构的展开,同时分子间发生SH/S-S 的交换反应,形成新的二硫键,使游离巯基含量下降。
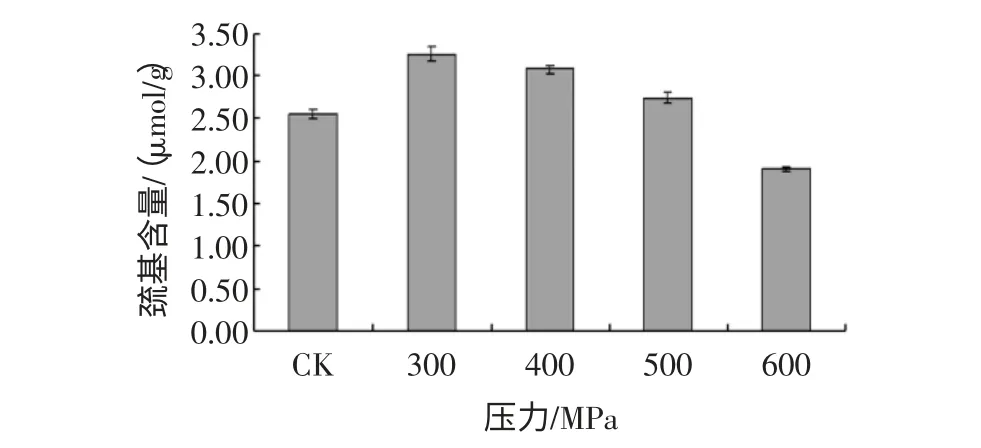
图7 高静压处理对花生分离蛋白巯基含量的影响Fig.7 The effect of HHP on the content of SH of PPI
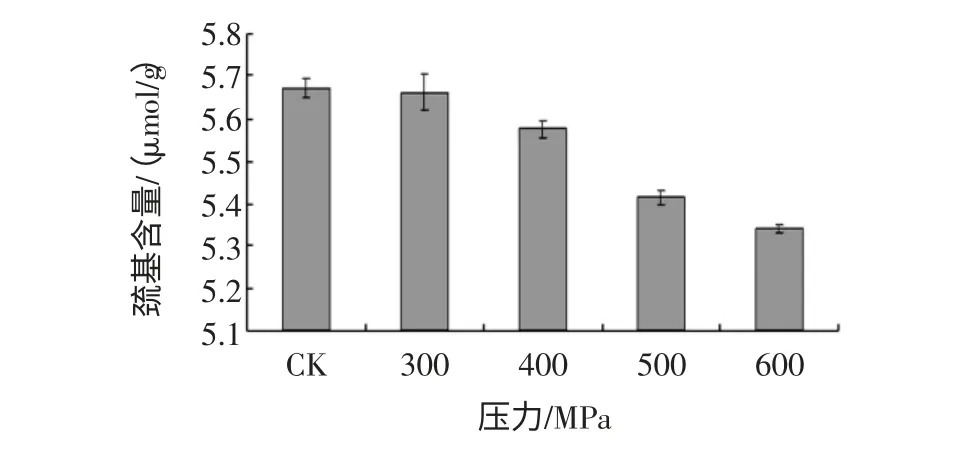
图8 高静压处理对花生球蛋白巯基含量的影响Fig.8 The effect of HHP on the content of SH of peanut globulins
3 结论
中性pH 条件下高静压处理可有效的改善花生分离蛋白和花生球蛋白的溶解性和乳化性,但是会降低其乳化稳定性。在400 MPa,花生分离蛋白具有最大的乳化性和表面疏水性,花生球蛋白具有最大的溶解性;在500 MPa,花生球蛋白具有最大的乳化性和表面疏水性,花生分离蛋白具有最大的溶解性。随着压力的升高,花生球蛋白和花生分离蛋白的游离巯基含量呈下降趋势。由此可见,高静压技术在对花生蛋白的结构和功能特性改造方面有显著作用,可以预见高静压技术在生产新型蛋白食品方面具有巨大的研究价值。
[1] 刘传富,张兆静.花生蛋白及其在食品中的应用[J].中国食物与营养,2005(1):24-25
[2] Kinsella J E. Functional properties of proteins in foods: survey [J].Critical review in food science and nutrition,1976,7:219-280
[3] Lullien-Pellerin V, Balny C. High pressure as a tool to study some proteins′properties:Conformational modification,activity and oligomeric dissociation[J]. Innovative food science and emerging technologies,2002,3:209-221
[4] Wang Xian-Sheng,Tang Chuan-He,Li Bian-Sheng,et al. Effects of high-pressure treatme nt on some physicochemical and functional properties of soy protein isolates [J]. Food hydrocolloids,2008,22:560-567
[5] Tang Chuan-He,Ma Ching-Yung.Effect of high pressure treatment on aggregation and structural properties of soy protein isolate [J].LWT-Food science and technology,2009,42:606-611
[6] 杨伟强,禹山林,袁涛.碱提酸沉法制取花生分离蛋白工艺研究[J].花生学报,2008,37(4):12-17
[7] Liu Chun,Wang Hong-ling,Cui Zhu-mei,et al. Optimization of extraction and isolation for 11S and 7S globulins of soybean seed storage protein[J].Food chemistry,2007,102:1310-1316
[8] Lowry O H,Rosebrough N J,Lewis A L,et al. Protein measurement with the Folin phenol reagent[J].The journal of biological chemistry,1951,193:265-275
[9] Pearce K N,Kinsella J E.Emulsifying properties of proteins: evaluation of a turbidimetric technique[J].Journal of agricultural and food chemistry,1978,26(3):716-723
[10] Kato A, Nakai S. Hydrophobicity determined by fluorescence probe methods and its correlation with properties of proteins[J].Biochimica et Biophysica Acta,1980,642:13-20
[11] Mine Y.Effect of dry heat and mild alkaline treatment on functional properties of egg white proteins[J].Journal of Agricultural and Food Chemistry,1997,45:2924-2928
[12] Balny C,Masson P.Effects of high pressure on proteins[J].Food reviews international,1993,44:89-13
[13] 钟昔阳,姜绍通,潘丽军,等.超高压对麦醇溶蛋白/麦谷蛋白功能性质的影响[J].中国粮油学报,2009,24(8):8-11

