响应面法优化嗜麦芽窄食单胞菌产蛋白酶发酵培养基
顾瑾麟,张红发,夏永军,任 静
(光明乳业股份有限公司乳业研究院,乳业生物技术国家重点实验室,上海200436)
蛋白酶是催化蛋白质水解的一类酶,主要存在于动物内脏、植物茎叶、果实和微生物中[1],既可以从动植物组织中提取,也可以通过微生物发酵工艺进行生产,是一类广泛应用于食品、纺织、医药、有机合成、洗涤剂及制革脱毛等方面的重要工业和研究用酶,其份额占整个酶制剂市场的一半以上[2]。微生物来源的蛋白酶,生产周期短、生产成本低、不受土地和季节限制,多为胞外酶,纯化制备相对容易,规模化生产的成本会大大降低。
考察培养基组分对产酶影响的传统方法有单因子实验、全因子实验等。因其未考虑各因素之间的交互作用,故不能实现真正的最优化,且当因素较多时,实验次数太多[3]。响应面法(Response surface methodology,RSM)是一种集实验设计、模型建立、各因素重要性的评估和各因素最优水平的确定的一种统计学方法,是重要的过程优化工具,它能迅速高效地确定多因子系统的最佳条件[4]。近年来采用响应面法对微生物发酵产酶培养基优化已有一些报道,并取得了较好的优化结果。Papagora C等[5]从干腌橄榄中分离得到菌株Debaryomyces hansenii YLL29,通过响应面法优化,其胞外脂肪酶活力达7.44U/m L,是未优化前的2.28倍。K N Niladevid等[6]通过响应面法将丝状菌链霉菌psammoticus ATCC 7334深层发酵产漆酶的含量提高了3倍。Yishan Su等[7]从泰山分离到产热稳定木聚糖酶菌株Thermomyces lanuginosus SDYKY-1,通过中心组合设计与响应面法优化,将其木聚糖酶活力提高144%,为3078U/m L。
本文以实验室分离保存的一株对脱脂乳平板有明显水解圈的菌株为实验对象,经鉴定为嗜麦芽窄食单胞菌(Kx-7),原始酶活为146.43U/m L。为了提高Kx-7产蛋白酶活力,以单因素实验为基础,并以筛选出的因素水平为变量,以蛋白酶酶活为响应值,运用响应面法对培养基进行优化,以期获得最佳发酵培养基配比。
1 材料与方法
1.1 材料与仪器
嗜麦芽窄食单胞菌(Kx-7) 由本实验室分离保存;脱脂奶粉、福林试剂、碳酸钠、三氯乙酸、磷酸二氢钠、磷酸氢二钠、干酪素、氢氧化钠、酪氨酸、葡萄糖、D-果糖、蔗糖、α-乳糖、淀粉、麦芽糖、酪蛋白、胰蛋白胨、酵母浸出粉、大豆蛋白胨、硝酸钠、尿素、硫酸铵、Triton X-100、十二烷基硫酸钠(SDS)、吐温-60、吐温-20、吐温-80 均为国产分析纯;种子培养基(LB培养基) 胰蛋白胨10g/L、酵母提取物5g/L、氯化钠10g/L,pH自然;原始发酵培养基 D-果糖30g/L、酪蛋白5g/L、Na2HPO4·2H2O 6g/L、KCl 1g/L、MgSO4·7H2O 0.1g/L,pH自然。以上培养基于121℃灭菌20m in。
BPH-9082恒温培养箱 上海一恒科技有限公司;ZHWY-2102C双层恒温摇床 上海智成分析仪器制造有限公司;Purifier RlogicTM 4英尺TypeA2生物安全柜 美国LABCONCO;MLS-3750高压灭菌锅日本SANYO;M inispin p lus台式离心机 德国艾本德eppendorf;AL104梅特勒分析天平、PL2002梅特勒便携式天平 瑞士梅特勒-托利多;SpectraMax M 5酶标仪 美国Molecular Devices公司。
1.2 实验方法
1.2.1 蛋白酶活力测定方法 参考行业标准《蛋白酶活力测定法》[8]。酶活力单位定义为:在 40℃下每分钟水解酪蛋白产生lμg酪氨酸,定义为1个蛋白酶活力单位。
1.2.2 单因素实验
1.2.2.1 碳源对酶活的影响 以接种量为5%(v/v)的菌液转接于分别添加了6种不同碳源的发酵培养基中,碳源分别为α-乳糖、蔗糖、淀粉、麦芽糖、D-果糖、葡萄糖,均30g/L;180r/m in,30℃振荡培养,30h后测定发酵液中蛋白酶活力。
1.2.2.2 氮源对酶活的影响 以接种量为5%(v/v)的菌液转接于分别添加了7种不同氮源的发酵培养基中,氮源分别为大豆蛋白胨、胰蛋白胨、酵母侵出粉、硫酸铵、尿素、硝酸钠、酪蛋白,均5g/L;以1.2.2.1中蛋白酶活力最高的因素为碳源,180r/m in,30℃振荡培养,30h后测定发酵液中蛋白酶活力。
1.2.2.3 表面活性剂对酶活的影响 以接种量为5%(v/v)的菌液转接于分别添加了5种表面活性剂的发酵培养基中,表面活性剂分别为吐温20、吐温60、吐温80、Triton X-100均4m L/L,SDS 0.2g/L;以1.2.2.1和1.2.2.2中影响酶活最高的因素为碳源和氮源,同时以不添加表面活性剂为空白对照,180r/m in,30℃的条件下振荡培养,30h后测定发酵液中蛋白酶活力。
1.2.3 响应面实验设计 根据单因素实验结果确定最佳碳源、氮源、表面活性剂及其相应浓度范围后,用Design Expert 7.0软件,根据Box-Behnken模型的中心组合实验原理设计三因素三水平的Box-Behnken实验。以D-果糖(X1)、酪蛋白(X2)和Triton-100(X3)三个因素为自变量,以蛋白酶酶活(Y)为响应值,对实验数据进行回归性分析,用t检验验证回归系数的显著性,用F检验评价模型方程的显著性,方程的拟合性由R2确定。实验设计因素及水平见表1。
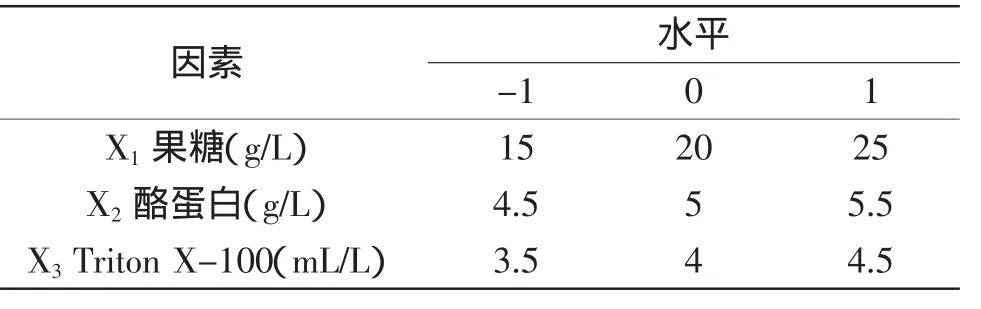
表1 响应面法分析因素及水平表Table1 Factors and levels for response surface analysis
2 结果与讨论
2.1 单因素实验结果
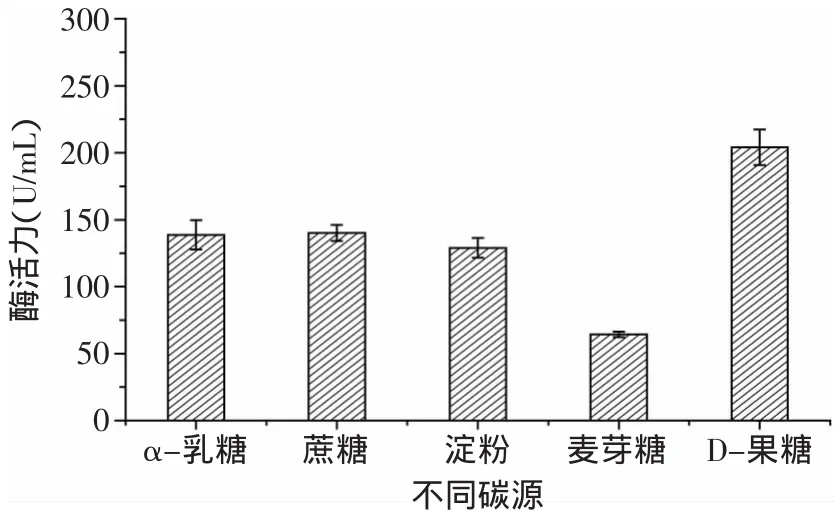
图1 不同碳源对蛋白酶酶活的影响Fig.1 Effectof different carbon sources on enzyme activity of protease
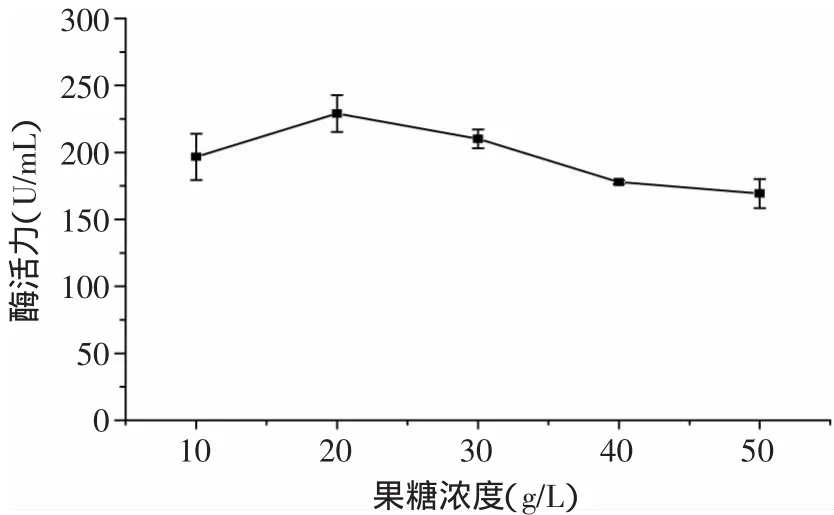
图2 D-果糖浓度对蛋白酶酶活的影响Fig.2 Effect of D-fructose concentration on enzyme activity of protease
2.1.1 不同碳源对酶活的影响 微生物细胞含碳量约占干重的50%,故除水分外,碳源是需要量最大的营养素[9],因此选择合适的碳源对菌体的生长以及产酶都极为重要。由图1可见,当以酪蛋白为氮源时,碳源对Kx-7产酶的影响依次是D-果糖>蔗糖>α-乳糖>淀粉>麦芽糖。碳源为D-果糖时,蛋白酶活力最高为204.04U/m L,具有显著效应。可能由于D-果糖为单糖,不需要再水解,相对于双糖和多糖更便于Kx-7吸收所利用。由图2可见,当D-果糖浓度为20g/L时,蛋白酶活力最高为229.02U/m L,过高或过低的糖浓度都不利于该菌株生长。这是由于糖浓度过低不能提供足够的能量和物质来源;而糖浓度过高一方面会引起发酵液中渗透压过高,使细胞失水,生长受到抑制,另一方面糖浓度过高使代谢产物增加,发酵液pH降低,不利于菌株生长。
2.1.2 氮源对酶活的影响 由图3可见,氮源对Kx-7产酶的影响依次是酪蛋白>胰蛋白胨>大豆蛋白胨>硝酸钠>尿素,使用有机氮源(酪蛋白、胰蛋白胨、大豆蛋白胨)时,Kx-7产酶酶活明显高于无机氮源(尿素、硝酸钠),其原因可能是有机氮源中含有的无机盐、较丰富的B族维生素及生长因子促进了蛋白酶的产生[10],无机氮源成分较单一,影响产酶量。3种有机氮源中,酪蛋白效果最好,酶活力达到257.67U/m L,可见酪蛋白具有显著效应。其原因可能是动物蛋白(酪蛋白、胰蛋白胨)比植物蛋白(大豆蛋白胨)对Kx-7产酶具有更好的促进作用。由图4可见,当酪蛋白浓度为5g/L时,蛋白酶活力最高为261.05U/m L,这是因为浓度过高导致C/N比降低,不利于蛋白酶积累;浓度过低不能得到理想的菌浓度,同样不利于蛋白酶的产生。
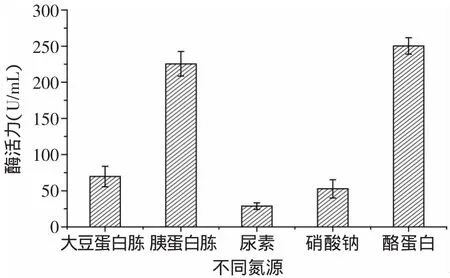
图3 不同氮源对蛋白酶酶活的影响Fig.3 Effectof nitrogen sources on enzyme activity of protease
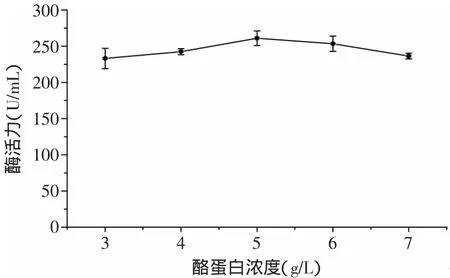
图4 酪蛋白浓度对蛋白酶酶活的影响Fig.4 Effectof casein concentration on enzyme activity of protease
2.1.3 表面活性剂对酶活的影响 由图5可见,表面活性剂对Kx-7产酶的影响依次为Triton X-100>SDS>空白对照>吐温-60>吐温-20>吐温-80。Triton X-100和SDS对Kx-7产蛋白酶活力有较大的促进作用,酶活分别达到290.72U/m L和283.79U/m L,可见Triton X-100具有显著效应。而表面活性剂吐温-20、吐温-60、吐温-80对Kx-7产蛋白酶活力没有明显影响。由图6可见,当Triton X-100浓度为4m L/L时,蛋白酶活力最高为284.50U/m L。表面活性剂在微生物发酵中的主要作用是提高细胞膜的渗透性,减少氧及营养物质进入细胞的传递阻力,从而提高目标产物的产量[11]。蛋白酶活力与Triton X-100呈现一定程度的浓度依赖性,低浓度时对蛋白酶活力有促进作用,高浓度则有抑制作用。
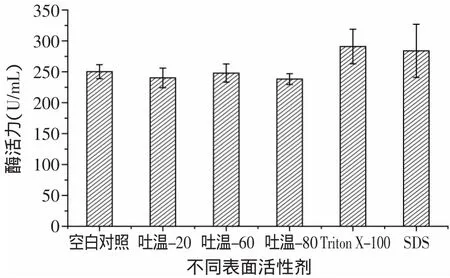
图5 不同表面活性剂对蛋白酶酶活的影响Fig.5 Effectof Surfactants on enzyme activity of protease

图6 Triton X-100浓度对蛋白酶酶活的影响Fig.6 Effectof Triton X-100 concentration on enzyme activity of protease
2.2 响应面分析
2.2.1 响应面回归模型的建立和分析 根据单因素实验结果,确定D-果糖、酪蛋白、Triton X-100为影响Kx-7产蛋白酶的关键因素,实验设计及结果如表2所示。实验数据进行二次多项式回归拟合后,获得嗜麦芽窄食单胞菌Kx-7产酶酶活对D-果糖、酪蛋白、Triton X-100的二次多项式回归方程为:

此模型相关系数R2=0.9425,这说明预测值与实测值之间有较好的拟合度。该二次项方程及各项方差分析如表3所示,模型p值为0.0127,说明模型显著(p<0.05),失拟项p值为0.1217,说明由误差引起模型偏差的概率为12.17%,模型失拟项不显著(p>0.05)。方程中独立变量X1、X2、X3不显著性,这表明仅随单因素浓度的增加蛋白酶活力增加不显著。在交互项中,X1X2、X1X3显著(p<0.05)。X、X、X对响应值影响显著(p<0.05)。
2.2.2 交互作用分析 经Design Expert软件分析可得到3个显著影响因子之间的响应面分析图(如图7~图9所示),相比于二次回归方程,响应面图能直观的显示3种因素的交互作用和对Kx-7产蛋白酶的影响,每组响应面图谱都有明显的顶峰,证实影响因素的最佳值落在实验设计的取值范围内。通过响应面图3种因素的最佳值可以得到预测,最大蛋白酶活力值在响应面的最高点处[12]。3种因素中X1与X2,X1与X3之间有显著的交互作用,X2与X3的交互作用不显著(p>0.05)。三因素的交互响应曲面图见图7~图9。
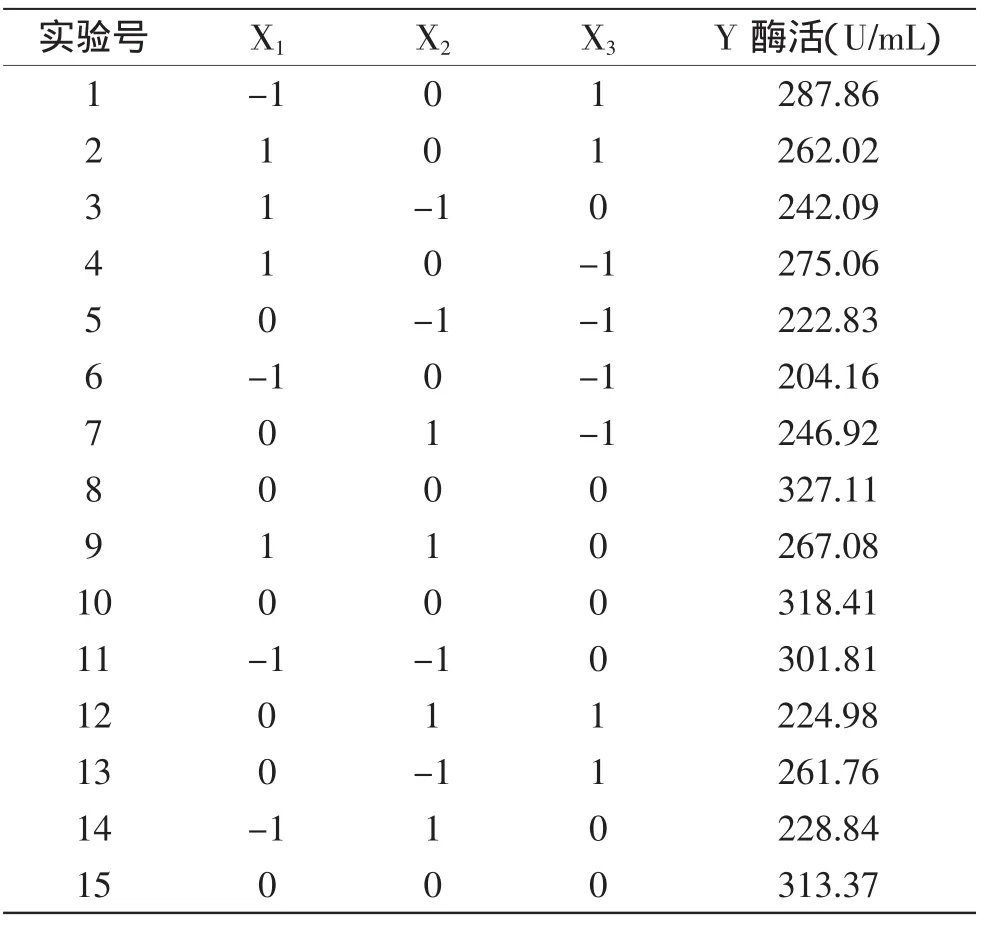
表2 Box-Behnken实验设计及结果Table2 Design and results of Box-Behnken experiment

表3 响应面结果方差分析Table3 Variance analysis of response surfacemethod design result
2.3 嗜麦芽窄食单胞菌(Kx-7)产蛋白酶最优培养基配方的获取与验证
对回归方程进行进一步分析,得到的最优发酵培养基组成为D-果糖19.15g/L,酪蛋白4.05g/L,Triton X-100 5.10m L/L时,理论上嗜麦芽窄食单胞菌(Kx-7)产蛋白酶活力的最大值为321.30U/m L。根据上述回归分析结果和响应面实验特点,通过实验验证,发酵30h后实际蛋白酶活力为(324.56±0.31)U/m L,与理论值较接近,预测精度达98.99%,可见该模型能较好地预测Kx-7实际产蛋白酶情况。从而用响应面法优化的发酵培养基可为今后Kx-7的培养和开发利用提供必要的理论基础。

图7 D-果糖和酪蛋白交互作用对蛋白酶活力的影响Fig.7 Effectof D-fructose and casein on enzyme activity of protease
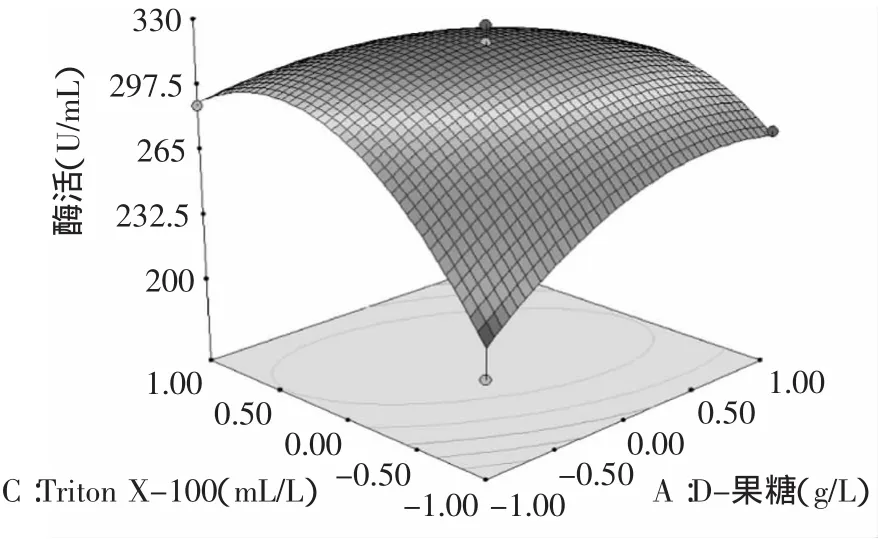
图8 D-果糖和曲拉通-100交互作用对蛋白酶活力的影响Fig.8 Effectof D-fructose and Triton X-100 on enzyme activity of protease

图9 酪蛋白和曲拉通-100交互作用对蛋白酶活力的影响Fig.9 Effect of casein and Triton X-100 on enzyme activity of protease
3 结论
蛋白酶具有重要的工业和研究应用价值,通过筛选高产菌种,优化发酵条件来提高蛋白酶产量是降低其工业应用成本的有效手段。影响微生物产酶的因素主要有3方面,即微生物菌株的自身优劣,培养基组成和培养条件[13]。嗜麦芽窄食单胞菌(Kx-7)为本实验室筛选的蛋白酶高产菌株,从优化培养基组分出发,首先采用单因素实验确定了嗜麦芽窄食单胞菌Kx-7产蛋白酶适宜的碳源、氮源及表面活性剂,分别为果糖,酪蛋白和Triton X-100,并分别确定了各自的适宜浓度范围。利用Box-Behnken实验对Kx-7产蛋白酶的发酵培养基进行优化,结果表明当果糖的浓度为19.15g/L,酪蛋白浓度为4.05g/L,曲拉通的浓度为5.1m L/L时,Kx-7的蛋白酶活力达到324.56U/m L,比优化前提高了1.2倍。该结果表明,采用响应面法来提高嗜麦芽窄食单胞菌(Kx-7)蛋白酶产量是可行的,具有一定实用价值。
[1]马桂珍,暴增海,王淑芳,等.高产蛋白酶细菌的分离筛选及其种类鉴定[J].食品科学,2011,32(21):183-187.
[2]宋鹏,陈亮,郭秀璞,等.产蛋白酶菌株的鉴定及酶学特性[J].食品科学,2012,33(13):152-155.
[3]汤斌,潘海波,张庆庆,等.基于响应面法优化匍枝根霉TP-02液态发酵纤维素酶条件[J].工业微生物,2010,40(2):30-34.
[4]Majumder A,Bhandari S,Purama RK,et al.Enhanced production of a novel dextran from Leuconostoc mesenteroides NRRLB-640 by response surfacemethodology[J].Ann Microbiol,2009,59(2):309-315.
[5]Papagora C,Roukas T,Kotzekidou P.Optimization of extracellular lipase production by Debaryomyces hansenii isolates from dry-salted olives using response surface methodology[J].Food and BioproductsProcessing,doi:10.1016/j.fbpo,2013,02,008.
[6]Niladevi K N,Sukumaran R K,Jacob N,et al.Optimization of laccase production from a novel strain-Streptomyces psammoticus using response surface methodology[J].Microbiological Research,2009,164(1):105-113.
[7]Su Y S,Zhang X Y,Hou ZW,et al.Improvement of xylanase production by thermophilic fungus Thermomyces lanuginosus SDYKY-1 using response surface methodology[J].New Biotechnology,2011,28(1):40-46.
[8]中华人民共和国卫生部中国国家标准化管理委员会.GB/T 5009.9-2008食品中淀粉的测定[S].北京:中国标准出版社,2008.
[9]周德庆.微生物学教程[M].北京:高等教育出版社,2005.
[10]郭艾英,凌云,张志雯.产低温蛋白酶海洋细菌的筛选及发酵条件[J].河北科技师范学院学报,2011,25(3):58-63.
[11]吕哲喆,刘晓侠,孙诗清,等.表面活性剂对天然红色素发酵的影响药物生物技术[J].药物生物技术,2012,19(4):324-327.
[12]Cai MH,Zhou XS,Sun XQ,et al.Statistical optimization ofmedium composition for aspergiolide A production bymarinederived fungus Aspergillusglaucus[J].JInd Microbiol Biotechnol,2009,36:381-389.
[13]刘明启,关荣发,陈文伟.黑曲霉固体发酵产木聚糖酶的响应面优化设计及其酶学性质的研究[J].农业生物技术学报,2010,18(1):52-60.

