重组β-葡萄糖苷酶基因和内切葡聚糖苷酶基因在大肠杆菌中的共表达
唐自钟,刘 姗,2,韩学易,陈 惠,*,孙 蓉,单 志,苟 琳,吴 琦
(1.四川农业大学生命科学与理学院,四川雅安625014;2.攀枝花学院生物与化学工程学院,四川攀枝花617000)
当代社会高速发展,食品原材料和能源等问题越来越受到世界人民的关注,纤维素是自然界中含量最多,最丰富的材料,如何利用这一巨大的资源成为研究者最为关心的问题。最早美国进行纤维素材料降解防护问题时发现纤维素经微生物降解后,可产生经济、丰富的生产原料,在扩大食品工业原料和植物原料的综合利用,提高原料利用率,净化环境和开辟新能源等方面具有十分重要的意义,且有望解决自然界不断产生的固体废物问题,于是纤维素酶得到了广泛的关注。纤维素酶在动物饲料、纺织、食品加工、污水处理、中草药有效成分提取等行业得到广泛应用,有效地改善产品质量,提高产量,具有良好的经济效益[1-3]。
目前纤维素酶的研究主要集中在菌种的筛选,单一基因的克隆与表达,及利用分子技术对已研究的纤维素酶进行合理化和非合理化突变,以期望得到高酶活的基因。W ilson等[4]利用定点突变技术对T.fusca的内切葡萄糖苷酶Cel6A进行突变,获得了15个表面突变体和5个环突变体,使其对羧甲基纤维素的活性提高了175%。当前研究对于纤维素酶的整体没有一个总的认识,纤维素酶是由三大酶类组成,它们是一个有机的整体,才能对纤维素有一个很好的降解作用[4-7],如何使其能够共同表达,目前在大肠杆菌中其他基因的共表达已有的相关研究,如庞永奇等[8]将pET30a2Cre和pET23b2loxGFP在大肠杆菌中成功实现了不相容性共表达;范立强等[9]肉碱脱水酶基因caiB和辅酶合成因子基因caiE的共表达研究中,比较了相容和不相容表达系统,基于以前研究基础,本研究以实验室自主得到的β-葡萄糖苷酶基因和内切葡聚糖苷酶基因出发,构建了这两种纤维素酶在大肠杆菌中的共表达,以期能提高降解纤维素的能力。
1 材料与方法
1.1 材料与仪器
本实验所用的菌株与载体 列于表1;限制性内切酶BglⅡ、Bam HⅠ、XhoⅠ、T4DNA连接酶、SlutionⅠ连接酶、DNAMarker、protein Marker(Low)、高保真酶primeSTAR@HSDNA polymerase、氨苄青霉素钠 大连TaKaRa Biotech公司;质粒提取试剂盒、琼脂糖凝胶回收试剂盒和PCR产物纯化回收试剂盒 上海OMEGA生物技术有限公司;2×PCR master m ix 天根生化科技有限公司;引物 由上海Invitrogen生物技术有限公司合成;胰蛋白陈和酵母粉 Oxoid公司;SDS-PAGE凝胶试剂盒 武汉博士德生物公司;Ni-Agarose His标签蛋白纯化试剂盒 GE公司美国;其他生物试剂 均为进口或国产分析纯。
PCR仪(百乐T100)、GenePulser电穿孔仪(bio-rad Gene PulserMXcellTM)、UVP凝胶成像仪(LY-B)、恒压恒流电泳仪(DYY-Ⅱ) 北京六一;冷冻离心机(Avanti J-E) Beckman公司等。
1.2 实验方法
1.2.1 重组质粒的构建 根据本实验室自行克隆得到的内切葡聚糖酶基因EG,并连于pUC18的基因序列pUC18-End和外切葡聚糖酶基因BGL并连于pMD19的基因序列pMD19-BGL,分别进行生物信息学分析,设计出不含有信号肽的引物序列,并在5’端和3’端分别引入了相应的酶切位点,引物序列及引入的酶切位点见表2。
高保真酶PCR扩增体系:EG基因片段,模板为质粒pUC18-End,扩增条件为:95℃预变性2m in;94℃变性1min,55℃退火1min,72℃延伸2min,30个循环;72℃延伸8m in。BGL基因片段,模板为质粒pMD19-BGL,扩增条件为:94℃预变性4m in;94℃变性50s,61℃退火50s,72℃延伸3m in,30个循环;72℃延伸10m in。产物经1%琼脂糖凝胶电泳检测回收,之后将PCR产物和表达载体质粒pET32a和pET30b进行相应的双酶切,回收后分别进行连接:pET32a与EG相连接;pET30b与BGL相连接。连接产物转化大肠杆菌DH 5α,经抗性筛选、菌落PCR、酶切筛选后挑取阳性转化子,测序。结果正确的重组子命名为:pET32a-EG和pET30b-BGL。
1.2.2 重组质粒的转化 pET32a-EG和pET30b-BGL分别用热激法转化入大肠杆菌表达菌株BL21(DE3),作为对照,同时将pET32a-EG和pET30b-BGL等量混合后进行电击转化入大肠杆菌BL21(DE3)进行电击共转化,电击转化程序:电脉冲为25μF,电压2.5kV,电阻200Ω,时间4~5ms。pET32a-EG转化子用100mg/L氨苄青霉素(Amp);pET30b-BGL转化子用50mg/L卡那霉素(Kan);共转化的转化子经同时含有Amp和Kan的双抗生素LB平板上筛选单菌落,37℃过夜培养后,挑取单菌落进行菌落PCR鉴定。
1.2.3 重组菌株的菌落PCR及高酶活菌株的筛选 将经相应抗生素筛选后的转化子,分别转入到另一个新鲜的带有相应抗性的平板上,37℃过夜培养后,利用T7引物进行菌落PCR鉴定。分别挑取10株鉴定结果为阳性的转化子进行终浓度1mmol/L IPTG诱导表达,收集菌体用1/15mol/L的PBS重悬,超声破碎后,用上清经适当稀释后测酶活。
1.2.4 酶活力测定方法

表1 本实验所用的菌株与载体Table1 The strains and vectors used in this experiment
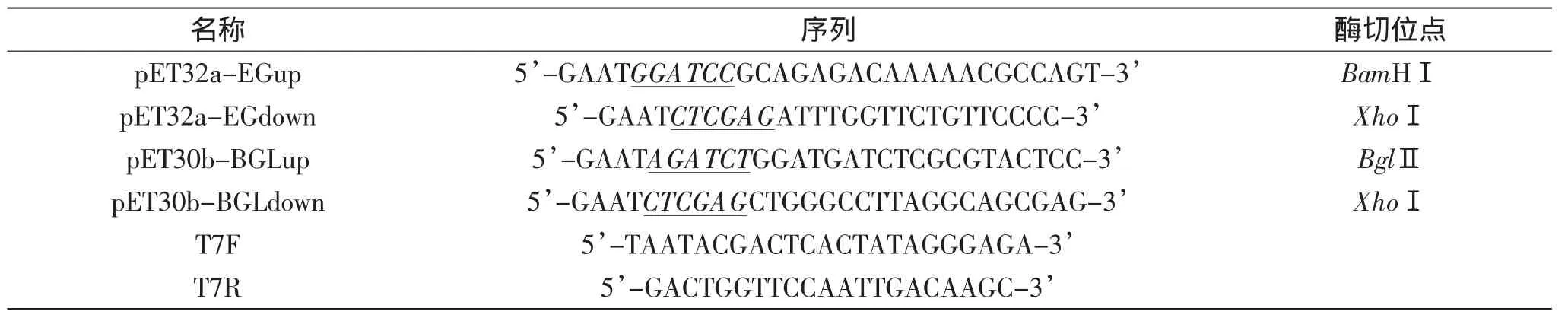
表2 本实验中所用到的引物序列Table2 Sequences of primers used in this experiment
1.2.4.1 内切葡聚糖酶活力测定方法 以1m L 1%的羧甲基纤维素钠(用1/15mol/L pH6.8磷酸盐缓冲液配制)为底物,加入0.1m L粗酶液,50℃水浴反应30m in后,加入2.5m L DNS显色液,沸水浴煮10m in,取出后在流水下迅速冷却后定容至5.0m L摇匀,将灭活的酶液作为空白对照,其他同以上步骤。在530.0nm波长处测得各管溶液的吸光值[5,10]。
酶活的定义:1m L酶液每分钟产生1μg还原糖的酶量作为1个酶活单位,用U/m L表示。
1.2.4.2 β-葡聚糖酶活力测定方法 加入0.5m L一定稀释度的粗酶液,以0.5m L 0.5%的水杨苷为底物,加入0.5m L一定稀释酶液,于55℃反应20m in,加入1m L DNS试剂,充分混合在沸水中煮沸5min,冷却后用蒸馏水定容至5m L,在540nm波长处测定其吸光度,以加热灭活的酶液为对照。根据葡萄糖标准曲线计算酶反应体系释放的还原糖的量[6,11]。
酶活定义:1m L酶液在1m in内使底物产生1μg还原糖(以葡萄糖计)所需的酶量为1个酶活单位(U)。
1.2.4.3 共表达酶活力测定方法 共表达酶活以内切葡聚糖酶方法进行。
1.2.5 蛋白的分离纯化 诱导表达的发酵液经离心收集菌体,按每100mg菌体(湿重)加入1~5m L细菌裂解液,经超声裂解菌体后,10000r/min,4℃离心3min,收集上清用GE公司生产的预装Ni+柱,用10倍柱体积浓度为50mmol/L的咪唑进行平衡后,上样后用15倍柱体积浓度为500mmol/L的咪唑进行洗脱,每1m L收集一管,留样进行SDS-PAGE分析。
1.2.6 重组酶酶学性质分析 最适反应pH将酶在pH3.0~10的底物中进行测定,pH稳定性分析将酶经pH 3.0~10的缓冲液中30m in后采用标准方法测定酶活力,最适反应温度将酶液置于30~90℃反应后采用标准方法测定酶活力,热稳定性的测定将酶液置于30~90℃下保温30min,采用标准方法测定酶活力,以最高酶活作为100%。
2 结果与分析
2.1 重组质粒的构建
以pUC18-End质粒和pMD19-BGL为模板用高保真酶进行PCR扩增,获得的片断大小分别约为1500bp和2800bp,与预计大小一致,克隆连接入表达载体,经抗性筛选和菌落PCR鉴定后,提取质粒采用相应的酶进行双酶切分析。pET32a-EG质粒,用Bam HⅠ和XhoⅠ酶处理,电泳结果如图1所示,酶切过后的载体和目的基因片段大小正确分别为1500bp和5600bp,表达载体pET32a-EG构建成功。
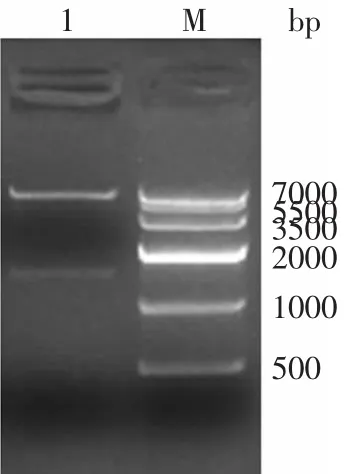
图1 重组表达载体pET32a-EG的酶切电泳Fig.1 Restriction analysis of recombinant plasmid pET32a-EG
pET30b-BGL,用BglⅡ和XhoⅠ进行单、双酶切鉴定,电泳检测结果如图2所示。
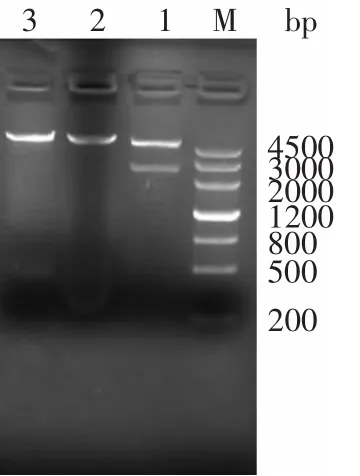
图2 重组表达载体pET30b-BGL的酶切电泳Fig.2 Restriction analysis of recombinant plasmid pET30b-BGL
重组质粒经BglⅡ和XhoⅠ分别单酶切之后的目的条带大小与预计大小一致,酶切条带单一。经BglⅡ和XhoⅠ双酶切之后,目的基因片段与载体分离,目的基因片段大小和载体大小均正确,确定目的基因和载体连接成功。
2.2 共表达菌株的菌落PCR筛选
将构建好的内切葡聚糖酶基因表达载体和外切葡聚糖酶基因表达载体通过电转化法转入BL21菌株中,经(含Amp 100μg/m L和Kan 50μg/m L)双抗筛选后,得到的阳性转化子进行菌落PCR鉴定,以T7up和T7down为引物,PCR扩增结果如图3所示,两条带大小分别为1500bp和2800bp。
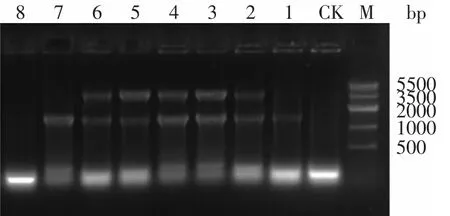
图3 菌落PCRFig.3 Colony PCR identification
2.3 重组工程菌的IPTG诱导表达筛选
分别从相应抗性的平板上各挑取10个阳性转化子,经终浓度为1mmol/L IPTG诱导后,测酶活。测得酶活如表3所示,从表中分析结果可知,共转化菌株酶活最高的是2号,酶活可达到1196.8U/m L,将其命名为pET32a-EG-pET30b-BGL;pET30b-BGL重组转化菌株酶活最高是5号,酶活可达到219.6U/m L,命名为pET30b-BGL;pET32a-EG重组转化菌株酶活最高的是10号,酶活可达到826.5U/m L,命名为pET32a-EG。
2.4 蛋白的分离纯化SDS-PAGE分析
分别对筛选出三种酶活较高的基因工程菌pET32a-EG-pET30b-BGL、pET30b-BGL、pET32a-EG的细胞裂解物进行SDS-PAGE凝胶电泳分析,如图4所示,5号和6号都出现一条带,相对分子量大约为55ku或90ku,7号出现两条带,相对分子量大约为55ku和90ku,与理论计算大小相符,结果表明内切葡聚糖酶和β葡萄糖苷酶在大肠杆菌中共同得到高效表达。1号和2号是含空载体大肠杆菌的细胞裂解物中,不存在目的条带,与预期结果相符。
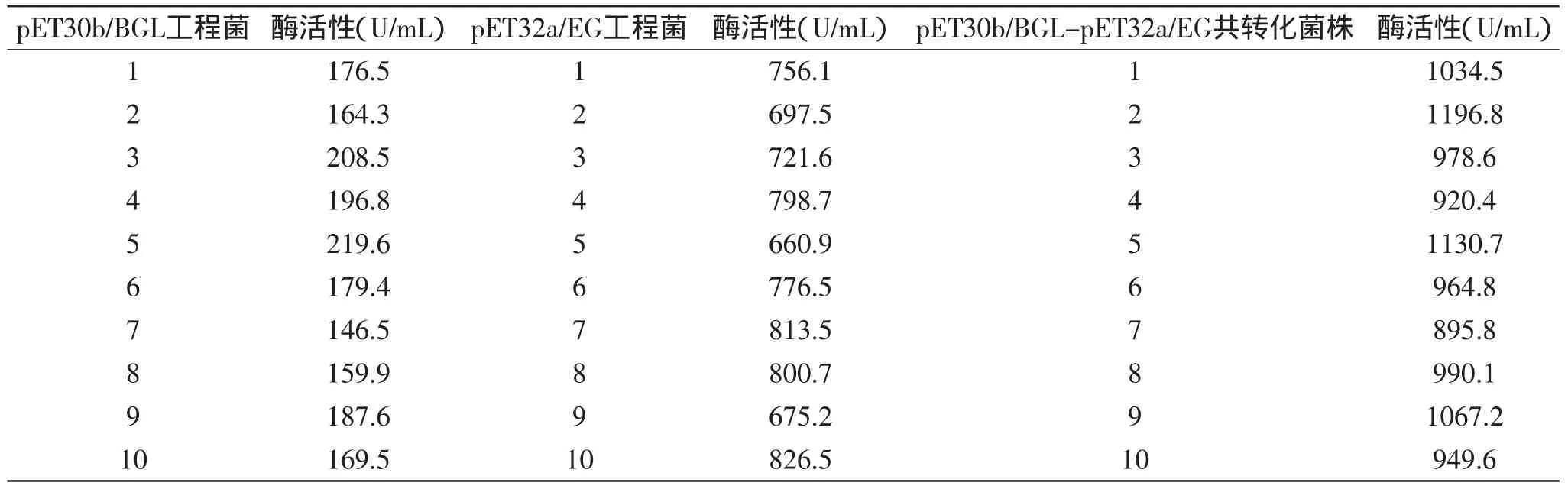
表3 三种酶活性比较Table3 Enzymatic activity comparison of three enzyme

图4 三种酶表达产物的SDS-PAGE分析Fig.4 SDS-PAGE analysis of expression of three reconstructed enzyme
蛋白质的分离纯化方法参照Ni2+柱纯化操作方法纯化后,得到单一的条带,条带大小也与目的蛋白大小预期一致,分别为55ku和90ku,如图5所示。
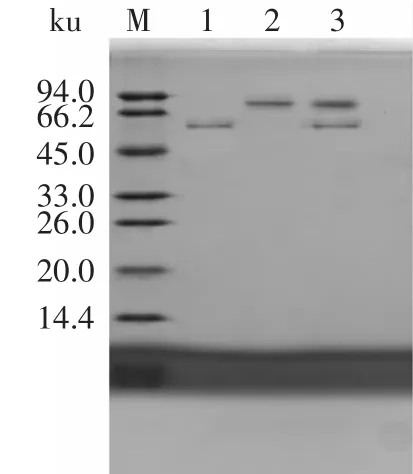
图5 纯化后目的蛋白SDS-PAGEFig.5 SDS-PAGE analysis of purification protein
2.5 重组酶酶学性质分析
2.5.1 重组酶最适反应pH测定 取适当稀释的纯化后的酶液在不同pH条件下与底物共同反应30m in后,测定其酶活,结果如图6所示,重组共表达酶(pET32a-EG-pET30b-BGL)、重组内切葡聚糖酶(pET32a-EG)和重组β-葡萄糖苷酶(pET30b-BGL)的最适反应pH均为6.0,在pH为6.0的环境下,三种重组酶均能达到最大酶活力。

图6 三种酶的最适反应pHFig.6 pH profile of the three reconstructed enzyme
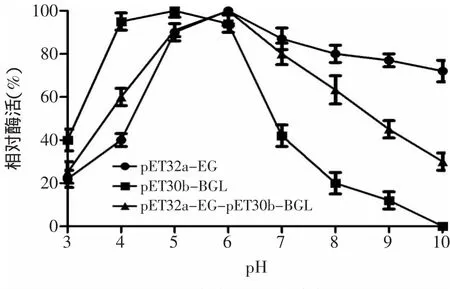
图7 三种酶的pH稳定性Fig.7 pH stability of the three reconstructed enzyme
2.5.2 重组酶pH稳定性的测定 取适当稀释的酶液在不同pH下处理后采用标准方法测定其酶活结果如图7所示,共表达酶(pET32a-EG-pET30b-BGL)在pH 5~7之间较为稳定,能保持最高酶活的80%以上,β-葡萄糖苷酶(pET30b-BGL)在pH偏酸性的环境中较为稳定,在pH4~6的环境中处理后,其残余酶活力仍能保持最高酶活的80%。内切葡聚糖酶(pET32a-EG)在pH5~9酶活力相对稳定,可以保持在最高酶活的80%以上。
2.5.3 重组酶最适温度测定 取适当稀释的酶液不同的温度下与底物共同反应30m in后,测定其酶活,结果如图8所示,重组共表达酶(pET32a-EG-pET30b-BGL)、重组内切葡聚糖酶(pET32a-EG)的最适反应温度均为60℃,重组β-葡萄糖苷酶(pET30b-BGL)的最适反应温度为50℃,在最适反应pH为6.0的环境下,三种重组酶在各自的最适反应温度下均能达到最大酶活力。

图8 三种酶的最适反应温度Fig.8 Optimal temperature of the three reconstructed enzyme
2.5.4 重组酶温度稳定性测定 取适当稀释的酶液在不同的温度下处理后,采用标准方法测定其酶活,结果如图9所示,共表达酶共表达酶(pET32a-EG-pET30b-BGL)和内切葡聚糖酶(pET32a-EG)在30~60℃范围内稳定性良好,β-葡萄糖苷酶(pET30b-BGL)在30~50℃稳定性良好,随着温度的逐渐升高,超过50℃,β-葡萄糖苷酶(pET30b-BGL)酶活急剧下降,60℃时酶活仅为最高酶活的10%,温度高于80℃时共表达酶和内切葡聚糖酶酶活迅速下降。
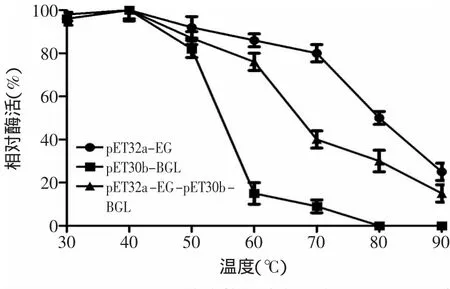
图9 三种酶热稳定性分析Fig.9 Heat stability of the three reconstructed enzyme
3 讨论
随着基因克隆技术的飞速发展,许多外源基因在不同的表达载体中进行表达,但是,很多生物学功能并不是由一个基因或一种蛋白来控制和完成的,它需要多个相关基因或蛋白的共同作用[12-14]。比如纤维素酶,就是有三种酶共同作用来分解纤维素的,因此,研究多个外源基因在同一宿主细胞中的共表达具有现实的意义和重要的应用价值。双质粒共表达系统是将两个外源基因,分别构建到不同抗性的载体中,然后把两个载体通过电转化法整合到大肠杆菌中,实现共表达[8,15-16]。主要分为两种,一种是复制子相同的不相容性双质粒,另一种是复制子不同的相容性双质粒。由于目前较难找到复制子不相同的两种载体,因此复制子相同的不相容双质粒系统操作更加简便,更具有实用性[9,14]。杨巍等[14]利用不相容双质粒系统,将DNA撕裂因子的2个亚基DFF45和DFF40基因利用不同抗性不相容双质粒系统在大肠杆菌BL21(DE3)中进行了共表达。范立强等[9]在关于大肠杆菌肉碱脱水酶基因caiB及其辅酶合成因子基因caiE的共表达研究中,对相容和不相容这2种双质粒系统进行了比较,结果证明了2种相容质粒和不相容质粒都能共存于宿主细胞中,其转化子的数量相近;同时证明了含相容质粒菌体的存活率的不恒定性,不相容双质粒系统成功因素主要有有质粒选择、转化和培养时间,对于质粒的选择,既要考虑抗性的不同,还要保证外源基因能高效表达,因此还要为基因工程的下游研究打好基础[17-20]。
本实验采用的是不相容双质粒表达系统,分别构建好pET32a-EG和pET30b-BGL,然后通过电击转化法,将构建好的两种重组质粒转化到制备好的感受态细胞中,通过氨苄和卡那这两种抗生素进行双抗筛选,在双抗的胁迫下,使其两种不相容质粒在同一宿主菌中稳定存在,使两个外源基因在大肠杆菌中首次实现了共同表达,其酶活为1196.8U/m L,比单一酶组分的酶活力要高,通过酶学性质分析显示共表达酶的最适反应pH为6.0,最适反应温度60℃,在pH5~7范围区间内能保持较高的pH稳定性,能够达到最高酶活的80%以上。在30~60℃范围能有较高的温度稳定性,酶活维持在80%以上。这一结果符合纤维素酶的协同学说,内切葡聚糖酶主要作用于纤维素的非结晶区,从还原端或非还原端切下纤维二糖,β-葡聚糖苷酶水解纤维二糖成二个葡萄糖。在本研究中,共表达产生的两种纤维素酶,内切葡聚糖酶和β-葡聚糖苷酶在对可溶性底物羧甲基纤维素钠降解过程中,纤维二糖的生成累积,被β-葡聚糖苷酶降解成了葡萄糖,使得纤维二糖对内切葡聚糖酶的一个反抑制作用减弱了,这就使得其能持续稳定地降解[5-7]。从而使酶活力发挥最大作用。这一研究结果将具有重大的经济价值和工业应用价值,同时为纤维素酶共表达的进一步研究奠定基础。
4 结论
本研究利用pET32a和pET30b两个载体的不同抗性的特性,在大肠杆菌中将β-葡萄糖苷酶基因和内切葡聚糖苷酶基因,实现了不相容性共表达,获得了产两种酶的工程菌,酶活力可达1196.8U/m L。比单一酶组分的酶活力高,酶学性质分析显示共表达酶的最适反应pH为6.0,最适反应温度60℃,在pH 5~7范围内能保持较高活性,酶活可达最高酶活的80%以上。在30~60℃范围能有较高的温度稳定性,酶活维持在80%以上。这一结果将为工业应用的进一步研究提供理论基础。
[1]宋京城,蔡健.纤维素酶在食品工业中的应用[J].农产品加工·学刊,2010(3):69-71.
[2]张明霞,段长青,张文娜.纤维素酶在食品工业中的应用与展望[J].酿酒科技,2005(4):99-100.
[3]闫训友,史振霞,张惟广,等.纤维素酶在食品工业中的应用进展[J].食品工业科技,2004,25(10):140-142.
[4]Escovar-Kousen JM,Wilson D,Irwin D.Integration of computermodelingand initialstudiesofsite-directedmutagenesis to improve cellulase activity on Cel9A from Thermobifida fusca [J].Appl Biochem Biotechnol,2004,113-116:287-297.
[5]高培基.纤维素酶降解机制及纤维素酶分子结构与功能研究进展[J].自然科学进展,2003,13(1):21-29.
[6]Parker A,Maw B,Fedor L.The beta-glucuronidase catalyzed hydrolysis of a glucopyranosiduronamide and a glucopyranoside:evidence for the oxocarbonium ion mechanism for bovine liver beta-glucuronidase[J].Biochem Biophys Res Commun,1981,103(4):1390-1394.
[7]Churilova IV,Maksimov VI,Klesov AA.Cellobiose as a regulator of endoglucanase activity of cellulase complexes.Mechanism of the regulation[J].Biokhimiia,1979,44(11):2100-2102.
[8]庞永奇,贾洪革,方荣祥,等.利用不相容质粒共转化大肠杆菌对Cre重组酶体内重组活性的可视检测[J].微生物学报,2005,45(1):125-128.
[9]范立强,袁勤生,吴祥甫.不相容双质粒共表达大肠杆菌肉碱脱水酶基因caiB及其辅因子合成酶基因caiE[J].中国医药工业杂志,2002,33(3):104-108.
[10]吴振芳,陈惠,曾民,等.内切葡聚糖酶基因在毕赤酵母中高效表达研究[J].农业生物技术学报,2009,17(3):529-535.
[11]朱龙宝,汤斌,陶玉贵,等.黑曲霉β-葡萄糖苷酶基因克隆及在毕赤酵母中分泌表达[J].食品与生物技术学报,2012,31(9):973-977.
[12]Sun J,Phillips CM,Anderson CT,et al.Expression and characterization of the Neurospora crassa endoglucanase GH5-1 [J].Protein Expr Purif,2011,75(2):147-154.
[13]Sommer B,Friehs K,Flaschel E.Efficient production of extracellular proteinswith Escherichia coli bymeans ofoptimized coexpression of bacteriocin release proteins[J].J Biotechnol,2010,145(4):350-358.
[14]杨巍,张岚,卢智刚.利用两种不相容质粒在大肠杆菌中共表达DFF45和DFF40[J].生物化学与生物物理学报,2001,33:238-242.
[15]孙剑,王健琪,翟朝阳.不相容双质粒共表达人内皮抑素及简化人纤溶酶原饼环区5[J].四川大学学报,2006,37(6):839-843.
[16]Ervin SE,Small PA Jr,Gulig PA.Use of incompatible plasmids to control expression of antigen by Salmonella typhimurium and analysis of immunogenicity in mice[J].Microb Pathog,1993,15(2):93-101.
[17]钟声,刘丹平,刘素伟,等.血管内皮生长因子121和骨形态蛋白2双基因共表达重组腺病毒载体的构建及鉴定[J].中国组织工程研究与临床康复,2011,15(20):3741-3744.
[18]王彦,吴奎,毕玉田,等.FasL和Der p2双基因共表达真核表达载体的构建及其在树突状细胞中的表达[J].重庆医学,2010,39(20):2697-2703.
[19]Cheng CY,Yu YJ,Yang MT.Coexpression of omega subunit in E.coli is required for themaintenance of enzymatic activity of Xanthomonas campestris pv.campestris RNA polymerase[J].Protein Expr Purif,2010,69(1):91-98.
[20]Wang F,Qu H,Zhang D,etal.Production of1,3-propanediol from glycerolby recombinant E.coli using incompatible plasmids system[J].Mol Biotechnol,2007,37(2):112-119.

