响应面优化酶法辅助提取金针菇根部多糖的工艺研究
陈贵堂,赵立艳,刘 玮,李 博,綦国红,王岁楼
(1.中国药科大学药学院,江苏南京210009;2.南京农业大学食品科技学院,江苏南京210095)
金针菇(Flammunlina velutipes)为担子菌纲伞菌目金钱菌属,是一种药食两用菌,其子实体含有丰富的多糖、氨基酸和多种维生素(VB1、VB2、VC、Vpp)[1-3]。其中金针菇多糖是金针菇中主要的生物活性成分之一,具有清除自由基、增强记忆力、抑制肿瘤、增强机体免疫力等多种生物学作用[4-9]。随着人们对金针菇营养价值的认识,金针菇的消费量越来越高。同时,产生的金针菇菌柄基部(俗称金针菇根)也越来越多。由于金针菇根中纤维素等成分较多,口感较差,以致售卖前或食用前人们就将其剪下丢弃,造成极大浪费。目前,国内外学者对金针菇功能成分的研究主要集中在其子实体和菌丝体上[10-13],而针对金针菇菌柄基部的研究还鲜有报道。可见,作为一种可再利用资源,如何提高其生产附加值,对其中的多糖类化合物等功能成分进行相关研究具有重要意义,而多糖的提取是多糖研究的关键步骤,也是基础步骤。多糖的提取方法将直接影响到多糖的得率、结构和活性。目前常用的多糖提取方法有热水浸提法、酸浸提法、碱浸提法、微波辅助提取法、超声波辅助提取法以及酶辅助提取法等,其中酶辅助提取法是近年来流行的一种新型多糖提取方法,具有条件温和、杂质易除和得率高等优点,得到了广泛应用[14-17],但利用酶法辅助提取金针菇菌根的研究还未见报道。
因此,本文从有效利用金针菇原材料和生产的角度出发,以金针菇菌柄基部为研究对象,以水为提取介质,在单因素实验的基础上,通过响应面分析法优化了金针菇菌柄基部多糖的酶法辅助提取工艺,确定其最佳工艺参数,旨在为金针菇菌柄基部多糖的提取纯化和生物活性研究提供基础。
1 材料与方法
1.1 材料与仪器
新鲜金针菇 购自江苏南京市场,取其根部,50℃真空干燥,粉碎,过80目筛备用;纤维素酶、木瓜蛋白酶、果胶酶(酶活均为200U/mg) 北京康倍斯科技有限公司;葡萄糖、氢氧化钠 国药集团化学试剂有限公司;浓硫酸、乙醇 南京化学试剂有限公司;苯酚 上海凌峰化学试剂有限公司;牛血清白蛋白 美国Sigma公司;其他试剂 均为国产分析纯;实验用水 为蒸馏水。
TU-1901双光束紫外可见分光光度计 北京普析通用仪器有限公司;HZQ-F160全温振荡培养箱 太仓市实验设备厂;DZF-6050MBE真空干燥箱 上海博讯实业有限公司;HH-8数显恒温水浴锅 国华电器有限公司;RE-5205旋转蒸发仪 上海亚荣生化仪器厂;FW-177中草药粉碎机 天津泰斯特仪器有限公司;XJ-ⅡB离心机 上海安亭科学仪器厂。
1.2 实验方法
1.2.1 多糖含量的测定 多糖的含量采用苯酚-硫酸法[18]进行测定。
多糖提取率(%)=提取液中多糖总质量(g)/样品质量(g)×100
1.2.2 金针菇根部多糖提取方法的筛选 一般来说,食用菌细胞壁主要由纤维素和果胶类物质构成,并且含有较多的蛋白质,故选取纤维素酶、木瓜蛋白酶和果胶酶在酶添加量(质量分数)分别为2%、料液比1∶20及其各自厂家推荐最适作用温度和pH条件下酶解金针菇菌根细粉60m in,然后继续在90℃条件下提取120min,分别考察提取体系中酶的种类对多糖提取率的影响,并以多糖提取率为指标,将不同酶解方法与热水浸提法进行比较,具体方法如下。
准确称取12份样品,每份10g,加入200m L蒸馏水,分为4组进行提取,分别为常规水提法(50℃温水浸泡60m in,然后90℃热水浸提120m in)、纤维素酶辅助提取(添加量2%,pH 4.5,45℃处理60m in,然后再用90℃热水浸提120m in)、木瓜蛋白酶辅助提取(添加量2%,pH4.5,50℃处理60min,然后再用90℃热水浸提120m in)和果胶酶辅助提取(添加量2%,pH 3.5,50℃处理60m in,然后再用90℃热水浸提120m in),测定提取液的多糖含量,通过对比实验选择适宜的提取方法,并对该方法进行单因素与响应面实验优化。
1.2.3 金针菇根部多糖提取工艺的单因素实验 通过单因素实验,分别考察酶添加量、液料比、酶解pH、酶解温度和酶解时间对金针菇根部多糖提取率的影响。酶解时将反应容器置于全温振荡培养箱中,转速设定为120r/min。酶解提取反应完成后将反应容器放入90℃水浴中持续120m in,待液料冷却后通过离心进行汁渣分离。
1.2.3.1 酶添加量对多糖提取率的影响 固定料液比1∶20、酶解温度50.0℃、酶解pH 5.0、酶解时间60m in,调节木瓜蛋白酶添加量分别为质量分数1.0%、1.5%、2.0%、2.5%、3.0%,酶解60min,测定多糖提取率。
1.2.3.2 料液比对多糖浸提率的影响 准确称取10g样品数份,分别按料液比1∶10、1∶20、1∶30、1∶40、1∶50、1∶60加入蒸馏水,调节pH至5.0,升温至50℃,加入0.15g木瓜蛋白酶(质量分数1.5%),酶解60min,测定多糖提取率。
1.2.3.3 pH对多糖提取率的影响 准确称取10g样品数份,固定料液比为1∶20、酶解温度50℃、酶添加量1.5%,分别调节pH至4.0、4.5、5.0、5.5、6.0、6.5,酶解60m in,测定多糖提取率。
1.2.3.4 酶解温度对多糖浸提率的影响 准确称取10g样品数份,固定料液比为1∶20、酶添加量1.5%、酶解pH5.0,分别升温至40、45、50、55、60、65℃,酶解60m in,测定多糖提取率。
1.2.3.5 酶解时间对多糖浸提率的影响 准确称取10g样品数份,固定料液比1∶20、酶添加量1.5%、酶解pH5.0、酶解温度50℃,分别酶解40、60、80、100、120、140、160m in,测定多糖提取率。
1.2.4 金针菇根部多糖提取工艺的响应面实验设计
依据单因素实验结果,根据Box-Benhnken中心组合实验设计原理,选取影响金针菇根部多糖提取率的主要因素酶解pH、酶解温度和酶解时间为实验因素,以多糖提取率为响应值,进行3因素3水平的响应面分析实验,其他工艺条件为料液比1∶20、木瓜蛋白酶酶添加量1.5%。实验因素和水平见表1。
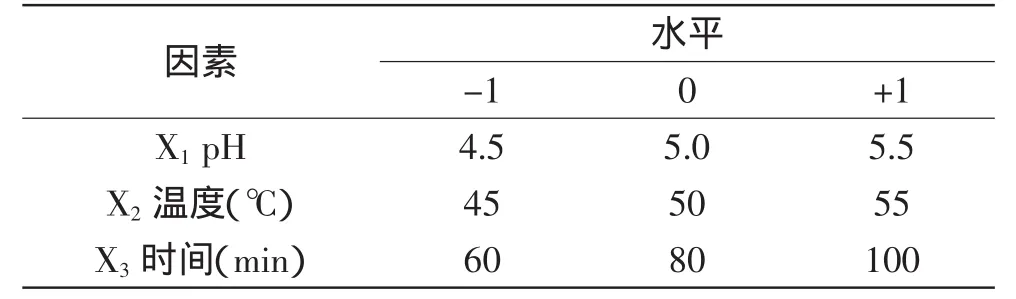
表1 响应面实验的因素和水平编码值Table1 Codes and levels of factors in Box-Behnken design
1.2.5 回归模型验证实验 按照Design Expert 7.0给出的最优参数进行实验,重复3次,计算实验值与理论值之间的误差。
1.2.6 最优提取条件下多糖的得率和纯度以及蛋白质含量测定 准确称取10g样品6份,分别在传统热水提取条件下和最优酶解参数下辅助热水提取,提取液4000r/m in离心后,旋转蒸发浓缩至原体积的1/5,加入3倍体积的无水乙醇,过夜。沉淀经无水乙醇和丙酮洗涤后,干燥得粗多糖,称重,计算多糖得率。并用苯酚-硫酸法测定粗多糖中的多糖质量,计算粗多糖纯度,用考马斯亮蓝染色法[19]测定粗多糖中蛋白质的含量。
多糖得率(%)=粗多糖质量(g)/样品质量(g)×100
多糖纯度(%)=粗多糖中多糖质量(g)/粗多糖质量(g)×100
蛋白质含量(%)=粗多糖中蛋白质质量(g)/粗多糖质量(g)×100
1.2.7 数据分析 响应曲面模型的回归方程式和显著性统计通过Design Expert软件进行计算和分析处理,系数的显著性通过Student t检验和p值进行分析。
2 结果与分析
2.1 不同提取方法对多糖提取率的影响
不同提取方法对金针菇根部多糖的提取效果如图1所示。由图1并结合数据分析可知,不同提取方法的实验结果比较中,木瓜蛋白酶处理的样品多糖提取率显著高于其他方法(p<0.05),且是传统热水浸提法的1.9倍(p<0.01)。说明木瓜蛋白酶是辅助提取金针菇根部多糖的最佳用酶,因此在后续的实验中选用木瓜蛋白酶作为提取多糖的酶试剂。

图1 不同提取方法对多糖提取率的影响Fig.1 Effectof enzymes on the yield of polysaccharide
2.2 单因素实验
2.2.1 酶添加量对多糖提取率的影响 酶添加量对多糖提取率的影响如图2所示。由图2并结合数据分析可知,酶添加量从1%增加到1.5%,多糖的提取率略有增大;当加酶量大于1.5%时,随着酶添加量的增加,多糖提取率的变化无统计学差异,说明在该底物浓度下,酶浓度已经趋于饱和,继续增加酶用量,对多糖提取率没有显著影响。因此,在本实验条件下,金针菇根部多糖酶法辅助提取的最适酶添加量为底物的1.5%。
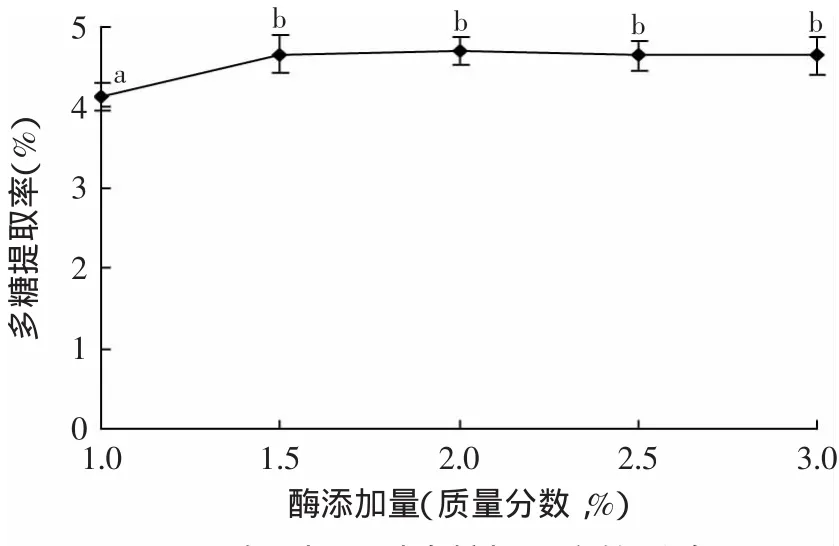
图2 酶添加量对多糖提取率的影响Fig.2 Effectof enzyme concentration on the yield of polysaccharide
2.2.2 料液比对多糖浸提率的影响 不同料液比对多糖提取率的影响如图3所示。由图3并结合数据分析可知,料液比在1∶10到1∶50范围内,多糖提取率变化无统计学差异,说明在本实验条件下,料液比对金针菇根部多糖的提取率影响不显著,本实验选取液料比为1∶20。
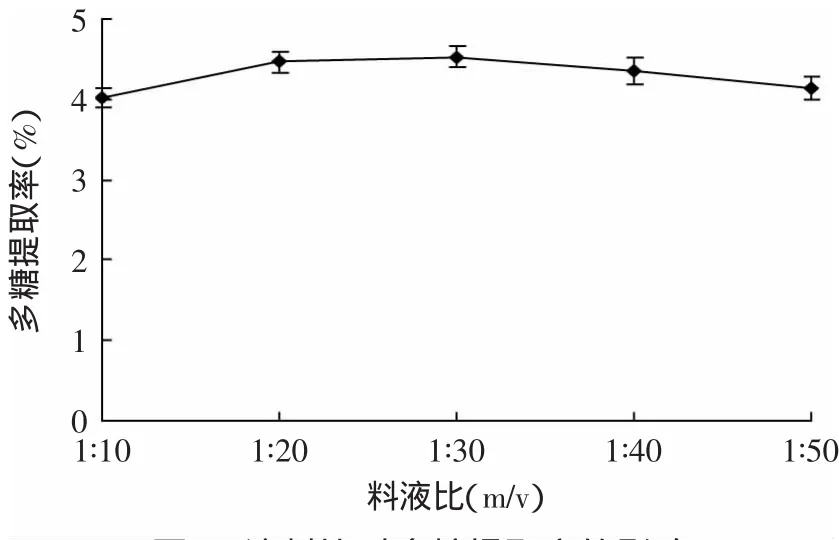
图3 液料比对多糖提取率的影响Fig.3 Effectof the ratio ofmaterial towater on the yield of polysaccharide
2.2.3 pH对多糖提取率的影响 不同pH对多糖提取率的影响结果如图4所示。由图4并结合数据分析可知,pH对金针菇根部多糖的提取率影响显著,在pH4.0~6.5范围内,多糖提取率变化较大,呈现先升高后下降趋势,且pH为5.5时,多糖提取率最高。

图4 酶解pH对多糖提取率的影响Fig.4 Effect of hydrolysis pH on the yield of polysaccharide
2.2.4 酶解温度对多糖浸提率的影响 酶解温度对多糖浸提率的影响结果如图5所示。可知,温度在40~50℃范围内,多糖提取率逐渐上升,在50℃时达到最高;温度在50~65℃范围内,多糖浸提率随着温度升高呈逐渐下降趋势。可知,金针菇根部多糖木瓜蛋白酶辅助提取的最适温度为50℃。
2.2.5 酶解时间对多糖浸提率的影响 酶解时间对多糖浸提率的影响如图6所示。由图6并结合数据分析可知,酶解时间在20~80min的范围内,多糖提取率随时间的增加迅速上升,80m in时达到最高,之后变化开始不明显,可见,金针菇根部多糖木瓜蛋白酶辅助提取的最适时间为80m in。
2.3 响应面优化实验
2.3.1 响应面实验设计及结果 响应面实验设计及结果见表2。
2.3.2 拟合模型的建立与模型方差分析 对表2中数据进行回归拟合,得到自变量与金针菇根部多糖提取率(Y)的二次多项回归方程为:
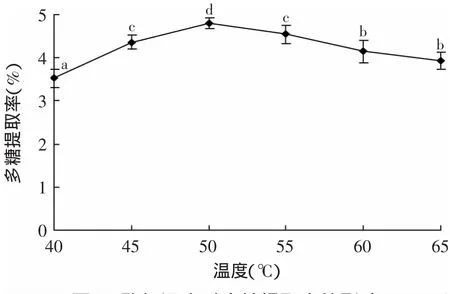
图5 酶解温度对多糖提取率的影响Fig.5 Effectof hydrolysis temperature on the yield of polysaccharide

图6 酶解时间对多糖提取率的影响Fig.6 Effectof hydrolysis time on the yield of polysaccharide
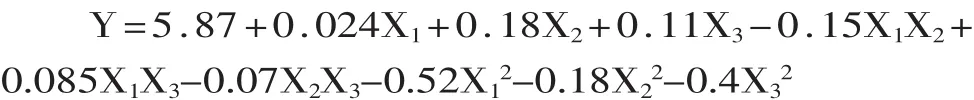
式中,Y为多糖提取率(%);X1为pH;X2为酶解温度(℃);X3为酶解时间(min)。
对模型的方差分析结果见表3。分析结果表明,对金针菇根部多糖提取率所建立的二次多项式模型具有高度显著性(p<0.0001),方程负相关系数的平方(R2)为0.9881,失拟项不显著(p=0.1120),R= 0.9727,说明建立的模型能够解释97.27%响应值的变化,能很好的描述金针菇根部细粉提取过程中多糖提取率随提取条件的变化规律,可以用此模型对多糖的提取率进行分析和预测。
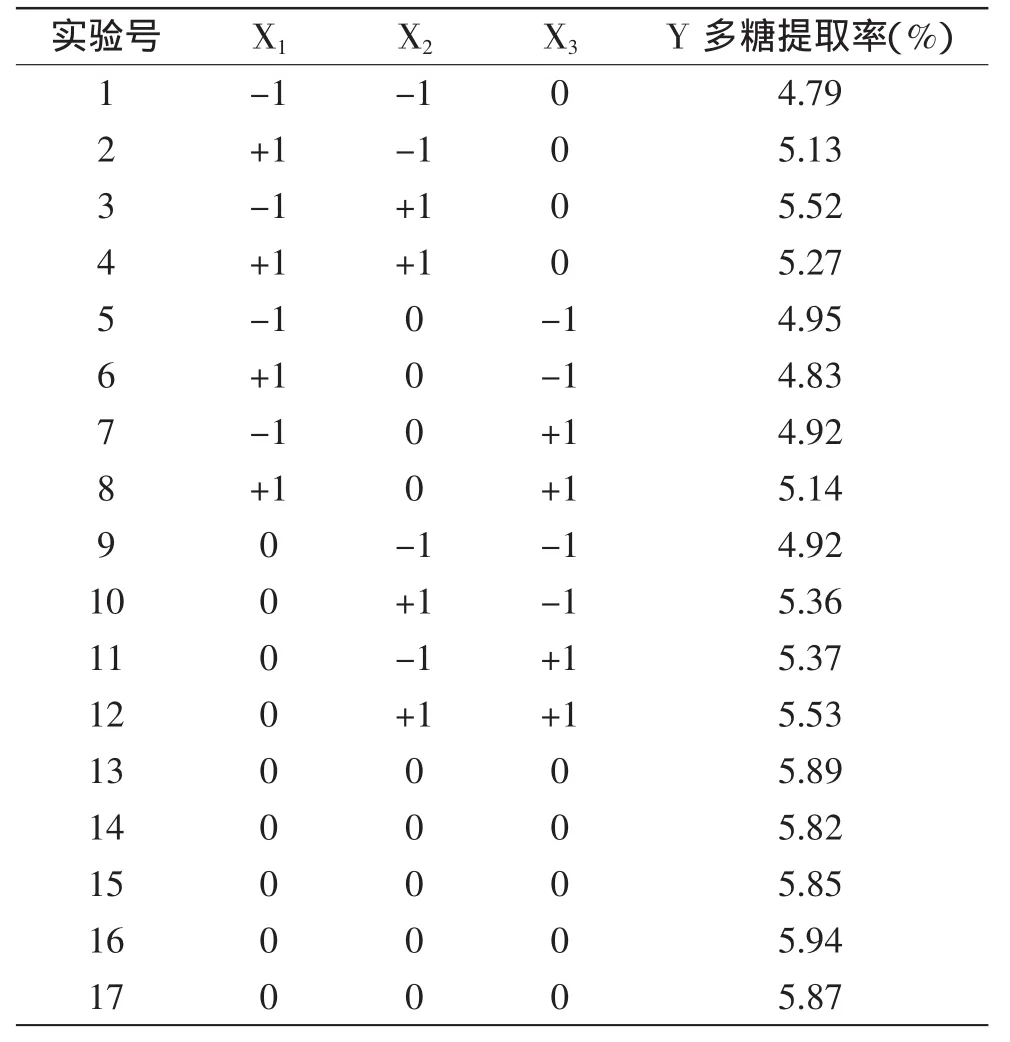
表2 响应面实验验设计及结果Table2 Design and results of response surface experiments

表3 回归模型方差分析Table3 Variance analysis of regression equation
由表3可以看出,酶解法辅助提取金针菇根部多糖的工艺参数中,影响多糖提取率的因素按主次顺序排列为酶解温度(X2)>酶解时间(X3)>酶解pH(X1)。在所选各因素水平范围内,X2、X3、X1X2、X1X3、X、X、X对Y的影响显著。由此可见,实验因素对响应值的影响不呈简单的线性关系,交互项和二次项对响应值也有较大的影响作用。
2.3.3 响应面分析 根据回归方程,固定1个因素在零水平上,研究另外2个因素间的交互效应,作响应曲面图,分析各影响因素对多糖提取率的影响以及各因素间的交互效应,如图7(a~c)所示。各图显示提取pH、提取温度和提取时间中任意1个变量取零水平时,其余2个变量对多糖提取率的影响。从图7中可以看出,除图a中温度的变化外,其余的均是任意1个因素取零水平,其余2个因素同时变化时,随着二者的增加,多糖提取率均呈现先上升后下降的趋势。其中,图7(a)和图7(b)的曲面较为陡峭,表明酶解pH和酶解温度、酶解pH和酶解时间之间均有较强的交互作用。

图7 两因素交互影响金针菇根部多糖提取率的响应面图Fig.7 Response surface plot showing the effectof every two factors interaction on the yield of polysaccharide
2.3.4 模型的优化和验证 通过Design Expert 7.1.3分析得到木瓜蛋白酶辅助提取灰树花根部多糖的最佳酶解条件为pH5.48,温度52.54℃、时间81.85min,在此条件下多糖提取率的预测值为5.925%。为检验实验结果是否可靠,根据最优条件进了验证实验,为方便实际操作,选取酶解pH为5.5、酶解温度52℃、酶解时间82min,在此条件下进行三次平行实验。将修正后的优化条件代入回归方程,得到多糖的理论提取率为5.93%,而实际测得多糖的平均提取率为5.90%,与模型预测值基本一致,充分说明了该模型能够较好地模拟和预测金针菇根部多糖的酶辅助提取条件与多糖提取率之间的关系,同时也说明了酶解工艺参数的可行性。
2.4 多糖的得率和纯度
在最优酶解工艺参数下提取金针菇根部多糖,提取液经醇沉和干燥后,测定多糖得率和多糖纯度,结果如表4所示。可见,与传统的热水浸提法相比,木瓜蛋白酶辅助提取金针菇根部多糖的多糖得率和多糖纯度均极显著升高,分别达到9.34%和67.3%;而蛋白质含量则极显著降低。

表4 多糖得率和纯度Table4 Obtain rate and purity of polysaccharide
3 结论
本研究采用木瓜蛋白酶酶解新工艺提取金针菇根部多糖,该工艺通过酶水解破坏菌体细胞结构,有效酶解与多糖结合在一起的蛋白质,将多糖释放出来,从而提高多糖提取率,同时又能降低多糖中蛋白质的含量,提高多糖纯度。
为优化酶解法提取多糖工艺条件,本实验通过单因素实验和响应面实验设计,得到影响金针菇根部多糖提取率的工艺因素按主次顺序排列为酶解温度(X2)>酶解时间(X3)>酶解pH(X1)。最终确定最佳提取工艺条件为木瓜蛋白酶添加量1.5%、料液比1∶20、酶解pH为5.5、酶解温度52℃、酶解时间82m in,在此最佳条件下,多糖的提取率为5.90%,得率为9.34%,多糖纯度为67.3%,蛋白质含量为5.3%,均极显著优于传统的热水浸提法。
[1]蔡和晖,廖森泰,叶运寿,等.金针菇的化学成分、生物活性及加工研究进展[J].食品研究与开发,2008(11):171-174.
[2]Kalac P.Chemical composition and nutritional value of European species of wild growing mushrooms:a review[J].Food Chemistry,2009,113(1):9-16.
[3]向莹,陈健,金鑫.金针菇菌盖与菌柄的营养评价[J].食品工业科技,2012,33(10):349-352,368.
[4]Smiderle RF,CARBONEROR,SASSAKIGL.Characterization ofaheterogalactan:Somenutritionalvaluesof theediblemushroom Flammulina velutipes[J].Food Chemisty,2008,108:329-333.
[5]Yang W,Pei F,Shi Y,et al.Purification,characterization and anti-proliferation activity of polysaccharides from Flammulina velutipes[J].Carbohydrate Polymers,2012,88:474-480.
[6]邹宇晓,廖森泰,吴娱明,等.金针菇多糖提取物对记忆障碍模型大鼠、小鼠学习记忆能力的影响[J].中国食品学报,2010(1):26-30.
[7]Zhang M,Cui SW,Cheung PCK,et al.Antitumor polysaccharides from mushrooms:a review on their isolation process,structural characteristics and antitumor activity[J].Trends in Food Science and Technology,2007,18(1):4-19.
[8]Jeurink PV,Noguera CL,Savelkoul HFJ,et al.Immunomodulatory capacity of fungal proteins on the cytokine production of human peripheral blood mononuclear cells[J].International Immunopharmacology,2008,8(8):1124-1133.
[9]傅明辉,洪梅达.金针菇子实体多糖的抗氧化活性的研究[J].食品研究与开发,2011,32(12):20-22.
[10]冯昆,张东杰,张涧铮,等.金针菇多糖提取条件的优化[J].黑龙江八一农垦大学学报,2005,17(5):73-75.
[11]Yang W,Fang Y,Liang J,et al.Optimization of ultrasonic extraction of Flammulina velutipes polysaccharidesand evaluation of its acetylcholinesterase inhibitory activity[J].Food Research International,2011,44:1269-1275.
[12]姜宁,刘晓鹏,吴红江,等.金针菇菌丝体多糖超声提取工艺的研究[J].食品科学,2008,29(8):289-292.
[13]孔晓雪,安辛欣,赵立艳,等.金针菇水溶性多糖物理提取工艺及优化[J].食品科学,2010,31(24):230-235.
[14]杨蓉生,陈炼红,唐俊妮,等.复合酶法提取红雪茶粗多糖工艺优化研究[J].食品工业科技,2012,33(12):285-288.
[15]高明侠,苗敬芝,曹泽虹,等.壳聚糖固定化木瓜蛋白酶提取牛蒡多糖的研究[J].食品科学,2007,28(9):227-229.
[16]张帅,沈楚燕,董基.酶法提取猴头菇多糖的研究[J].河南工业大学学报:自然科学版,2011,31(2):76-79.
[17]吕长鑫,李萌萌,徐晓明,等.响应面分析法优化纤维素酶提取紫苏多糖工艺[J].食品科学,2013,34(2):6-10.
[18]彭会军,雷清凤,杨春亮,等.落葵水溶性多糖的提取工艺研究[J].食品研究与开发,2008,29(12):9-11.
[19]Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(7):248-254.

