水杨酸和牛血清白蛋白的相互作用研究及共存铜离子的影响
王旭,吴淑春,王家学,郑青,郭玉华
(1.浙江医学高等专科学校,杭州 310053;2.湖州师范学院生命科学学院,浙江 湖州 313000)
水杨酸和牛血清白蛋白的相互作用研究及共存铜离子的影响
王旭1,吴淑春1,王家学1,郑青2,郭玉华2
(1.浙江医学高等专科学校,杭州 310053;2.湖州师范学院生命科学学院,浙江 湖州 313000)
目的 研究铜离子对水杨酸与血清白蛋白相互作用的影响。方法 采用荧光光谱技术研究了不同温度下水杨酸与牛血清白蛋白(BSA)的相互作用及铜离子对水杨酸-BSA体系的影响。结果 运用理论模型处理实验数据,得到水杨酸与牛血清白蛋白(BSA)的猝灭常数、结合常数、结合力类型等相互作用参数。结论 铜离子存在时,不改变水杨酸对BSA内源荧光的猝灭类型和水杨酸-BSA分子间作用的类型,但使水杨酸与BSA的表观结合常数增大。
水杨酸;牛血清白蛋白;铜离子;荧光光谱法
水杨酸是临床常用药物,有抗真菌和溶解角质等多效药理活性。常用药物“阿司匹林”即乙酰水杨酸,在生物体内能很快被转化为水杨酸。血清白蛋白是血浆中最为丰富的蛋白质,能与多种内源或外源性物质结合,起到存储与转运的作用[1]。铜是生命体中所必须的微量元素,同时作为各种金属酶的活性中心是生物体内载氧蛋白活性部位的基本成分[2-3]。药物小分子与血清白蛋白之间的复合物通常是借助于分子间作用力而形成的超分子化合物,而体内的微量金属元素既可能与药物小分子形成配合物,也可能影响蛋白质-药物超分子体系[4-5]。故从不同角度研究蛋白质-药物之间及其在金属离子存在情况下的结合反应,有助于了解药物在体内的运输和分布情况,对于阐明药物的运输、毒性、代谢过程及了解蛋白质的结构与功能关系具有重要意义。
因牛血清白蛋白(BSA)与人血清白蛋白高度同源,已被广泛用作蛋白质模型化合物进行研究[6]。荧光光谱法是研究生物大分子,特别是蛋白质与各种有机小分子、离子和无机化合物相互作用的重要手段[2,7-8]。为了深入考察铜离子对水杨酸与蛋白质之间的相互作用的影响,本实验用荧光光谱研究铜离子对水杨酸与牛血清白蛋白(BSA)相互作用的影响,运用理论模型处理实验数据得到猝灭常数、结合常数、结合力类型等重要相互作用参数。
1 材料与方法
1.1 仪器与试剂
FP-6200 型荧光分光光度计(日本Jasco公司);Finnpipette移液器(上海雷勃分析仪器有限公司) 5~50 µL,20~200 µL;TB-85型超级恒温器(日本Shimadzu公司);UPWS-10T超纯水器(杭州永洁达净化科技有限公司);AB265-S电子分析天平(瑞典METTER TOLEDO公司)。
BSA溶液:以0.05 mol·L-1、pH=7.4的Tris-HCl溶液配制,以0.10 mol·L-1NaCl维持离子强度,浓度为1.0×10-4mol·L-1。水杨酸溶液:以0.05 mol·L-1、pH=7.4的Tris-HCl溶液配制,浓度为1.0× 10-3mol·L-1。CuCl2溶液:以0.05 mol·L-1、pH=7.4的Tris-HCl溶液配制,浓度为1.0×10-3mol·L-1。
BSA为生化试剂,购于华东医药集团有限公司。水杨酸、三羟基氨基甲烷(Tris)(纯度≥99.9%)、HCl(浓度为36%~8%)、NaCl(含量≥99%)、CuCl2(含量≥99%)均为分析纯;实验用水为超纯水器处理的超纯水。
1.2 实验方法
BSA荧光激发和发射光谱的测定:移取一定量BSA溶液于石英比色皿中,设置发射波长为280 nm,狭缝宽度为5 nm,在室温(298 K)下绘制250~350 nm的荧光激发光谱,测得其最大激发波长为282 nm;并在其最大激发波长处设置狭缝宽度为5 nm,在室温(298 K)下绘制300~500 nm的荧光发射光谱,得到荧光发射光谱的最大发射波长为345 nm。
不同浓度水杨酸对BSA的荧光滴定:在一系列10.0 mL比色管中,准确移取2.0 mL BSA 溶液,用微量注射器加入不同体积的水杨酸溶液,加Tris-HCl溶液定容至10.0 mL,作用1 h后,在最大激发波长为282 nm处,在280~500 nm内扫描BSA的荧光发射光谱。
铜离子存在时不同浓度水杨酸对BSA的荧光滴定:在一系列10.0 mL比色管中,准确移取2.0 mL BSA溶液,用微量注射器加入200 µL的CuCl2溶液,用微量注射器加入不同体积的水杨酸溶液,加Tris-HCl溶液定容至10.0 mL,作用1 h后,在最大激发波长为282 m处,在280~500 nm内扫描BSA的荧光发射光谱。
2 结果与讨论
2.1 荧光猝灭现象
蛋白质分子中的色氨酸、酪氨酸和苯丙氨酸等氨基酸残基在一定波长的紫外光激发下能够发出荧光。因苯丙氨酸的荧光非常弱,所以荧光信号主要来自色氨酸和酪氨酸。故蛋白质的天然荧光及其变化直接反映了蛋白质中色氨酸、酪氨酸残基本身和周围环境的变化[9]。
在无Cu2+存在的情况下,随着水杨酸浓度的不断增加,BSA的内源荧光强度逐渐降低,但激发峰和发射峰的峰形基本不变,结果见图1。Cu2+对水杨酸与牛血清白蛋白作用的荧光有协同猝灭作用,随着水杨酸浓度的增加,BSA的内源荧光降低的强度更大,但激发峰和发射峰的峰形基本不变,结果见图2。同时,图1和图2在409 nm左右均出现了一个荧光发射峰,且发射峰的强度随着水杨酸浓度的增加而增强,这是溶液中游离的水杨酸产生的[10]。

图1 水杨酸-BSA的荧光猝灭图a→j-水杨酸浓度依次为:0,0.25,0.5,0.75,1.0,1.25,1.5,1.75,2.0,2.5 mol·L-1Fig 1 Fluorescence quenching of salicylic acid-BSA a→j-the concentration of salicylic acid: 0.0, 0.25, 0.5, 0.75, 1.0, 1.25, 1.5, 1.75, 2.0, 2.5 mol·L-1

图2 水杨酸-BSA-Cu2+的荧光猝灭图a→j-水杨酸浓度依次为:0,0.25,0.5,0.75,1.0,1.25,1.5,1.75,2.0,2.5 mol·L-1Fig 2 Fluorescence quenching of salicylic acid-BSA-Cu2+a→j-the concentration of salicylic acid: 0.0, 0.25, 0.5, 0.75, 1.0, 1.25, 1.5, 1.75, 2.0, 2.5 mol·L-1
2.2 猝灭机制
引起BSA荧光猝灭的原因可能是动态猝灭或静态猝灭。前者是一种能量转移或电子转移过程,不影响蛋白质的结构和生理活性。后者则是由于发生了配合作用,通常是产生了不发荧光的配合物,对蛋白质的二级结构可产生影响,并可影响其生理活性。为了判断水杨酸引起的BSA荧光猝灭是动态猝灭还是静态淬灭,根据猝灭效率遵循的Stern-Volmer方程:
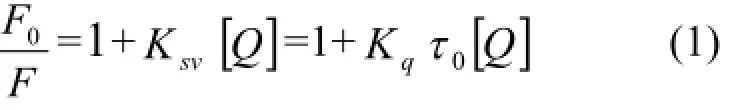
式中F0和F分别表示未加入和加入猝灭剂时的相对荧光强度,Ksv表示动态猝灭常数,Kq表示双分子猝灭过程的速率常数,τ0为不存在猝灭剂分子时荧光分子的平均寿命(τ0=10-8s),[Q]表示猝灭剂的浓度。作F0/F~[Q]关系图,得到不同温度下Ksv的值见表1。

表1 不同温度下水杨酸与BSA的荧光猝灭常数Ksv及线性相关系数rTab 1 Quenching constants Ksv, correlation coefficient r of salicylic acid-BSA at different temperatures
由(1)式知Kq=Ksv/τ0,由表1中Ksv计算得Kq,Kq的数量级为1012,远大于各类猝灭剂对生物大分子最大扩散碰撞猝灭速率常数2.0× 1010L·mol-1·s-1[11],且Ksv随着温度的升高有所减小,由此断定不管Cu2+存在与否,水杨酸对BSA的猝灭不是由于分子间碰撞引起的动态猝灭,而是由于形成不发光复合物的静态猝灭。
从表1中水杨酸对BSA的猝灭常数Ksv可知,Cu2+存在时,对水杨酸与牛血清白蛋白作用的荧光有协同猝灭作用,能提高水杨酸与BSA的结合能力,猝灭常数Ksv比Cu2+不存在时大,表明Cu2+对BSA的内源荧光猝灭效应有所增强,Cu2+可能参与了BHA-BSA形成配合物的作用过程。

表2 不同温度下水杨酸与牛血清白蛋白配合物的离解常数KD与结合常数KLBTab 2 Dissociation costants KDand binding constants KLBof salicylic acid-BSA at different temperatures
2.3 结合常数
在静态猝灭中,结合常数KLB与荧光强度、猝灭剂浓度之间的关系可以用 Lineweaver-Burk双倒数方程表示[8]:
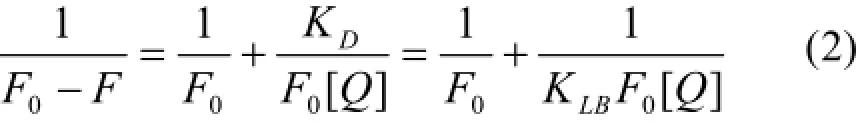
金属离子直接影响药物与蛋白质的结合,不同金属离子对不同药物分子与蛋白质结合有截然不同的两种影响:一是对药物与蛋白质结合有减小作用[12-13],二是对药物与蛋白质的结合有增强作用[7-8]。一般认为,前者主要是由于金属离子与蛋白质的作用,导致蛋白质与药物结合的紧邻区域构型发生改变,从而削弱了药物与蛋白质的结合;后者则主要是由于金属离子同时与药物和蛋白质结合,在药物和蛋白质分子间形成“离子架桥(metal ionbridge)”,从而起到增强作用。Cu2+的存在使BSA与水杨酸的结合常数略有增大,属于第2种情况。这个过程中,Cu2+的参与降低了药物小分子的游离浓度,这样便增强了药物与蛋白质的结合力,对延长药物作用时间、减小药物毒性的临床治疗是有效的。
2.4 水杨酸与BSA之间作用力的推测
一般情况下,药物小分子与蛋白质大分子间的非共价相互作用属分子间的弱相互作用,包括氢键、范德华力、静电和疏水等多种相互作用形式,当温度变化不大时,可将焓变视为常数。根据热力学公式可计算药物小分子与生物大分子结合过程的有关热力学参数:

由热力学参数可简单判断其结合作用类型[14]:若ΔH>0及ΔS>0,则主要表现为疏水作用;ΔH<0及ΔS>0主要表现为静电作用;ΔH<0及ΔS<0主要表现为氢键或范德华力。根据实验得到不同温度下各体系的KLB值,由此求出其结合过程的热力学参数,见表3。

表3 不同温度下水杨酸-BSA作用过程的热力学参数Tab 3 Thermodynamic parameters of salicylic acid-BSA at different temperatures
由实验结果的热力学参数显示,有无Cu2+存在下,水杨酸与BSA结合过程均为ΔG<0、ΔS>0,表明其作用过程是一个熵增加,自由能减小以静电引力为主的自发过程。但多数情况下,有机小分子与蛋白质的反应是多种作用力协同作用的结果。
3 结论
荧光光谱实验表明,在水溶液中,由于水杨酸与BSA的结合而对BSA荧光产生了静态猝灭作用;铜离子存在时,不改变水杨酸对BSA内源荧光的猝灭类型,但使水杨酸与BSA的表观结合常数增大。有无Cu2+存在下,水杨酸与BSA结合过程均为ΔG<0、ΔS>0,表明其作用过程是一个熵增加,自由能减小以静电引力为主的自发过程。
REFERENCES
[1] YANG P. Introduction to Bioinorganic Chemistry(生物无机化学导论) [M]. Xi’an: Xi’an Jiaotong University Press, 1991: 164.
[2] SHAIKH S M T, SEETHARAMAPPA J, ASHOKA S, et al. A study of the interaction between bromopyrogallol red and bovine serum albumin by spectroscopic method [J]. Dyes and Pigments, 2007, 73(2): 211-216.
[3] ROY A S, TRIPATHY D R, GHOSH A K, et al. An alternate mode of binding of the polyphenol quercetin with serum albumins when complexed with Cu(II) [J]. Journal of Luminescence, 2012, 132(11): 2943–2951.
[4] ULRICH K H. Molecular aspects of ligand binding to serum albumin [J]. Pharmacol Rev, 1981, 33(1): 17-53.
[5] MOSTAFA S, EI SADEK M, ALLA E A. Spectrophotometric determination of ciprofloxacin, enrofloxacin and pefloxacin through charge transfer complex formation [J]. J Pharm Biomed Anal, 2002, 27(1/2): 133-142.
[6] YU Y M, FENG J C, LIU Y. Spectroscopic study of the interaction between sulfamethoxazole and bovine serum albumin in the presence of Fe3+[J]. Acta Chim Sin(化学学报), 2011, 69(2), 190-198.
[7] WANG N, YE L, ZHAO B Q , et al. Spectroscopic studies on the interaction of efonidipine with bovine serum albumin [J]. J Med Biol Res, 2008, 41(7): 589-595
[8] GUO M, WANG W, ZHOU J Z, et al. Study on the interaction between paclitaxe-l iron(III) and bovine serum albumin [J]. Chem Res Appl(化学研究与应用), 2008, 20(4): 457-460
[9] SHAO S, QIU J. Effecting of metal ions on the interaction between zidovudine and bovine serum albumin [J]. Acta Phys-Chim Sin(物理化学学报), 2009, 25(7): 1342-1346.
[10] YU T Z,TAO Z Y. Fluorescence study on the interaction of salicylic acid and human serum albumin [J]. Spectrosc Spect Anal(光谱学与光谱分析), 1999, 19(3): 453-455.
[11] LAKOWICZ J R, WEBER G. Quenching of fluorescence by oxygen. Probe for structural fluctuations in macromolecules [J]. Biochemistry, 1973, 12(21): 4161-4170.
[12] LIU X F, XIA Y M, FANG Y, et al. Interaction between natural pharmaceutical homologues of coumarin and bovine serum albumin [J]. Acta Chim Sin(化学学报), 2004, 62: 1484-1490
[13] FEI Y, LU G C, FANG G R, et al. Studies on interaction of sinafloxacin with bovine serum albumin and effect of the coexistent metal ions on the reaction [J]. Spectrosc Spect Anal(光谱学与光谱分析), 2008, 28(11), 2609-2614.
[14] ROSS P D, SUBRAMANIAN S. Thermodynamics of protein association reactions: forces contributing to stability [J]. Biochemistry, 1981, 20(11), 3096-3102.
Interaction of Salicylic Acid with Bovine Serum Albumin and the Effect of Coexistent Cu2+on the Reaction
WANG Xu1, WU Shuchun1, WANG Jiaxue1, ZHENG Qing2, GUO Yuhua2
(1.Zhejiang Medical College, Hangzhou 310053, China; 2.Faculty of Life Science, Huzhou Teachers College, Huzhou 313000, China)
OBJECTIVE To investigate the interactions of salicylic acid and bovine serum albumin (BSA) in the presence of Cu2+. METHODS The interaction between salicylic acid and BSA was investigated using fluorescence at different temperatures. The effect of Cu2+on the salicylic acid-BSA system was also researched. RESULTS The quenching constants, binding constants and binding force type were measured according to theory model. CONCLUSION The presence of Cu2+doesn’t change quenching type and force type between salicylic acid and BSA, but the apparent association constant(KLB) becomes higher.
salicylic acid; bovine serum albumin; Cu2+; fluorescence spectrometry
R913
A
1007-7693(2013)10-1066-05
2012-12-25
浙江省自然科学基金项目(LQ12B03001);浙江医学高等专科学校一般研究计划项目(2013B04)
王旭,女,博士,副教授 Tel: (0571)87692890 E-mail: wangxu.linda@163.com

