小分子PIM 激酶抑制剂的研究进展
郑小洲,金晓磊,赵临襄
(沈阳药科大学 基于靶点的药物设计与研究教育部重点实验室,辽宁 沈阳110016)
1 PIM 激酶的结构
PIM-1 基因最早作为莫洛尼小鼠白血病病毒的前病毒整合位点(proviral integration site of moloney murine leukemia virus)而得名。PIM 激酶家族有3 名成员:PIM-1、PIM-2 和PIM-3 激酶,同属于丝氨酸/苏氨酸蛋白激酶。它们的氨基酸序列具有同源性:PIM-1 和PIM-2 为61%,PIM-1 和PIM-3 为71%[1-2]。目前,PIM-1 和PIM-2 激酶研究得较多,而关于PIM-3 的晶体结构未见报道。
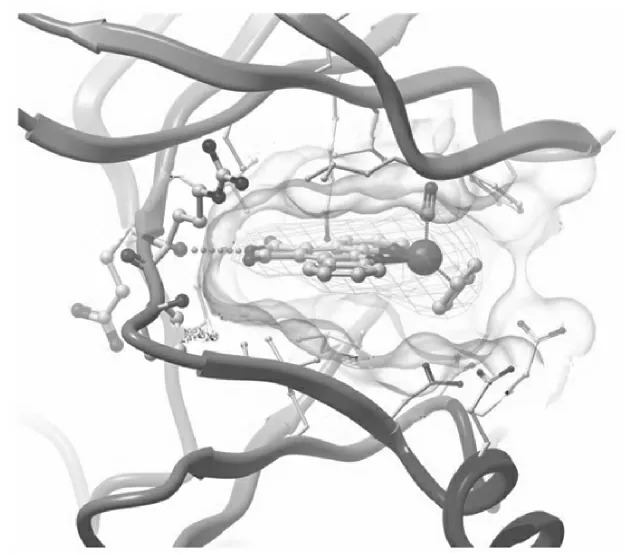
Figure 1 Inhibitor interactions in the ATP pocket[4]
PIM-1 激酶有34 kDa 和44 kDa 两种,其中以44 kDa 的激酶为主。PIM-1 是典型的双叶型激酶结构,N 端主要是反向平行的β 折叠,C 端主要是α 螺旋,N 端和C 端两个结构域通过短的铰链区连接。这两个结构域之间接口处的口袋构成了活性部位(图1),包含铰链区(残基122-127)、N 末端结构域中富含甘氨酸的环(残基44-52)和C 末端结构域中的活化环(残基186-210)[3-4]。PIM-2 激酶有34 kDa、38 kDa 和40 kDa 三种,其中以34 kDa 的激酶为主。PIM-2 也是典型的双叶型蛋白质结构,具有与PIM-1 相似的活性口袋。
2 PIM 激酶与肿瘤
PIM 激酶通过多种机制影响肿瘤细胞的存活和增殖:PIM-1 和转录因子c-myc 对前列腺癌和淋巴瘤的形成具有协同作用,PIM-1 在c-myc 基因诱导的小鼠前列腺癌中高表达[5];PIM-1 磷酸化BAD 蛋白Ser112 位点(BAD 蛋白失活的门控位点),使BAD 蛋白失去促凋亡活性;PIM 激酶可以调节细胞周期,诱导细胞的增殖,例如:PIM-1 磷酸化细胞周期磷酸酯酶CDC25A 并增强其活性,促进细胞G1/S 期的进程;PIM-1 激酶介导细胞周期抑制剂p27Kip1和p21cip1/WAP1的磷酸化作用,抑制PCNA(增殖细胞核抗原)与p21cip1/WAP1结合,促进细胞G1 期和G2/M 期的进程[6-7];PIM 激酶既可以正向调节STAT3 和Wnt 信号传导通路,也可正向调节NFκB 信号传导系统,从而促进细胞增殖。
3 小分子PIM 激酶抑制剂
3.1 咪唑并[1,2-b]哒嗪类和三唑并[4,3-b]哒嗪类化合物
Chen 等[8]发现咪唑并[1,2-b]哒嗪类化合物(图2)有很好的可改造性和成药性。其中最具代表性的是K00135 和SGI-1776。在小鼠Ba/F3 细胞激酶试验中,K00135 对PIM-1 和PIM-2 有良好的抑 制 作 用,IC50分 别 为0.12 μmol·L-1和1.8 μmol·L-1[9]。化合物SGI-1776 对B 细胞慢性淋巴细胞性白血病(B-CLL)具有凋亡诱导作用(PIM-1,IC50= 7 nmol·L-1;PIM-2,IC50=363 nmol·L-1;PIM-3,IC50= 69 nmol·L-1)。2008 年11 月,FDA 批准SuperGen 公司开始SGI-1776 的Ⅰ期临床试验,由于试验中出现了心脏QTc 间期延长的现象,2010 年11 月该化合物的临床试验被迫终止。之后Blanco-Aparicio 等[10]发现ETP-39010 是一种有效的PIM 激酶抑制剂(PIM-1,IC50= 130 nmol·L-1;PIM-2,IC50=420 nmol·L-1;PIM-3,IC50=79 nmol·L-1)。
Grey 等[11]通过对咪唑并哒嗪母核的改造,得到了三唑并[4,3-b]哒嗪类化合物,例如化合物1 和2(图3)。将化合物1 的环己基对位引入羟基(化合物2)可以明显改善物理性质:clogP=2.8,clogD7.4=3.9,溶解度为170 μmol·L-1,MDCK 渗透性为35.3/49.0。多种激酶活性测试发现,化合物2 对PIM-1 具有良好的抑制活性和高度选择性(PIM-1,Ki<5 nmol·L-1)。
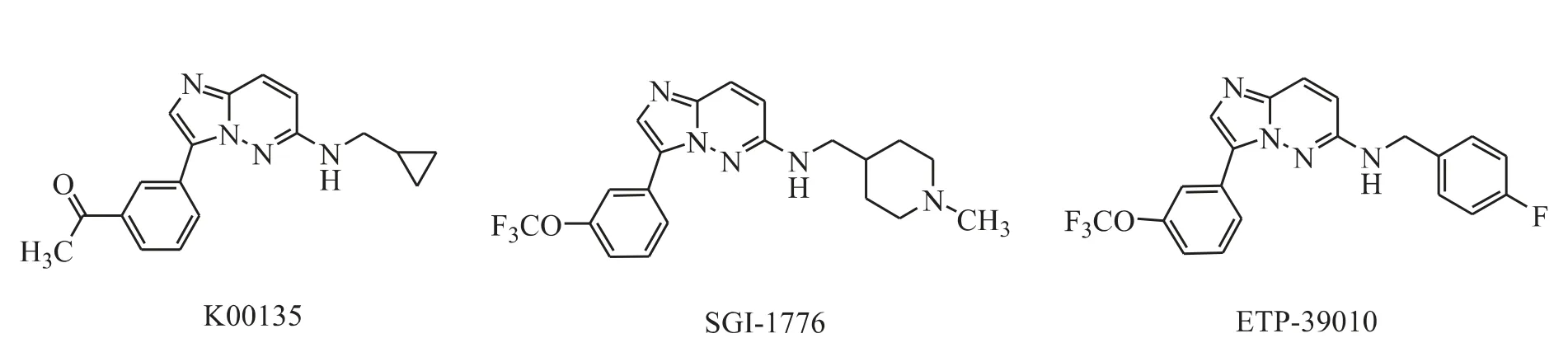
Figure 2 Imidazo[1,2-b]pyridazines as PIM kinase inhibitors

Figure 3 1,2,4-triazolo[4,3-b]pyridazines as PIM kinase inhibitors
3.2 苯并[c][2,6]萘啶类化合物
苯并[c][2,6]萘啶类化合物CX-4945(图4)作为首个CK2 激酶的ATP 竞争性抑制剂已进入临床试验[12]。通过对238 种激酶进行抑制活性筛选,Siddiqui-Jain 等[13]发现该化合物还具有PIM-1激酶抑制活性(CK2,IC50= 0.001 μmol·L-1;PIM-1,IC50=0.046 μmol·L-1)。Pierre 等[14]对CX-4945 的结构进行修饰,设计并合成了一系列结构类似的化合物(图4),由急性髓性白血病细胞株MV-4-11 的抗增殖实验可知,这类化合物均有较好的PIM 激酶抑制活性。例如化合物3(CK2,IC50>0.5 μmol·L-1;PIM-1,IC50= 0.027 μmol·L-1;PIM-2,IC50=0.018 μmol·L-1)。构效关系表明:C-7位引入三氮唑(化合物3)使CK2 活性减弱,PIM-1活性增强,从而选择性抑制PIM-1 激酶;C-5 位的2'-氯苯胺或2'-氟苯胺使活性提高到纳摩尔级,如化合物4(PIM-1,IC50=0.005 μmol·L-1;PIM-2,IC50=0.003 μmol·L-1;PIM-3,IC50=0.057 μmol·L-1);将母核A 环换成五元环,如吡咯、噻吩、咪唑等[15],既可保持对PIM 激酶的抑制活性,也恢复了对CK2 激酶的抑制活性。以化合物5 为例,对PIM-1、PIM-2 和CK2 的IC50值 分 别 为0.003、0.002、0.009 μmol·L-1。
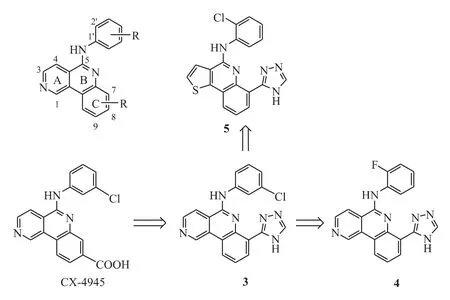
Figure 4 Benzo[c][2,6]naphthyridines as PIM kinase inhibitors
3.3 苯亚甲基联噻唑烷类化合物
经过高通量筛选,Beharry 和Xia 等[16-17]发现了苯亚甲基联噻唑烷类PIM 激酶抑制剂。对50多种蛋白激酶活性筛选后发现这类化合物对PIM激酶有高选择性。在此基础上,Dakin 等[18]设计并合成了一系列苯亚甲基联噻唑烷-2,4-二酮衍生物,例 如化合物6(PIM-1,IC50=0. 024 μmol·L-1;PIM-2,IC50=0.1 μmol·L-1)、化合物7(PIM-1,IC50=0.15 μmol·L-1;PIM-2,IC50=0.02 μmol·L-1)、化 合 物8 (PIM-1,IC50<0.004 μmol·L-1,PIM-2,IC50= 0.05 μmol·L-1,PIM-3,IC50<0.003 μmol·L-1),上述化合物6 ~8 的结构见图5。

Figure 5 Benzylidene-linked thiazolidines as PIM kinase inhibitors
3.4 苯并[4,5]噻吩并[3,2-d]嘧啶酮类化合物
Tao 等[19]通过高通量筛选发现:苯并[4,5]噻吩并[3,2-d]嘧啶酮类化合物(图6)对K562和MV4-11 细胞具有有效的抗增殖活性,例如化合物9(PIM-1,Ki=63 nmol·L-1;PIM-2,Ki=160 nmol·L-1)。该类化合物构效关系如下:2 位引入二甲氨基甲基,化合物对PIM-1 和PIM-2 的活性增加,例如化合物10(PIM-1,Ki=14 nmol·L-1;PIM-2,Ki=63 nmol·L-1);2 位引入羟基吡咯烷基,化合物对PIM-1 和PIM-2 活性保持(与化合物10 相比),如化合物11(PIM-1,Ki=5 nmol·L-1;PIM-2,Ki=29 nmol·L-1);8 位引入疏水性强的环丙乙烯基可大大增加化合物的PIM-1 和PIM-2 抑制活性,如化合物12(PIM-1,Ki=1 nmol·L-1;PIM-2,Ki=2 nmol·L-1);8 位引入苯基取代基可以明显增强PIM 激酶抑制活性,其中抑制活性大小为:对羟基苯基>间羟基苯基>邻甲基苯基,如化合物13(PIM-1,Ki= 2 nmol·L-1;PIM-2,Ki= 3 nmol·L-1,PIM-3,Ki=0.5 nmol·L-1)。

Figure 6 3H-Benzo[4,5]thieno[3,2-d]pyrimidin-4-ones as PIM kinase inhibitors
3.5 酰腙类化合物

Figure 7 Acylhydrazones as PIM kinase inhibitors
Chang 等[20]为了得到对W10 小鼠B-淋巴瘤细胞株有细胞毒性的化合物,通过高通量筛选发现了3 个结构类似的酰腙类化合物21A8、21H7和65D4(图7),它们对W10 细胞的LD50值为0.4 ~1.0 μmol·L-1,而对正常细胞无显著影响,其中65D4 能最有效地抑制癌细胞存活。为了改善65D4 的水溶性,对其A、B、C 三个区域进行了结构改造(图7):包括将A 区域的苯环换成嘧啶环,并在间位引入吗啡啉基团;变化连接吗啡啉环碳链的长度;在C区域引入羟基和卤素。经过结构改造得到了21 种对前列腺癌细胞生长有抑制作用的化合物,其中M110 对DU-145 细胞抑制活性最好,IC50=0.9 μmol·L-1。激酶活性筛选实验结果表明:M110 是高选择的PIM 激酶抑制剂(PIM-1,IC50= 2.5 μmol·L-1;PIM-2,IC50=2.5 μmol·L-1,PIM-3,IC50= 0.05 μmol·L-1);M110 对上皮细胞瘤有效,可以抑制前列腺癌衍生细胞株的增殖(IC50<1 μmol·L-1),而对正常的人外周血液淋巴细胞作用较小(IC50值达到40 μmol·L-1)。
3.6 苯并呋喃-2 羧酸类化合物
Xiang 等[21]通过高通量筛选发现苯并呋喃-2羧酸类化合物(图8)有PIM 激酶抑制活性,例如化合物14(PIM-1,IC50=8.5 μmol·L-1)和化合物15(PIM-1,IC50=5.8 μmol·L-1)。化合物14的5 位溴和2 位羧基是活性必需基团,通过结构优化得到了高活性的PIM 激酶抑制剂,如化合物16(PIM-1,IC50= 0.020 μmol·L-1PIM-2,IC50=0.19 μmol·L-1)、化 合 物 17 (PIM-1,IC50=0.001 μmol·L-1;PIM-2,IC50=0.004 μmol·L-1)、化合物18(PIM-1,IC50= 0.019 μmol·L-1;PIM-2,IC50=0.066 μmol·L-1)。
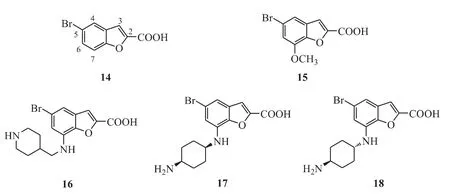
Figure 8 Benzofuran-2-carboxylic acids as PIM kinase inhibitors
3.7 吡咯并咔唑类化合物
Akue-Gedu 等[22]发现了吡咯并[2,3-a]咔唑类PIM 激酶抑制剂(图9)。对66 种激酶进行活性筛选,发现化合物19 是最强的PIM 激酶抑制剂(PIM-1,IC50=0.12 μmol·L-1;PIM-2,IC50=0.51 μmol·L-1;PIM-3,IC50=0.01 μmol·L-1)。Letribot 等[23-24]在化合物19 的C 环N-10 上引入取代基,虽然抑制活性变化不大,但改善了化合物的渗透性。在人类纤维原代培养细胞(Fibro)和3 种实体瘤细胞株(PC3、DU145 和PA1)的体外实验中,这类化合物的抗增殖活性都在低微摩尔级,如化合物20(Fibro,IC50=0.63 μmol·L-1;PC3,IC50= 0.65 μmol·L-1;DU145,IC50=0.96 μmol·L-1;PA1,IC50=0.486 μmol·L-1)。Giraud 等[25]将化合物19 的C-3 位醛基去掉,并在C-4 位上引入了甲氧羰基得到了化合物21,其对PIM-1 和PIM-3 激酶有抑制活性(PIM-1,IC50=3 μmol·L-1;PIM-3,IC50=0.5 μmol·L-1),且显示出微摩尔级的抗增殖活性(Fibro,IC50=8 μmol·L-1;PC3,IC50=6 μmol·L-1;DU145,IC50>50 μmol·L-1;PA1,IC50=27 μmol·L-1)。

Figure 9 Pyrrolo[2,3-a]carbazoles as PIM kinase inhibitors
3.8 吲哚酮类化合物

Figure 10 Oxindoles as PIM kinase inhibitors
Haddach 等[26]通过高通量筛选发现吲哚酮类化合物(图10)具有PIM-1 激酶抑制活性,例如化合物22(PIM-1,IC50=0.386 μmol·L-1)。并且从同类化合物中发现,内酰胺的NH 作为氢键供体是PIM 激酶活性必需基团,在NH 上引入甲基PIM 激酶活性消失。吲哚环上5 位用氯原子取代可以加强PIM 激酶活性,而F 取代则活性降低。通过MV-4-11(人类AML 细胞)抗增殖活性筛选发现了活性更好的化合物23(PIM-1,IC50=5 nmol·L-1;PIM-2,IC50=25 nmol·L-1;PIM-3,IC50=16 nmol·L-1)。
4 结语
本文从结构特征、作用机制及小分子抑制剂的研究进展三个方面对PIM 激酶进行了总结。PIM 激酶通过多种机制影响肿瘤细胞的增殖和存活:PIM 激酶与转录因子协同作用,促进肿瘤细胞增殖;PIM 激酶也可通过磷酸化凋亡蛋白BAD和ASK1 来增加细胞存活;PIM 激酶通过调节多种细胞周期因子来调节细胞周期,诱导细胞的增殖;PIM 激酶通过调节细胞信号通路,增强细胞存活能力。总之,PIM 激酶在肿瘤的形成和发展过程中发挥着重要作用。尽管目前还没有PIM 激酶抑制剂上市,但关于小分子PIM 激酶抑制剂的研究越来越多,这些研究成果将推动新靶点抗肿瘤药物向前发展。
[1] BRAULT L,GASSER C,BRACHER F,et al. PIM serine/threonine kinases in the pathogenesis and therapy of hematologic malignancies and solid cancers[J].Haematologica,2010,95(6):1004 -1015.
[2] NAWIJN M C,ALENDAR A,BERNS A.For better or for worse:the role of PIM oncogenes in tumorigenesis[J].Nat Rev Cancer,2010,11(1):23 -34.
[3] BULLOCK A N,DEBRECZENI J E,FEDOROV O Y,et al.Structural basis of inhibitor specificity of the human protooncogene proviral insertion site in moloney murine leukemia virus(PIM-1)kinase[J].J Med Chem,2005,48(24):7604 -7614.
[4] BULLOCK A N,RUSSO S,AMOS A,et al.Crystal structure of the PIM2 kinase in complex with an organoruthenium inhibitor[J/OL]. PLoS One,2009,4(10):e7112.
[5] ELLWOOD-YEN K,GRAEBER T G,WONGVIPAT J,et al. Myc-driven murine prostate cancer shares molecular features with human prostate tumors[J].Cancer Cell,2003,4(3):223 -238.
[6] HOGAN C,HUTCHISON C,MARCAR L,et al.Elevated levels of oncogenic protein kinase PIM-1 induce the p53 pathway in cultured cells and correlate with increased Mdm2 in mantle cell lymphoma[J].J Biol Chem,2008,283(26):18012 -18023.
[7] MORISHITA D,KATAYAMA R,SEKIMIZU K,et al. PIM kinases promote cell cycle progression by phosphorylating and down-regulating p27Kip1 at the transcriptional and posttranscriptional levels[J].Cancer Res,2008,68(13):5076 -5085.
[8] CHEN L S,REDKAR S,BEARSS D,et al.PIM kinase inhibitor,SGI-1776,induces apoptosis in chronic lymphocytic leukemia cells[J].Blood,2009,114(19):4150 -4157.
[9] POGACIC V,BULLOCK A N,FEDOROV O,et al.Structural analysis identifies imidazo[1,2-b]pyridazines as PIM kinase inhibitors within vitroantileukemic activity[J]. Cancer Res,2007,67(14):6916 -6924.
[10] BLANCO-APARICIO C,COLLAZO A M,OYARZABAL J,et al. PIM-1 kinase inhibitor ETP-45299 suppresses cellular proliferation and synergizes with PI3K inhibition[J]. Cancer Lett,2011,300(2):145 -153.
[11] GREY R,PIERCE A C,BEMIS G W,et al. Structure-based design of 3-aryl-6-amino-triazolo[4,3-b]pyridazine inhibitors of PIM-1 kinase[J]. Bioorg Med Chem Lett,2009,19(11):3019 -3022.
[12] PIERRE F,CHUA P C,O'BRIEN S E,et al.Discovery and SAR of 5-(3-chlorophenylamino)benzo[c][2,6]naphthyridine-8-carboxylic acid(CX-4945),the first clinical stage inhibitor of protein kinase CK2 for the treatment of cancer[J]. J Med Chem,2011,54(2):635 -654.
[13] SIDDIQUI-JAIN A,DRYGIN D,STREINER N,et al.CX-4945,an orally bioavailable selective inhibitor of protein kinase CK2,inhibits prosurvival and angiogenic signaling and exhibits antitumor efficacy[J].Cancer Res,2010,70(24):10288 -10298.
[14] PIERRE F,STEFAN E,NEDELLEC A S,et al.7-(4H-1,2,4-Triazol-3-yl)benzo[c][2,6]naphthyridines:a novel class of PIM kinase inhibitors with potent cell antiproliferative activity[J]. Bioorg Med Chem Lett,2011,21(22):6687 -6692.
[15] PIERRE F,REGAN C F,CHEVREL M C,et al.Novel potent dual inhibitors of CK2 and PIM kinases with antiproliferative activity against cancer cells[J].Bioorg Med Chem Lett,2012,22(9):3327 -3331.
[16] BEHARRY Z,ZEMSKOVA M,MAHAJAN S,et al.Novel benzylidene-thiazolidine-2,4-diones inhibit PIM protein kinase activity and induce cell cycle arrest in leukemia and prostate cancer cells[J]. Mol Cancer Ther,2009,8(6):1473 -1483.
[17] XIA Z,KNAAK C,MA J,et al. Synthesis and evaluation of novel inhibitors of PIM-1 and PIM-2 protein kinases[J].J Med Chem,2009,52(1):74 -86.
[18] DAKIN L A,BLOCK M H,CHEN H,et al. Discovery of novel benzylidene-1,3-thiazolidine-2,4-diones as potent and selective inhibitors of the PIM-1,PIM-2,and PIM-3 protein kinases[J]. Bioorg Med Chem Lett,2012,22(14):4599 -4604.
[19] TAO Z F,HASVOLD L A,LEVERSON J D,et al.Discovery of 3H-benzo[4,5]thieno[3,2-d]pyrimidin-4-ones as potent,highly selective,and orally bioavailable inhibitors of the human protooncogene proviral insertion site in moloney murine leukemia virus(PIM)kinases[J]. J Med Chem,2009,52(21):6621 -6636.
[20] CHANG M,KANWAR N,FENG E,et al. PIM kinase inhibitors downregulate STAT3Tyr705 phosphorylation[J]. Mol Cancer Ther,2010,9(9):2478 -2487.
[21] XIANG Y,HIRTH B,ASMUSSEN G,et al.The discovery of novel benzofuran-2-carboxylic acids as potent PIM-1 inhibitors[J]. Bioorg Med Chem Lett,2011,21(10):3050 -3056.
[22] AKUE-GEDU R,NAUTON L,THERY V,et al.Synthesis,PIM kinase inhibitory potencies andinvitroantiproliferative activities of diversely substituted pyrrolo[2,3-a]carbazoles[J]. Bioorg Med Chem,2010,18(18):6865 -6873.
[23] LETRIBOT B,AKUE-GEDU R,SANTIO N M,et al.Use of copper(I)catalyzed azide alkyne cycloaddition(CuAAC)for the preparation of conjugated pyrrolo[2,3-a]carbazole PIM kinase inhibitors[J].Eur J Med Chem,2012,50(4):304 -310.
[24] AKUE-GEDU R,LETRIBOT B,SAUGUES E,et al.Kinase inhibitory potencies andin vitroantiproliferative activities of N-10 substituted pyrrolo[2,3-a]carbazole derivatives[J].Bioorg Med Chem Lett,2012,22(11):3807 -3809.
[25] GIRAUD F,AKUE-GEDU R,NAUTON L,et al.Synthesis and biological activities of 4-substituted pyrrolo[2,3-a]carbazole PIM kinase inhibitors[J].Eur J Med Chem,2012,56(10):225 -236.
[26] HADDACH M,MICHAUX J,SCHWAEBE M K,et al. Discovery of CX-6258. A potent,selective,and orally efficacious pan-PIM kinases inhibitor[J].ACS Med Chem Lett,2012,3(2):135 -139.