螺内脂降低大鼠心肌非梗死区MMP/TIMP基因转录及表达
王全志,杨 旸,陈惠军,杨廷桐*
(1.中国人民解放军第371 中心医院检验病理科,河南新乡453003;2.南方医科大学南方医院介入科,广东广州510515;3.新乡医学院附属新乡市中心医院内儿康复科,河南新乡453000)
心肌缺血导致心肌细胞功能严重障碍[1],一旦心肌梗死发生后,细胞外基质(extracellularmatrix,ECM)异常在心室重构中发挥着重要作用。药物干预对ECM 的影响机制目前仍有争议,有研究[2]认为降低基质金属蛋白酶(matrix metalloproteinases)/基质金属蛋白酶抑制因子(matrix metalloproteinase inhibitor)的比值对ECM 有影响,可以减轻肺纤维化;但也有否认观点[3]。因此,本研究建立大鼠心肌梗死模型,观察螺内脂对大鼠心肌非梗死区MMP/TIMP 失衡的影响及其可能机制,为临床防治心肌梗死提供新思路和可能的基因治疗靶点。
1 材料与方法
1.1 材料
1.1.1 心肌梗死模型建立[4]与实验分组:60 只清洁级雄性Wistar 大鼠,12 ~15 周龄,体质量210 ~230 g,(河南省实验动物中心,scxk 豫2005-0001)。模型制备参照文献[1]。将术后48 h存活的大鼠分为1)对照组;2)心肌梗死组;3)心肌梗死+药物组,每组20 只。心肌梗死+药物组48 h采用灌胃法给螺内酯[20 mg/(kg·d)]。对照组与心肌梗死组均喂等容量0.9%氯化钠注射液。
1.1.2 取材:3 组分别于心肌梗死模型成功后的48 h、7、14 及28 d取材,每组各时间点分别取5 只大鼠。用3%戊巴比妥钠腹腔麻醉,迅速开胸,取出心脏,冰上操作,4 ℃经高压处理的DEPC 水中洗去残余血液。剪取左室非梗死区心肌组织约100 mg分成两块,一块置于液氮速冻后,于-80 ℃冰箱保存。按照Trizol (Gibco 公司)说明书提取总RNA,溶于20 μL DEPC 处理水中,用于反转录PCR(RTPCR)。另一块用于HE 染色和免疫组化(IHC)分析。
1.1.3 试剂:MMP-2、MMP-9、TIMP-2 免疫组化试剂盒(武汉博士德和北京中杉试剂公司)。
1.1.4 引物合成:由上海生物工程公司合成。MMP-2 引物序列(400 bp):上游:5'-CCATGTGTCT TCCCCTTCAC-3',下游:5'-CGATGCCATCAAAGAC AATG-3';MMP-9 引物序列(486 bp):上游:5'-GCC GGGAACGTATCTGGAAAT-3',下游引物:5'-TCACC CGGTTGTGGAAACTC-3';TIMP-2 引物序列(442 bp):上游:5'-TCTTTCATCATGAGGCAGAGG-3',下游:5'-GGAAGGGATGTCAAAGCTGGA-3'。大鼠β-actin 引物序列(375 bp):上游:5'-GCCATGTACGTAGCC ATCCA-3',下游5'-GAACCGCTCATTGCCGATAG-3'。
1.2 方法
1.2.1 IHC 方法:按试剂盒说明书进行,设置阳性及阴性对照。阳性表达为胞质内棕黄色。采用图像分析软件系统进行分析,每个样本选取5 张切片,每张切片在400 倍光镜下选取3 个视野进行测量,计算出平均吸光度值(average absorbance value)。
1.2.2 RT-PCR:按照试剂盒说明书进行。采用Trizol 一步法提取总RNA,取1 μL 总RNA 以10 μL体系反转录制备cDNA,稀释30 倍置于-20 ℃冰箱中备用。PCR 扩增反应体系为25 μL:cDNA 2 μL,引物10 μmol/L,Taq 酶1.25 U。反应条件:94 ℃预变性3 min,94 ℃35 s,62 ℃40 s,72 ℃1 min,30 个循环,72 ℃5 min,4 ℃保存。
1.3 统计学分析
采用SSPS12.0 统计软件,数据用目的基因/βactin 吸光度值表示,平均吸光度值用均值±标准差(±s)表示,组间比较采用t 检验。
2 结果
2.1 心肌梗死动物模型建立成功标志
心电图改变及心脏大体出现心尖部暗红色梗死区。
2.2 IHC 结果
梗死组MMP-2、MMP-9 活性增强,在14 d达到高峰(P<0.01),28 d有回降但仍高于对照组(P<0.05)。梗死+药物组中MMP-2 及MMP-9 的活性较对照组高,但比梗死组下降(P<0.05)。而梗死+药物组在48 h显著高与对照组(P<0.05),(表1,图1)。
2.3 非梗死区MMP-2、MMP-9 及TIMP-2 基因的表达
MMP-2、MMP-9 及TIMP-2 基因改变与蛋白表达基本一致(表2,图2)。
3 讨论
心肌梗死发生后ECM 的变化对心肌预后重构具有重要作用[5],MMP 与TIMP 参与了ECM 的改变。心肌细胞的再生随时间演进而迅速消失[6],因此,心肌梗死后胶原蛋白的成分降解和增长就成为心室重构的病理基础。抑制心肌组织中MMP-2 和MMP-9 可以进一步改善心脏功能[7],由此可见MMPs/TIMP 的比值在ECM 的变化中起决定性作用。
表1 MMP-2、MMP-9 及TIMP-2 蛋白在大鼠心肌非梗死区的表达Table 1 Expression of MMP-2、MMP-9 and TIMP-2 in myocardial noninfarct area of rat(positive area/total area ×100%,±s,n=20)

表1 MMP-2、MMP-9 及TIMP-2 蛋白在大鼠心肌非梗死区的表达Table 1 Expression of MMP-2、MMP-9 and TIMP-2 in myocardial noninfarct area of rat(positive area/total area ×100%,±s,n=20)
*P<0.05,**P<0.01 compared with control;#P<0.05 compared with infarction.
groupprotein48 hours7 days14 days28 days controlMMP-26.25 ±0.426.37 ±0.516.02 ±0.436.01 ±0.16 MMP-95.56 ±0.125.67 ±0.295.68 ±0.135.59 ±0.46 TIMP-29.56 ±0.178.86 ±1.289.62 ±1.639.11 ±1.46 infarctionMMP-210.36 ±1.03*16.62 ±1.35*21.29 ±1.52**16.60 ±1.46*MMP-99.86 ±1.1315.42 ±1.15*20.89 ±1.42**15.76 ±1.64*TIMP-210.86 ±1.63*15.42 ±1.75*23.21 ±1.12**21.78 ±1.74**infarction+drugMMP-29.68 ±1.7113.25 ±1.43#15.19 ±1.56#11.49 ±1.31#MMP-98.28 ±1.3312.27 ±1.33#14.58 ±1.46#10.46 ±1.63#TIMP-211.21 ±1.4318.27 ±1.63#25.18 ±1.56#22.76 ±1.63
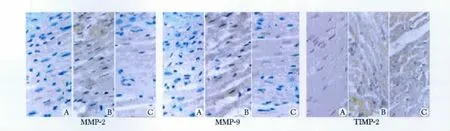
图1 2 周时MMP-2、MMP-9 和TIMP-2 免疫组化染色(×200)Fig 1 MMP-2、MMP-9 and TIMP-2 immunohistochemisty staining 2 weeks (×200)
表2 MMP-2、MMP-9 和TIMP-2 在非梗死区不同时间段的表达Table 2 Expression of MMP-2,MMP-9 and TIMP-2 mRNA in noninfarcted area at different time(±s,n=20)

表2 MMP-2、MMP-9 和TIMP-2 在非梗死区不同时间段的表达Table 2 Expression of MMP-2,MMP-9 and TIMP-2 mRNA in noninfarcted area at different time(±s,n=20)
*P<0.05,**P<0.01 compared with control group;#P<0.05 compared with Infarction group.
groupprotein48 hours7 days14 days28 days controlMMP-20.09 ±0.000.09 ±0.010.09 ±0.010.09 ±0.01 MMP-90.09 ±0.010.09 ±0.010.09 ±0.020.09 ±0.02 TIMP-20.11 ±0.180.10 ±0.380.09 ±0.230.11 ±0.87 infarctionMMP-20.11 ±0.02*0.15 ±0.02*0.23 ±0.01**0.22 ±0.02*MMP-90.11 ±0.010.16 ±0.02*0.24 ±0.01**0.21 ±0.02*TIMP-20.28 ±0.03*0.31 ±0.09*0.29 ±0.06**0.28 ±0.02**infarction+drugMMP-20.11 ±0.010.14 ±0.020.17 ±0.02#0.15 ±0.02#MMP-90.12 ±0.020.15 ±0.020.18 ±0.02#0.15 ±0.02#TIMP-20.29 ±0.040.46 ±0.05#0.31 ±0.03#0.29 ±0.04

图2 2 周时大鼠非梗死中MMP-2、MMP-9、TIMP-2 mRNA RT-PCR 结果Fig 2 Result of MMP-2,MMP-9 and TIMP-2 mRNA RT-PCR of myocardial noninfarct area in rat 2 weeks
本研究动态观察了心肌梗死发生发展过程中MMP-2、MMP-9 及TIMP-2 的变化。在对照组中MMP-2、MMP-9 及TIMP-2 均有表达。在梗死组中MMP-2、MMP-9 表达迅速增加,而TIMP-2 表达增加速度迟缓,导致MMP-2、MMP-9 与TIMP-2 比值失调,心肌组织被破坏。引起心肌梗死后发生心室重构的主要时间点是在14 ~28 d以内。临床上应严密关注此期的心脏变化。而在28 d以后TIMP-2 逐渐升高,对MMP-2、MMP-9 起到一定抑制作用。
本研究进一步说明MMP-2 与MMP-9 明显升高严重影响了心功能。而MMP-2 转基因小鼠模型能够独立引起心室重塑和心功能不全[8],则为MMPs与心室重塑的关系提供了更确切的证据。
螺内酯属于醛固酮拮抗剂,可降低心肌梗死后心力衰竭和重度心力衰竭的死亡率[7],显示了拮抗醛固酮对心脏毒害作用的重要性和醛固酮拮抗剂在治疗心力衰竭中的地位。螺内酯与氯沙坦及其联合治疗均可显著降低非梗死区心肌胶原沉积及I/Ⅲ型胶原比值,抑制胶原的增生[9]。然而,在心肌梗死后的心室重构中,醛固酮拮抗剂对非梗死区胶原重构的影响是否与MMPs/TIMP 的比值有关,尚不清楚。本实验发现梗死+药物组中MMP-2及MMP-9 的表达在同一时间点上比梗死组显著降低,提示螺内酯可以降低MMP-2 及MMP-9 的表达,升高TIMP-2 的表达,减轻心肌梗死时由于ECM 的破坏而导致严重的心肌破坏与重构。螺内酯抑制心肌梗死后的心室重构可能是通过调节MMPs/TIPMP 的比值起作用[10]。
本研究也发现TIMP-2 在梗死组的各个时间点也增高,可能的机制是TIMP-2 与MMP-2 存在共有AP-2 反式作用因子[11]。在梗死+药物组中TIMP-2表达在各个时间点与梗死组相比有轻度增高,说明螺内酯对TIMP-2 也有直接或间接的作用。MMP-2及MMP-9 的表达和活性过度增强或MMP-2、MMP-9/TIMP-2 比例失调是导致心室重构和后期心功能恶化的重要因素[12]。该研究也为临床防治心肌梗死的心室重构提供了依据。
[1]Anneche T,Chappe D,ChenC,et al.Sevoflurane preserves the endothelial glycocalyx against ischaemia reperfusion injury[J].Br J Anaesth,2010,104:414-421.
[2]刘斌,张玉华,魏路清,等.阿托伐他汀对肺纤维化大鼠MMP-9 和TIMP-1 表达的影响[J].基础医学与临床,2011,31:90-91.
[3]Huhu R,Heinen A,Weber NC,et al.Ischaemic and morphine in duced post-conditioning:impack of MK(ca)channels[J].Br J Anaesth,2010,105:589-595.
[4]刘振,刘玲玲,杨廷桐.两种大鼠心肌梗死模型的比较研究[J].动物医学进展,2010,31:19-25.
[5]Soinale FG,Wilbur NM.Matrix metalloproteinase therapy in heart failure[J].Curr Treat Options Cardiovasc Med,2009,11:339-346.
[6]Porrello ER,Mahoud AL,Simpson E,et al.Transient regenerative potantial of the neonatal mouse heart[J].Science,2011,331:1078-1080.
[7]孔一慧,曹荣元,张莉,等.β-肾上腺素能受体激动剂和抑制剂对心衰大鼠心室MMP-2 和MMP-9 表达的影响[J]。基础医学与临床,2010,30:1177-1183.
[8]BergmanMR,Teerlink JR,MahimkarR,et al.Cardiac matrix metalloproteinase-2 expression independently in-ducesmarked ventricular remodeling and systolic dysfunc-tion[J].Am J PhysiolHeartCirc Physio l,2007,292:H1847-H1860.
[9]董士民,白洁,刘坤申.螺内酯、氯沙坦及两者合用对急性心肌梗死大鼠心肌胶原重建、醛固酮合成酶基因及胶原mRNA 表达的影响[J].中国病理生理杂志,2006,22:1839-1842.
[10]Rude MK,Duhaney TA,Kuster GM,et al.Aldosterone stimulates matrix metalloproteinases and reactive oxygen species in adult rat ventricular cardiomyocytes hypertension[J],2005,46:555-561.
[11]Nagase H,Visse R,Murphy G.Structure and function of matrix metalloproteinases and TIMPs[J].Cardiovasc Res,2006,69:562-573.
[12]Yang D,Ma S,Li D,et al.Angiotensin Ⅱreceptor blockade improves matrx metalloproteinases/tissue inhibitor of matrix balance and restores fibronectin expression in rat infarcted myocardium[J].Biochem Biophys Commun,2009,388:606-611.

