盐酸纳美芬对大鼠颅脑创伤后Survivin表达的影响
张兴超,张绍政,彭龙锋,曲绍霞,姜京超,高培龙
生存素(Survivin)是近来新发现的一种凋亡抑制基因,在正常成人组织中不表达,而在颅脑损伤后高表达,具有抑制细胞凋亡的作用[1]。盐酸纳美芬在颅脑创伤后具有神经保护作用,但其机制尚不清楚[2]。本研究采用自由落体法大鼠颅脑创伤模型,观察盐酸纳美芬对大鼠颅脑创伤后伤侧脑组织Survivin、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)蛋白表达和细胞凋亡的影响,以探讨其发挥神经保护作用的可能机制。
材料与方法
1 主要仪器和试剂
Epics XL流式细胞仪(美国Becman-Coulter公司),BI2000图像分析系统(成都泰盟科技有限公司);Caspase-3 P20多克隆抗体(兔抗)、Survivin多克隆抗体(兔抗)为Santa Cruz公司产品,SP试剂盒(抗兔IgG)和DAB显色试剂盒购自北京中杉金桥生物技术有限公司,盐酸纳美芬注射液(成都天台山制药有限公司,国药准字H20080645)。
2 实验动物及分组
选取健康雄性Wistar大鼠,无特定病原体(SPF)级,体质量(260±20)g[由甘肃省中医学院动物实验中心提供,动物质量合格证号为SCXK(甘)2004-007],随机分为假手术组(6只)、颅脑创伤组(36只)及纳美芬治疗组(36只)。假手术组在伤后1d取材,余两组均在伤后1、2、3、5、7、14d分别取材,每时间点各6只。
3 动物模型的建立
采用Feeney法制作颅脑创伤模型[3]。实验动物用戊巴比妥钠(60mg/kg)腹腔注射麻醉后,头部固定于立体定向仪上,沿中线切开头皮,剥离骨膜,暴露右顶骨,用牙科钻在冠状缝后1.5mm、中线旁2.5mm处钻孔并扩大为一直径5mm骨窗,保持硬膜完整。用40g砝码分别于25cm高处沿外周导管坠落,致右顶叶脑挫裂伤,硬膜外置明胶海绵止血,骨蜡封闭骨窗,缝合头皮。按分组规定的时间点断头取脑。假手术组除不打击外,其它步骤同上。治疗组于颅脑创伤后立即一次性皮下注射盐酸纳美芬(0.1mg/kg)[4]。
4 免疫组织化学技术检测Survivin、Caspase-3表达
大鼠断头取脑,用4%中性多聚甲醛液固定,常规石蜡包埋,以视交叉和乳头体中部为切面行冠状切片,片厚5μm。采用SP法检测Survivin和Caspase-3的表达(按SP法步骤进行),阴性对照为不加一抗。在光镜下观察Survivin、Caspase-3免疫反应的结果,阳性染色定位于胞浆和(或)核膜,呈黄色。采用BI-2000图像分析系统进行图像定量分析。Survivin和Caspase-3免疫组化染色标记强度用光密度值(optical density,OD)表示,比较各组OD值。
5 流式细胞仪检测神经细胞凋亡
取损伤灶处新鲜脑组织约100~150mg,于磷酸缓冲液(PBS)中匀浆,匀浆后组织用400目筛网过滤,滤液放离心管中,1000r/min离心5min,PBS洗2次,再加70%乙醇固定,4℃过夜。次日离心去上清,PBS洗1次,加1ml碘化丙啶(PI)染液(浓度为50μg/ml,含生理盐水32.4ml,PI 2.5mg,核糖核酸酶(Rnase)0.5mg,聚乙二醇辛基苯基酸(Triton-X-100)0.25ml,枸橼酸钠50mg,加蒸馏水至50ml),4℃避光条件下染色30min。应用Epics XL流式细胞仪记录氩离子激发光波长488nm处红色荧光,每个样本计数10 000个细胞,以细胞凋亡的百分率为检测指标。
6 统计学处理
结 果
1 神经细胞凋亡率的变化
颅脑创伤组各时相点神经细胞凋亡率均较假手术组增高,伤后2d达高峰,此后逐渐下降,但直至伤后14d仍显著高于假手术组水平(P<0.05)。纳美芬治疗组各时相点细胞凋亡率较颅脑创伤组均明显降低(P<0.05)(见图1、表1)。
2 Survivin、Caspase-3蛋白表达的变化
颅脑创伤后3d在伤侧脑组织中可见Survivin少量表达,7d达高峰,3、5、7、14d组与假手术组比较均有显著性差异(P<0.05);纳美芬治疗后1d即见Survivin表达,之后表达明显增加,5d达高峰,与颅脑创伤组各时相点相比,Survivin表达均显著升高(P<0.05)(见图2、3)。Caspase-3在伤后1d达高峰,后逐渐下降,14d时仍显著高于假手术组(P<0.05);纳美芬治疗组各时相点伤侧脑组织Caspase-3表达较颅脑创伤组均明显降低(P<0.05)(见图4、5)。
表1 纳美芬治疗前后不同时间点伤侧脑组织神经细胞凋亡率(±s,%)
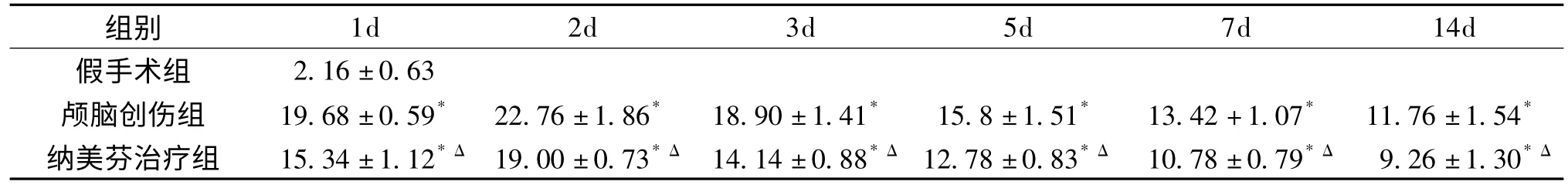
表1 纳美芬治疗前后不同时间点伤侧脑组织神经细胞凋亡率(±s,%)
与假手术组比较:*P<0.05;与颅脑创伤组比较:ΔP<0.05
组别1d 2d 3d 5d 7d 14d假手术组2.16±0.63颅脑创伤组 19.68±0.59* 22.76±1.86* 18.90±1.41* 15.8±1.51* 13.42+1.07* 11.76±1.54*纳美芬治疗组 15.34±1.12*Δ19.00±0.73*Δ14.14±0.88*Δ12.78±0.83*Δ10.78±0.79*Δ 9.26±1.30*Δ
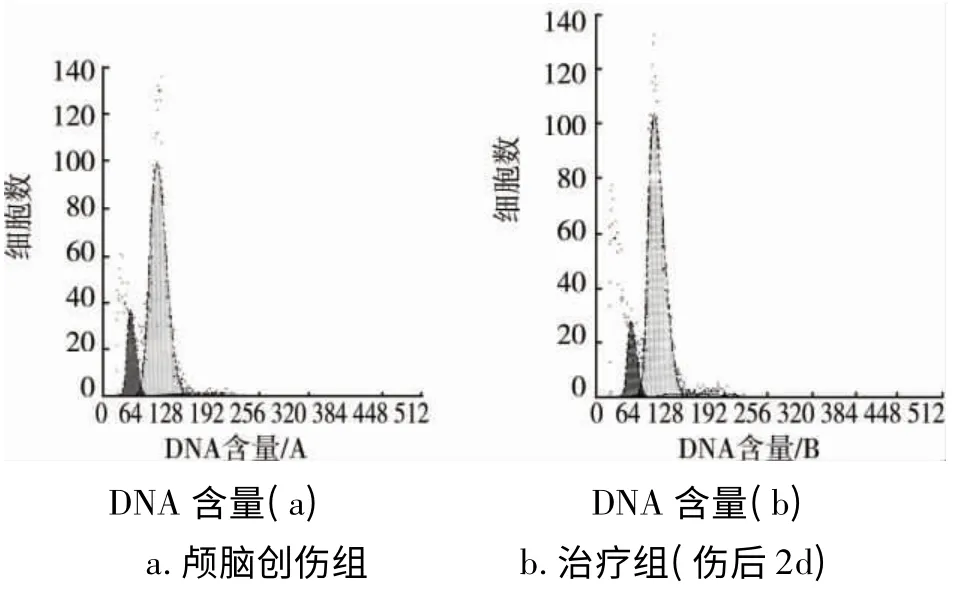
图1 流式细胞仪直方图
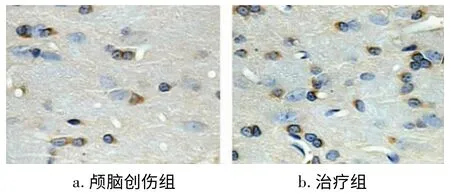
图2 伤后5d Survivin蛋白阳性表达(SP×400)

图3 各组不同时间点Survivin蛋白表达变化
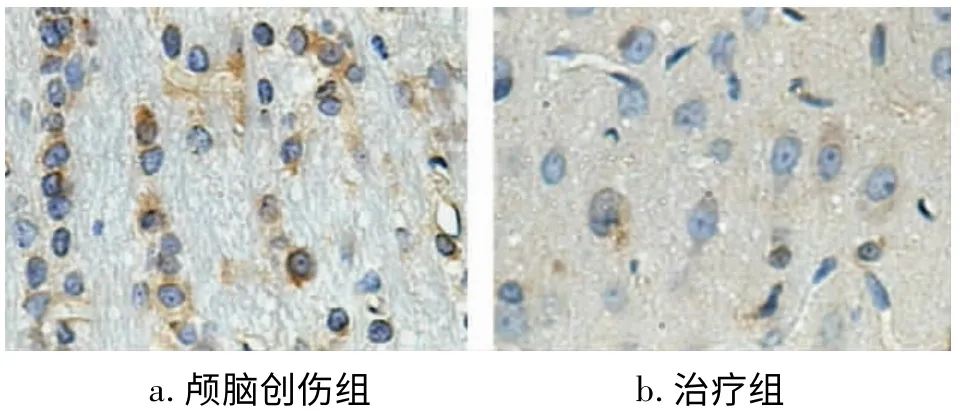
图4 伤后1d Caspase-3蛋白阳性表达(SP×400)

图5 各组不同时间点Caspase-3蛋白表达变化
讨 论
创伤性颅脑伤是临床常见的致死性疾病之一,病理生理机制非常复杂,对人类健康危害极大,主要原因是继发性脑病理改变,而颅脑损伤后的神经细胞凋亡促进了继发性脑损害的发展,导致病人预后不良[5]。因此,抗神经细胞凋亡成为创伤性颅脑伤救治的重要方面。
Caspase-3的激活是凋亡级联反应中的关键步骤,它的活化参与了脑缺氧缺血损伤后神经细胞的凋亡,并对决定细胞凋亡下游事件的激活起重要作用[6]。Survivin是凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)家族中的一个新成员,它是用效应细胞蛋白酶受体-1(effector cell protease receptor-1,EPR-1)cDNA从人类基因组库的杂交筛选中将其分离出来,位于染色体17q25,其蛋白含有142个氨基酸。Survivin在正常分化成熟组织中不表达,而在大多数肿瘤组织及颅脑创伤后存在高表达,并发现其主要通过直接抑制终末效应酶,即Caspase-3和Caspase-7的活性来阻断各种刺激诱导的细胞凋亡过程,发挥神经保护作用[1,7]。
纳美芬作为最新一代的阿片受体拮抗剂,能与脑内的阿片受体结合,竞争性阻断内源性阿片肽对神经细胞的损害,其可通过解除内啡呔对神经感觉及运动传导通路的抑制,降低抑制神经元兴奋性;减少自由基的产生和抗脂质过氧化作用,增加细胞膜的稳定性;抑制颅脑创伤时巨噬细胞的趋化活性,减少炎症介质的释放,减轻炎症反应;降低内皮素,提高降钙素基因相关肽水平,保护神经元;抑制兴奋性氨基酸释放及改善神经细胞内Ca2+紊乱,减轻其对神经细胞的损害作用;增加脑局部血流和脑灌注压,改善神经细胞的能量代谢,减轻脑水肿,而达到神经保护的作用[2,4,8-9]。但纳美芬是否可以通过上调Survivin蛋白表达发挥神经保护作用,国内外报道甚少。笔者通过观察纳美芬对实验性大鼠颅脑创伤后神经细胞Caspase-3和Survivin蛋白表达的影响,探讨其作用机制,为其临床应用提供依据。
本实验发现颅脑创伤后早期并无Survivin蛋白明显表达,但随着受伤时间的延长,Survivin蛋白表达逐渐增高,而纳美芬治疗使Survivin蛋白表达在伤后早期就出现,达峰时间早于颅脑创伤组,与颅脑创伤组各时相点相比,Survivin蛋白表达水平显著升高,且持续高水平表达。这说明在颅脑创伤后不但存在Survivin蛋白高表达,而且纳美芬治疗可促使其早期高水平表达。同时本实验发现纳美芬治疗组各时相点伤侧脑组织Caspase-3蛋白表达水平及细胞凋亡率较颅脑创伤组均明显降低,并通过相关性分析发现它们之间具有负相关性(r=-0.584,P=0.001)。笔者认为颅脑创伤后应用纳美芬治疗可增加抗凋亡蛋白Survivin的合成和分泌,抑制Caspase-3表达,从而阻断细胞凋亡过程,发挥脑保护作用。
[1]Johnson EA,Svetlov SI,Wang KK,et al.Cell-specific DNA fragmentation may be attenuated by a survivin-dependent mechanism after traumatic brain injury in rats[J].Exp Brain Res,2005,167(1):17-26.
[2]刁云锋,涂悦,张赛.纳美芬治疗急性重型颅脑创伤的疗效分析[J].医药论坛杂志,2011,32(12):16-18.
[3]江基尧,朱诚,罗其中.现代颅脑损伤学[M].上海:第二军医大学出版,2004:417-719.
[4]朱海兵,温预关,黄河清.盐酸纳美芬的药理作用及临床应用[J].广州医药,2008,39(4):1-4.
[5]Marciano PG,Brettschneider J,Manduchi E,et al.Neuron-specific mRNA complexity responses during hippocampal apoptosis after traumatic brain injury[J].Neuroscience,2004,24(12):2866-2876.
[6]Van Haren K,Voorn JP,Peterson DR,et al.The life and death of oligodendrocytes in vanishing white matter disease[J].Neuropathol Exp Neurol,2004,63(6):618-30.
[7]Van Houdt WJ,Haviv YS,Lu B,et al.The human survivin promoter:a novel transcriptional targeting strategy for treatment of glioma[J].Neurosurgery,2006,104(4):583-592.
[8]Chen CJ,Cheng FC,Liao SL,et al.Effects of naloxone on lactate,pyruvate metabolism and antioxidant enzyme activity in rat cerebral ischemia/reperfusion[J].Neurosci Lett,2000,287(2):113-116.
[9]胡枢坤,黄峰平,郑康.纳美芬对脑肿瘤术后的脑保护作用[J].国际神经病学神经外科学杂志,2011,38(4):319-322.

