T2校正1H-MRS定量分析慢性丙型肝炎肝脂肪变程度的研究
石 喻 夏 菲 张 兰 卞胜昕 郭启勇
T2校正1H-MRS定量分析慢性丙型肝炎肝脂肪变程度的研究
石 喻1夏 菲2张 兰1卞胜昕1郭启勇1
目的 探讨T2校正1H-MRS定量分析慢性丙型肝炎患者肝脂肪含量(HFC)的可行性。资料与方法 应用3.0T1H-MRS定量测量43例慢性丙型肝炎患者的HFC,评价HFC与组织学结果及代谢物指标的相关性,分析不同丙型肝炎基因型之间HFC的差异。结果1H-MRS测量的丙型肝炎的HFC范围为1%~29%,与病理分级呈正相关(r=0.71, P<0.01);HFC与稳态模型胰岛素抵抗指数(r=0.43, P<0.05)、稳态模型β细胞功能(r=0.42, P<0.05)、体重指数(r=0.41, P<0.05)、丙氨酸氨基转移酶(r=0.38, P<0.05)和天冬氨酸氨基转移酶(r=0.56, P<0.05)均呈正相关;HFC与肝纤维化程度无相关性(r=-0.03, P>0.05)。患者基因型包含1b型23例,2a型14例,混合型6例,不同丙型肝炎基因型之间HFC差异无统计学意义(χ2=0.37, P>0.05)。结论1H-MRS可准确定量分析慢性丙型肝炎患者的HFC,适合临床工作。
肝炎,丙型,慢性;脂肪肝;磁共振成像;磁共振波谱学
氢质子磁共振波谱(1H-MRS)是一种简单、无创的定量检测肝脂肪含量(HFC)的方法,其诊断非酒精性脂肪肝具有极高的准确性,甚至可以取代肝脏穿刺[1]。慢性丙型肝炎患者约50%~80%合并不同程度的脂肪肝,评估和干预患者的脂肪肝程度有助于恰当地诊治慢性丙型肝炎[2,3]。丙型肝炎脂肪肝的发生与基因型、机体代谢紊乱密切相关,并可能与肝内纤维化互为因果、相互促进[2-4]。1H-MRS能否在复杂的病理背景下准确诊断其脂肪肝的程度及尚存在一定争议[3,4]。因此,本研究旨在探讨1H-MRS定量评价丙型肝炎脂肪肝的能力,分析不同基因型、机体代谢指标、纤维化分期与脂肪肝程度的相关性。
1 资料与方法
1.1 研究对象 纳入2010-01~2011-12中国医科大学附属盛京医院慢性丙型肝炎住院患者,病程超过6个月,所有患者入院时均未行干扰素治疗,丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)持续升高,同时伴有血清丙型肝炎病毒(HCV)抗体及HCVRNA阳性。排除酒精性脂肪肝或者酗酒史患者、慢性乙型肝炎、药物性肝病、自身免疫性肝病和肝豆状核变性等其他肝病所致肝炎者,未行HCV基因分型检测、基因检测无法分型者,无肝脏穿刺活检结果或未行MRI检查者。最终入选43例,男24例,女19例;平均年龄(42.1±11.7)岁,均于活检前1周内行MRI检查。计算体重指数(BMI),BMI=体重/身高2(kg/m2)。
1.2 仪器与方法 采用GE Signa Excite HD 3.0T超导型磁共振成像系统,8通道torsopa相控阵线圈联合并行采集技术,加呼吸门控,采集轴位T1WI、T2WI和脂肪抑制序列,冠状面FIESTA序列。1H-MRS数据采用点分辨波谱分析法,TR 1500 ms,TE 35 ms,轴位T2WI定位,体素尽量选择肝实质,避开肝内血管及胆管区域,激励次数8次。体素大小为30 mm×30 mm×30 mm,在体素周围施加一定宽度的饱和带,以消除血管搏动、骨骼、气体等对体素产生的影响。
1.3 血清学及基因型检查 患者于清晨抽取空腹静脉血检测胰岛素、血糖、血脂、ALT、AST、三酰甘油、总胆固醇。采用稳态模型胰岛素抵抗(HOMA-IR)和稳态模型β细胞功能(HOMA-β)评价个体的胰岛素抵抗水平和胰岛β细胞功能。HOMA-IR=空腹血糖水平(mmol/L)×空腹胰岛素水平(mU/L)/22.5;HOMA-β=20×空腹胰岛素水平(mU/L)/[空腹血糖水平(mmol/L)-3.5][5]。参照Okamoto法[6]采用C区型特异性引物PCR法检测HCV基因分型。
1.4 图像分析 利用GE SAGE 7波谱分析软件和插件,将谱线拆为6条原始谱线,得到不抑水和抑水的平均谱线。采用不抑水谱线计算水的峰下面积,采用抑水谱线计算脂质的峰下面积。采用经验T2校正值,T2水=34 ms,T2脂=68 ms[7],校正峰下面积=测量峰下面积/exp(-TE/ T2)[8]。HFC=S脂/(S脂+S水),S脂为位于0.7~1.7 ppm的甲基(CH3)和亚甲基(CH2)脂肪峰下面积之和,S水为位于4.0~5.4/ppm的水峰面积。
1.5 病理分级 行肝脏穿刺活检并行HE染色,肝纤维化使用Scheuer分期[5]标准,分为S0、S1、S2、S3、S4期。肝脂肪变程度根据小泡性脂肪变及大泡性脂肪变程度之和,可分为无脂肪肝0,轻度0~10%,中度11%~30%,重度31%~100%。由2位经验丰富的病理科医师采用盲法独立阅片,诊断不一致时重复阅片并达成共识。
1.6 统计学方法 采用SPSS 13.0软件,各指标间的相关性采用Pearson相关分析,HFC组间两两比较采用Mann-Whitney U检验,不同丙型肝炎基因型间HFC比较采用非参数Kruskal-Wallis检验,P<0.05表示差异有统计学意义。
2 结果
2.1 HFC对脂肪肝程度的定量诊断 患者平均BMI为(24.65±3.36)kg/m2,其中20例(46.5%)超重(BMI≥23.9 kg/m2),AST和ALT分别为(48.02±22.69)U/L和(72.02±24.74)U/L。HOMA-IR和HOMA-β分别为(3.93±0.88)mU·mmol/L2和(185.88±59.98)mU/ mmol。病理结果:无脂肪肝14例,轻度脂肪肝14例,中度脂肪肝9例,重度脂肪肝6例。不同脂肪肝分级下的1H-MRS谱线见图1~3。1H-MRS所测HFC为1%~29%,病理肝脂肪变的程度为0~66%,无脂肪肝与轻度脂肪肝、轻度与中度脂肪肝HFC差异有统计学意义(U=11.5, P<0.01; U=22.5, P<0.05);中度与重度脂肪肝差异无统计学意义(U=19.5, P>0.05)。见图4。
2.2 HFC及各代谢物指标的相关性 病理脂肪肝分级(r=0.71, P<0.01)、AST(r=0.56, P<0.05)、ALT(r=0.38, P<0.05)、HOMA-IR(r=0.43, P<0.05)、HOMA-β(r=0.42, P<0.05)、BMI(r=0.41, P<0.05)与HFC均呈正相关,肝纤维化程度与HFC无相关性(r=-0.03, P>0.05)。BMI与HOMA-IR(r=0.52, P<0.05)、HOMA-β(r=0.36, P<0.05)呈正相关,肝纤维化分期与HOMA-IR(r=0.53, P<0.01)、HOMA-β(r=0.56, P<0.01)呈正相关。
2.3 丙型肝炎基因型与HFC的关系 HCV患者包含基因型1b型23例,2a型14例,混合型6例。不同基因型间HFC差异无统计学意义(χ2=0.37, P>0.05)。

图1

图2

图3
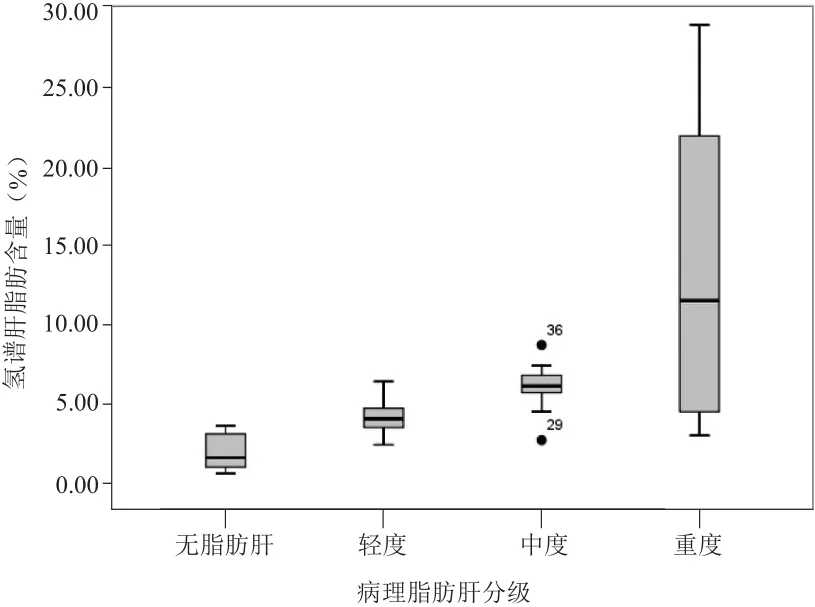
图4 不同病理脂肪肝程度分级1H-MRS肝脂肪含量比较
3 讨论
3.11H-MRS评价慢性丙型肝炎的肝脂肪含量 肝脂肪变是慢性丙型肝炎特征性的病理改变之一,与乙型肝炎相比,肝脂肪变更常见于丙型肝炎,一方面与丙型肝炎病毒自身特点,如HCV基因型、HCV核心蛋白相关;另一方面与机体的代谢综合征和胰岛素抵抗密切有关。丙型肝炎患者合并脂肪肝影响干扰素疗法的应答率,促进肝纤维化和炎症的进展,甚至诱发肝细胞癌的发生。因此,评价丙型肝炎患者的脂肪肝程度对指导临床用药和综合治疗具有重要意义。目前临床上常用的诊断脂肪肝的方法为CT和超声,但二者定量诊断脂肪肝的敏感度和特异度均较低,尤其是轻、中度脂肪肝[7]。磁共振同、反相位成像技术[1]对于诊断非酒精性脂肪肝有较高的敏感度和特异度,然而肝纤维化和肝硬化患者的肝内铁沉积改变了肝脏T2*值,使得该方法无法正确估计脂肪肝的程度[9],不适用于评价慢性丙型肝炎的肝脂肪含量。
1H-MRS作为一种无创性定量诊断单纯性脂肪肝的方法,具有极高的准确性,已作为“金标准”取代活检[1,9,10]。然而慢性肝炎病理特征复杂,常合并炎症坏死和纤维化,1H-MRS的诊断效能尚不明确。Krssák等[5]报道1H-MRS定量分析丙型肝炎的肝脂肪变程度同样具有较高的诊断准确性,1H-MRS所测得肝脂肪含量与病理结果的相关性较强(r=0.75, P<0.01),本研究结果(r=0.71, P<0.01)与Krssák等[5]的研究结果基本一致,其诊断效能略低于文献[7,11]报道的1H-MRS诊断非酒精性脂肪肝的能力,说明纤维化或炎症对1H-MRS检测的脂肪峰产生无明显影响。此外,本研究中HFC尚不能鉴别中、重度脂肪肝,这可能与丙型肝炎肝脂肪变程度整体偏低、大多数为轻、中度脂肪肝有关。重度脂肪肝样本量少、程度范围跨度较大,在一定程度上影响了重度脂肪肝评价的准确性,因此,1H-MRS是一种良好的评价丙型肝炎脂肪肝程度的方法,尤其对轻、中度脂肪肝效果良好。
3.2 肝纤维化程度与HFC的相关性 肝纤维化是慢性丙型肝炎最重要的病理特征之一[12],肝纤维化与1H-MRS检测HFC是否存在相关性尚有一定争议。本研究未观察到HFC与肝纤维化呈相关性,Cho等[4]认为,HFC随着纤维化严重程度的上升而下降,而Orlacchio等[3]则认为,HFC与肝纤维化程度呈明显正相关,推断肝脂肪变与肝纤维化的病理变化相互促进。上述2种方法均未进行峰下面积的T2校正,未消除水、脂T2衰减的影响,且二者的脂肪定量公式均存在缺陷,前者计算脂质的绝对值,后者的肝脂肪定量公式=S脂/S水(S为峰下面积),经Marsman等[11]证实该公式是不准确的,尤其在中、重度脂肪肝时,水峰明显下降,由于水含量下降造成测得的HFC呈现显著上升的假象,而非病理脂肪肝加重。本研究结果与Krssák等[5]的结果一致,认为尽管肝脂肪变可能影响肝纤维化的进程,但二者是否存在直接的相关性,尚需大样本研究进一步证实。
3.3 患者的基因型、机体代谢与病理结果的关系世界上普遍存在的丙型肝炎基因型包括5个[13],我国以1b型和2a型为主,这几种基因型间HFC无确切差异。Krssák等[5]纳入患者以3a型为主,并观察到该基因型的脂肪肝发生率明显高于其他型,基因3a型可引发与体重指数无关的脂肪变性,其脂肪肝发生率高达80%[14],而本研究中无一例3a型,因此排除了此类基因特异性所导致的脂肪肝。我国代表性的1b型和2a型丙型肝炎更易导致宿主发生胰岛素抵抗,产生糖脂代谢异常,IR和β细胞功能异常可能是我国丙型肝炎脂肪肝的关键性因素,而患者的体重、生活方式亦参与了脂肪肝的形成[15]。肝脂肪变对不同基因型肝炎的抗病毒治疗影响不一,基因3a型患者直接给予干扰素治疗即可同时改善肝内炎症、肝脂肪变的程度,而针对1b型和2a型丙型肝炎,应在抗病毒治疗的同时应用降血脂药物,可能会提高抗病毒的疗效,进而减少纤维化的可能性[5]。此外,单纯降低患者体重、改变生活方式,亦可改善肝脏脂肪变和纤维化程度[5,15]。
3.4 本研究的局限性 ①本研究样本量较少,我国丙型肝炎患者远较乙型肝炎患者少,扩大样本量尤其是收集重度脂肪肝患者,可能进一步增加研究的准确性。②个体脂质峰T2值存在细小差异,理想状态应为准确测量每例患者的T2值,但此法费时费力,不适用于临床研究。③本研究应用亚甲基和甲基峰代表脂肪峰,符合国际惯例,但亦有研究采用亚甲基单峰或多个脂肪峰面积之和计算,其区别值得深入探讨。
[1] Borra RJ, Salo S, Dean K, et al. Nonalcoholic fatty liver disease: rapid evaluation of liver fat content with in-phase and out-of-phase Mr imaging. Radiology, 2009, 250(1): 130-136.
[2] Eslam M, Kawaguchi T, Del Campo JA, et al. Use of HOMAIR in hepatitis C. J Viral Hepat, 2011, 18(10): 675-684.
[3] Orlacchio A, Bolacchi F, Cadioli M, et al. Evaluation of the severity of chronic hepatitis C with 3-T 1H-MR spectroscopy. Am J Roentgenol, 2008, 190(5): 1331-1339.
[4] Cho SG, Kim MY, Kim HJ, et al. Chronic hepatitis: in vivo proton Mr spectroscopic evaluation of the liver and correlation with histopathologic findings. Radiology, 2001, 221(3): 740-746.
[5] Krssák M, Hofer H, Wrba F, et al. Non-invasive assessment of hepatic fat accumulation in chronic hepatitis C by 1H magnetic resonance spectroscopy. Eur J Radiol, 2010, 74(3): e60-e66.
[6] Okamoto H, Sugiyama Y, Okada S, et al. Typing hepatitis C virus by polymerase chain reaction with type-specific primers: application to clinical surveys and tracing infectious sources. J Gen Virol, 1992, 73(Pt 3): 673-679.
[7] van Werven JR, Marsman HA, Nederveen AJ, et al. Assessment of hepatic steatosis in patients undergoing liver resection: comparison of US, CT, T1-weighted dual-echo Mr imaging, and point-resolved 1H Mr spectroscopy. Radiology, 2010, 256(1): 159-168.
[8] Garbow JR, Lin X, Sakata N, et al. In vivo MRS measurement of liver lipid levels in mice. J Lipid Res, 2004, 45(7): 1364-1371.
[9] Westphalen AC, Qayyum A, Yeh BM, et al. Liver fat: effect of hepatic iron deposition on evaluation with opposed-phase Mr imaging. Radiology, 2007, 242(2): 450-455.
[10] 刘帅, 赵卫东, 陈鹏, 等. 肝细胞癌1.5T1H-MRS波峰形态特征分析. 中国医学影像学杂志, 2011, 19(2): 135-138.
[11] Marsman HA, van WJ, Nederveen AJ, et al. Noninvasive quantification of hepatic steatosis in rats using 3.0 T 1H-magnetic resonance spectroscopy. J Magn Reson Imaging, 2010, 32(1): 148-154.
[12] 龙腾河, 农村立. 肝纤维化的影像学诊断. 中国医学影像学杂志, 2010, 18(4): 301-305, 309.
[13] Simmonds P, Bukh J, Combet C, et al. Consensus proposals for a unified system of nomenclature of hepatitis C virus genotypes. Hepatology, 2005, 42(4): 962-973.
[14] Castera L, Chouteau P, Hezode C, et al. Hepatitis C virusinduced hepatocellular steatosis. Am J Gastroenterol, 2005, 100(3): 711-715.
[15] Machado MV, Cortez-Pinto H. Insulin resistance and steatosis in chronic hepatitis C. Ann Hepatol, 2009, 8(Suppl 1): S67-S75.
(责任编辑 张春辉)
Quantitative Assessment of Hepatic Fat Content in Chronic Hepatitis C Using T2 Corrected1H-MR Spectroscopy
SHI Yu XIA Fei ZHANG Lan BIAN Shengxin GUO Qiyong
Purpose To quantify hepatic fat content (HFC) using T2 corrected1HMR spectroscopy (1H-MRS) in patients with chronic hepatitis C (HCV).Materials and Methods Forty-three patients with chronic HCV were assessed by1H-MRS at 3.0T. Correlations were evaluated among histological grading, metabolic indexes and HFC. The HFC differences among different HCV genotypes were also assessed.Results HFC range assessed by1H-MRS was 1%-29%, and HFC were positively correlated with pathologic steatosis stages (r=0.71, P<0.01) . HFC was also moderately correlated with HOMAIR (r=0.43, P<0.05), HOMA-β (r=0.42, P<0.05), BMI (r=0.41, P<0.05), ALT (r=0.38, P<0.05) and AST (r=0.56, P<0.05). HFC was not correlated with liver fibrosis (r=-0.03, P>0.05). In 43 patients, 23 were genotype 1b, 14 were genotype 2a, and 6 were mixed type, which showed no difference in HFC measured by1H-MRS (χ2=0.37, P>0.05). Conclusion1H-MRS is a promising method in detecting liver steatosis in HCV patients, and it is suitable for clinical application.
Hepatitis C, chronic; Fatty liver; Magnetic resonance imaging; Magnetic resonance spectroscopy
10.3969/j.issn.1005-5185.2013.01.011
1. 中国医科大学附属盛京医院放射科 辽宁沈阳 110004
2. 中国医科大学附属盛京医院感染科 辽宁沈阳 110004
郭启勇
Department of Radiology, Shengjing Hospital, China Medical University, Shenyang 110004, China
Address Correspondence to: GUO Qiyong
E-mail: guoqy@sj-hospital.org
国家自然科学基金项目(81071123)。
R512.6+3;R445.2
2012-07-19
修回日期:2012-11-09
中国医学影像学杂志
2013年 第21卷 第1期:36-39
Chinese Journal of Medical Imaging
2013 Volume 21(1): 36-39

